六君子汤乙酸乙酯提取物干预CAFs 条件培养基下EC9706 细胞能量代谢的机制研究
2023-12-13星娄翔宇尚艺婉周哲旭刘洋刘娅茹胡啸博陈玉龙
陈 星娄翔宇尚艺婉周哲旭刘 洋刘娅茹胡啸博陈玉龙
(1.河南中医药大学,郑州 450046;2.河南省中医方证信号传导重点实验室,郑州 450046)
食管癌(esophageal carcinoma, EC)是常见的消化道恶性肿瘤之一,根据2020 年中国癌症调查报告显示,食管癌是发病率排名第六位的恶性肿瘤[1]。尽管随着医疗水平的发展和进步,食管癌的五年生存率有了一定提升,但仅仅维持在18%左右[2-4]。
肿瘤细胞的生长与肿瘤微环境中存在的癌相关成纤维细胞(cancer associated fibroblasts, CAFs)关系密切。 在肿瘤微环境中,CAFs 是肿瘤微环境中含量最丰富的细胞,可为肿瘤细胞提供各种能量物质,促进肿瘤细胞生长、增殖[5-7]。 因此,CAFs 对肿瘤细胞的能量代谢有着重要作用。
前期研究发现六君子汤乙酸乙酯提取物(ethyl acetate extract of Liujunzi Decoction,EAELD)可以通过调节AMPK/mTOR 通路影响EC9706 细胞的能量代谢,抑制该细胞的活性,并增强化疗药顺铂对EC9706 细胞的疗效[8],且70%~80%细胞融合度的CAFM,含量为60%时能够明显促进EC9706 细胞的能量代谢,因此,本研究拟通过CAFs 与EC9706 细胞体外间接共培养,探讨EAELD 是否通过干预CAFs 条件培养基下EC9706 细胞的能量代谢,进而影响肿瘤细胞的增殖,为六君子汤的临床应用提供实验依据。
1 材料和方法
1.1 细胞
人食管鳞癌EC9706 细胞,由河南中医药大学分子生物中心提供,本实验室传代培养。 人癌相关成纤维细胞(CAFs),由课题组分离并鉴定。
1.2 主要试剂与仪器
DMEM 高糖培养基(货号:12100)、胰蛋白酶-EDTA 消 化 液(货 号: T1300)、 噻 唑 蓝(methyl thiazolyl tetrazolium,MTT,货号:M8180)(Solarbio 公司);胎牛血清(Lonsera 公司,货号:A97E00G);二甲基亚砜(DMSO,Amresco 公司,货号:D8370);乳酸测试盒(南京建成生物工程研究所,货号:A019-2-1);葡萄糖比色法测试盒(Elibscience 公司,货号:EBC-K234-M);XF 糖酵解速率测定试剂盒(货号:10334-100);水化液(货号:08418001)、XF96 孔细胞培养板(货号:101085-004)、基础检测培养基(货号:23217002)、XFp 细胞线粒体压力测试试剂盒(货号:103101-100,Agilent 公司);兔抗人M2 型丙酮酸激酶抗体(Pyruvate kinase isozyme type M2,PKM2,货号:4053s);兔抗人p-PKM2 抗体(货号:3827s)、兔抗人己糖激酶2 抗体(Hexokinase 2,HK2,货号:2867s)、兔抗人α-微管蛋白抗体(α-Tubulin,货号:2125s)(CST 公司)、兔抗人葡萄糖转运蛋白1 抗体(Glucose transporter 1,GLUT1,货号:YN4056)、 兔抗人单羧酸转运体- 1 抗体(monocarboxylic acid transporter 1, MCT1, 货 号:ab179832)、兔抗人MCT4 抗体(Monocarboxylic acid transporter 4,货号:ab234728)(Immunoway 公司);反转录试剂盒(Toyobo 公司,货号:117000);2×SYBR ® Green ( 武 汉 ABclonal 公 司, 货 号:RM21203)。
酶标仪(BIO-TEK 公司,型号:ELx-800);CO2培养箱(美国Thermo 公司,型号:371);超净工作台(苏净集团安泰公司,型号37997);能量代谢分析系统(美国Agilent 公司,型号:Seahorse XFe96);倒置显微镜(德国Laica 公司,型号:DFC450C);荧光定量PCR 仪(美国ABI 公司,型号:QuantStudioTM6 Flex);荧光分光光度计(美国Thermo 公司,型号:NanoDrop One);电泳仪(美国Bio-Rad 公司,型号:PowerPac Basic);凝胶成像系统(美国Bio-Rad 公司,型号:Universal Hood Ⅱ)。
1.3 实验方法
1.3.1 六君子汤乙酸乙酯部位提取
六君子汤组成参照《医学正传》,按照人参∶白术∶茯苓∶甘草∶陈皮∶半夏=1 ∶1.5 ∶1 ∶1 ∶1 ∶1.5打成粗粉混匀,以M(药物重量):V(70%乙醇体积)= 1 ∶8 比例混匀于圆底烧瓶内,设置加热温度为50℃,煮沸1.5 h 后,8 层纱布过滤药渣,重复两次。将药液静置过夜后进行浓缩,浓缩体积大约与生药总重量相当,浓缩液与乙酸乙酯体积比为2 ∶1 进行萃取,萃取6 次,合并萃取液,过滤,旋转蒸发仪回收乙酸乙酯后,水浴锅浓缩,低温真空干燥,称重,为EAELD。 经质谱分析鉴定其共有663 种物质,主要成分以2-羟基肉桂酸、4-二羟基苯甲酸、5-羟基酸橙黄酮、草黄素-8-C-葡萄糖苷(金雀花素)、高车前素-8-C-葡萄糖苷等酚酸类、黄酮类为主。
1.3.2 细胞的传代与培养
EC9706 细胞与CAFs 均采用由10%的胎牛血清和90% DMEM 含双抗的高糖培养基配制成的完全培养基进行培养,置于37℃、5% CO2的培养箱中,待细胞融合度达80%~90%进行1 ∶3 ~1 ∶5传代。
1.3.3 条件培养基的制备
取对数生长期的CAFs 细胞,根据实验所需的细胞数,用8 mL 完全培养基重悬,放入CO2培养箱中,培养24 h 后,使细胞融合度达70%~80%,1 mL PBS 洗涤后,依次加入10 mL 不含胎牛血清的DMEM 含双抗高糖培养基,继续培养48 h 后,收集培养基为CAFM,-20℃保存1 周,-80℃长期保存。
1.3.4 MTT 法检测EAELD 对EC9706 细胞增殖的影响
取对数生长期的EC9706 细胞,每孔1×104个接种于96 孔板里,置于CO2培养箱中培养24 h,用不含胎牛血清的DMEM 含双抗高糖培养基,将EAELD 工作液配制为不同浓度(0、10、20、40、60、80 μg/mL),置于CO2培养箱继续培养48 h。 按照DMEM ∶5 mg/mL MTT=9 ∶1,每孔100 μL 加入MTT工作液,4 h 后,每孔加入150 μL 的DMSO,酶标仪检测570 nm 波长下各孔吸光值,计算各组药物抑制率,选取IC30、IC50为后续实验用药,实验重复3 次。药物抑制率=(空白对照组OD 值-用药组OD 值)/空白对照组OD 值×100%
1.3.5 能量代谢分析系统检测EAELD 对CAFM 下EC9706 细胞能量代谢的影响
取对数生长期的EC9706 细胞,接种于Seahorse 96 孔板中,每孔细胞悬液80 μL,每孔8000 个细胞,每组3 个复孔。 置于CO2培养箱中培养24 h 后,根据1.3.4 中MTT 检测结果加药,选取浓度为25 μg/mL 作为低剂量组、40 μg/mL 作为高剂量组,用条件培养基配制EAELD 工作液,分别处理细胞,继续培养48 h。 不添加EAELD 的计作CAFM 组。 按照说明书,检测各组细胞能量代谢情况。 实验结果由Wave 软件分析。
1.3.6 比色法检测EAELD 对CAFM 下EC9706 细胞上清乳酸含量及葡萄糖摄取量
取对数生长期的EC9706 细胞,按照一定数量接种于6 孔板中,培养24 h 后加药(分组同1.3.5),继续培养48 h 后,收集细胞上清,1500 r/min,5 min离心,PBS 稀释3 ~5 倍。 按说明书要求进行检测,并测定条件培养基中乳酸、葡萄糖的浓度,计算加药培养后培养基中乳酸、葡萄糖含量的变化。
1.3.7 RT-qPCR 法 检 测 EAELD 对 CAFM 下EC9706 细胞能量代谢相关分子mRNA 表达的影响
细胞分组同(1.3.5),用TRIzol 提取总RNA,超微量分光光度计测定总RNA 在260 nm 和280 nm处A 值,计算RNA 浓度,以10 μL 体系进行反转录,再以10 μL 体系对c-DNA 进行扩增,以β-肌动蛋白(β-actin)为内参,用2-△△Ct计算各个样品中目的mRNA 相对表达量。 引物由郑州点睛公司设计合成,序列见表1。

表1 引物序列Table 1 Primer sequence
1.3.8 Westernblot 法 检 测EAELD 对CAFM 下EC9706 细胞能量代谢相关分子蛋白表达的影响
细胞分组同(1.3.5),以RIPA 裂解液∶蛋白磷酸酶抑制剂:蛋白酶抑制剂=100 ∶1 ∶1 的比例,配制细胞裂解液混合物,每孔加入100 μL 裂解细胞,按BCA 试剂盒说明测定蛋白浓度,98℃变性8 min,取20 μg 蛋白上样,用10%的十二烷硫酸钠-聚丙烯酰胺凝胶电泳,转膜75 min,5%脱脂牛奶室温封闭4 h,一抗HK2、PKM2、p-PKM2、GLUT1、MCT1、α-Tubulin 按照1 ∶1000 比例稀释,MCT4 按照1 ∶3000 比例稀释,孵育4℃过夜,TBST 漂洗3 次,二抗按照1 ∶1000 比例稀释,室温孵育1 h,再次漂洗3次,配制ECL 发光显影液,上机检测,显影拍照。 以α-Tubulin 为内参,使用“Image Lab”分析每组条带的光密度值,以目的条带光密度值/内参条带光密度值,计算各组蛋白相对表达量。
1.4 统计学方法
每组实验重复3 次,数据采用IBM SPSS 21.0软件进行分析,结果采用平均数±标准差(±s)进行描述。 若结果符合正态分布且方差齐,两组之间对比采用独立样本t检验;多组之间比较则采用单因素方差分析,两两对比以LSD 为统计依据。 若符合正态分布,方差不齐,以DunnettT3 为统计依据。 若不符合正态分布,则选择非参数检验。P<0.05 表示差异具有统计学意义。
2 结果
2.1 EAELD 对食管癌EC9706 细胞增殖的影响
与DMEM 组相比,除10 μg/mL 组外,不同浓度的EAELD 对EC9706 细胞的增殖均有抑制作用(P<0.05),抑制率随EAELD 浓度的升高而升高,选取25 μg/mL、40 μg/mL 分别为低浓度组、高浓度组。见图1。

注:与DMEM 组相比, *P<0.05, **P<0.01。图1 EAELD 对EC9706 细胞增殖的影响(n=3)Note.Compared with DMEM group, *P<0.05, **P<0.01.Figure 1 Effects of EAELD on EC9706 cell proliferation
2.2 EAELD 对CAFM 下EC9706 细胞能量代谢的影响
与CAFM 组相比,EAELD 低剂量组和高剂量组都能够显著降低非线粒体耗氧、基础呼吸值、最大呼吸值、合成ATP 耗氧量、备用呼吸能力、基础糖酵解、补偿糖酵解、糖酵解潜能(P<0.01),EAELD 高剂量组能够下调EC9706 细胞的线粒体耗氧与基础糖酵解比值(P<0.05)。 见表2、表3,图2。

注:A:线粒体呼吸能力;B:糖醇解速率。图2 EAELD 对CAFM 下EC9706 细胞线粒体呼吸能力和糖醇解速率影响的“海马”曲线Note.A, Mitochondrial respiratory capacity.B, Glycololysis rate.Figure 2 “Hippocampus” curve of the effect of EAELD on mitochondrial respiratory capacity and glycololysis rate of EC9706 cells under CAFM
表2 EAELD 对CAFM下EC9706细胞线粒体能力的影响(±s,n=3)Table 2 Effects of EAELD of soup on mitochondrial capacity of EC9706 cells under CAFM

表2 EAELD 对CAFM下EC9706细胞线粒体能力的影响(±s,n=3)Table 2 Effects of EAELD of soup on mitochondrial capacity of EC9706 cells under CAFM
注:与CAFM 组相比, **P<0.01。Note.Compared with CAFM group, **P<0.01.
线M粒ito体ch压ond力ri指al 标pre(spsum roe l i/nmdienx)EAELD(μg/mL)0 25 40 Non-mitocho非nd线ria粒l o体xy耗gen氧consumption 77.80±10.44 40.80±4.84** 17.00±3.03**Basal基re础sp呼ira吸tio值n value 115.40±6.89 61.00±10.85** 24.72±1.68**Maximu最m大re呼spi吸rat值ion value 162.26±9.81 79.94±10.44** 34.69±3.28**Oxygen co合ns成umpA tTioPn耗of 氧AT量P synthesis 11.16±2.15 5.41±2.3** 1.59±2.15**Spare备re用sp呼ira吸tio能n c力apacity 46.86±9.23 18.94±3.27** 9.97±3.33**
表3 EAELD 对CAFM下EC9706 细胞糖酵解能力的影响(±s,n=3)Table3 Effects of EAELD on the glycolytic capacity of EC9706 cells under CAFM
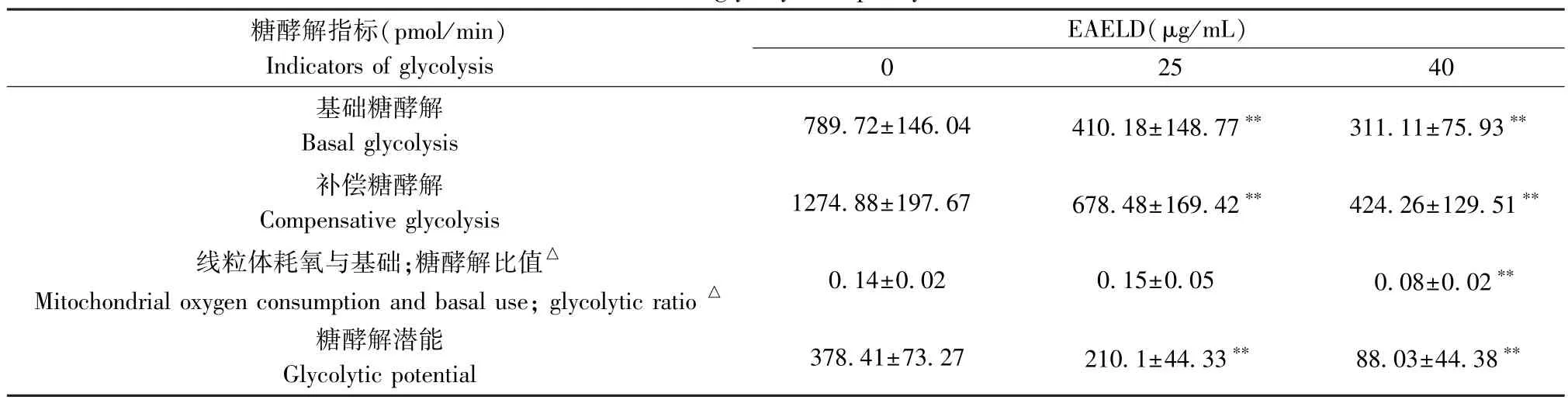
表3 EAELD 对CAFM下EC9706 细胞糖酵解能力的影响(±s,n=3)Table3 Effects of EAELD on the glycolytic capacity of EC9706 cells under CAFM
注:△表示该比值无单位。与CAFM组相比,**P<0.01。Note.△indicatestheratiohasnounit.ComparedwithCAFMgroup, **P<0.01.
糖酵解指标(pmol/min)Indicators of glycolysis EAELD(μg/mL)0 25 40基础糖酵解Basal glycolysis 789.72±146.04 410.18±148.77** 311.11±75.93**补偿糖酵解Compensative glycolysis 1274.88±197.67 678.48±169.42** 424.26±129.51**线粒体耗氧与基础;糖酵解比值△Mitochondrial oxygen consumption and basal use; glycolytic ratio △ 0.14±0.02 0.15±0.05 0.08±0.02**糖酵解潜能Glycolytic potential 378.41±73.27 210.1±44.33** 88.03±44.38**
2.3 EAELD 对CAFM 下EC9706 细胞上清乳酸含量及葡萄糖摄取量的影响
与CAFM 组相比,EAELD 高剂量组能够减少CAFM 培养的EC9706 细胞葡萄糖摄取(P<0.05),EAELD 低剂量组和高剂量组均能减少CAFM 培养的EC9706 细胞上清乳酸含量(P<0.01)。 见图3。

注:A:葡萄糖摄取量;B:上清乳酸含量。 与CAFM 组相比, *P<0.05, **P<0.01。图3 EAELD 对CAFM 下EC9706 细胞代谢物质的影响(n=3)Note.A, Glucose uptake.B, Lactic acid content of supernatant.Compared with CAFM group, *P<0.05, **P<0.01.Figure 3 Effects of EAELD on the metabolism of EC9706 cells under CAFM
2.4 EAELD 对CAFM 下EC9706 细胞能量代谢相关分子mRNA 表达的影响
与CAFM 组相比,EAELD 的低剂量组和高剂量组都能够下调GLUT1 的mRNA 表达(P<0.05,P<0.01);EAELD 低剂量组能够下调MCT1 的mRNA表达(P<0.05)。 见表4。
表4 EAELD 对CAFM 下EC9706 细胞能量代谢相关分子mRNA 表达的影响(±s,n=3)Table 4 Effects of EAELD on mRNA expression related to energy metabolism in EC9706 cells under CAFM

表4 EAELD 对CAFM 下EC9706 细胞能量代谢相关分子mRNA 表达的影响(±s,n=3)Table 4 Effects of EAELD on mRNA expression related to energy metabolism in EC9706 cells under CAFM
注:与CAFM 组相比, *P<0.05, **P<0.01。Note.Compared with CAFM group, *P<0.05, **P<0.01.
mRNA 名称mRNA name EAELD(μg/mL)0 25 40 HK2 1 0.85±0.06 1.45±0.4 PKM2 10.82±0.21 0.9±0.18 GLUT1 1 0.71±0.15* 0.64±0.07**MCT1 1 0.72±0.16* 0.99±0.14 MCT4 1 1.04±0.28 0.96±0.27
2.5 EAELD 对CAFM 下EC9706 细胞能量代谢相关分子蛋白表达的影响
与CAFM 组相比,EAELD 低剂量和高剂量组能够下调p-PKM2、HK2、PKM2、MCT1 蛋白表达(P<0.01),EAELD 高剂量组能够下调p-PKM2、GLUT1的蛋白表达(P<0.01,P<0.05)。 见表5,图4。
表5 EAELD 对CAFM 下EC9706 细胞能量代谢相关分子蛋白表达的影响(±s,n=3)Table 5 Effects of EAELD on molecular protein expression related to energy metabolism in EC9706 cells under CAFM

表5 EAELD 对CAFM 下EC9706 细胞能量代谢相关分子蛋白表达的影响(±s,n=3)Table 5 Effects of EAELD on molecular protein expression related to energy metabolism in EC9706 cells under CAFM
注:与CAFM 组相比, *P<0.05, **P<0.01。Note.Compared with CAFM group, *P<0.05, **P<0.01.
蛋白名称Protein name EAELD(μg/mL)0 25 40 p-PKM2 0.31±0.06 0.31±0.01 0.2±0.03**HK2 1.74±0.52 0.86±0.17** 0.8±0.33**PKM2 1.42±0.29 0.71±0.25** 0.42±0.2**GLUT1 0.65±0.12 0.51±0.1 0.39±0.13*MCT1 0.47±0.03 0.28±0.06** 0.23±0.08**MCT4 0.1±0.02 0.15±0.03 0.16±0.04
3 讨论
食管癌属于中医学“噎膈”病的范畴。 食管癌的发生与脾胃功能异常有着密切联系,正如《灵枢·四时气》曰:“饮食不下,膈塞不通,邪在胃脘”[9]。 脾胃失调是其主要病机,健脾和胃法是治疗“脾胃失调”这一病机的常用方法,也是食管癌的常用治法之一,其代表方为六君子汤,该方出自《医学正传》,由人参、白术、茯苓、甘草、陈皮、半夏,六味药物组成,全方共奏益气健脾、燥湿化痰之效,是治疗食管癌的常用方药,临床应用发现六君子汤具有抗肿瘤、对放化疗增效减毒、调节恶性肿瘤患者免疫功能等作用[10]。
肿瘤细胞与CAFs 细胞的能量交互,是在单羧酸转运蛋白(MCTs)的作用下,肿瘤细胞与CAFs 之间实现了乳酸、丙酮酸的高效利用[11-13],前期研究发现随着EAELD 浓度的增加,对EC9706 的抑制率也随之增加,并且调节AMPK/mTOR 通路影响EC9706 细胞的能量代谢[8],其次发现70%~80%细胞融合度的CAFs 条件培养基在60%的浓度时对EC9706 的增殖作用最明显,基于此,本研究以CAFs条件培养基培养的EC9706 细胞为对象,研究EAELD 能否干预其能量代谢。
首先采用Seahorse 能量代谢分析系统检测EAELD 对CAFs 条件培养基下的EC9706 细胞能量代谢的影响。 结果显示EAELD 的低剂量组和高剂量组均可以明显抑制在CAFM 中的EC9706 细胞糖酵解能力和线粒体呼吸能力。 由于糖酵解利用1 分子葡萄糖可生成2 分子的三磷酸腺苷(ATP),因此癌细胞需要增加葡萄糖的摄取来维持高水平的糖酵解,而EAELD 可以减少CAFM 培养的EC9706 细胞的葡萄糖的摄取与上清中乳酸的含量。
GLUT1 是转运葡萄糖的关键蛋白,GLUT1 顺浓度梯度将葡萄糖转运至细胞内,为肿瘤细胞提供代谢原料[14]。 HK2、PKM2 作为糖酵解限速酶,HK2能够与线粒体外膜的电压依赖性阴离子选择性通道蛋白1(VDAC1)相互作用并结合,促进ATP 合成相关酶的激活,增强ATP 的产生、促进糖酵解、抑制细胞凋亡,为肿瘤细胞提供合成大分子的碳源[15-17]。 PKM2 是糖酵解过程的最后一个限速酶,可将磷酸烯醇式丙酮酸快速转化为丙酮酸、加快糖酵解速率、产生更多的ATP[18-21]。 PKM2 的翻译后修饰影响着PKM2 的活性,PKM2 的酪氨酸残基105(Y105)被磷酸化后,能够促进PKM2 二聚体的形成,抑制四聚体活性,增加肿瘤细胞的生物合成,以促进肿瘤细胞的增殖[22-23]。 MCTs 能够催化L-乳酸、丙酮酸等单羧酸盐和酮体跨质膜的质子连接转运,在肿瘤代谢中起着至关重要的作用[24-25],其中MCT1 根据细胞内外的主要底物浓度以及跨质膜的pH 梯度,进行L-乳酸在质膜上的转运,而MCT4 在糖酵解活跃的组织中表达更多,主要作用是从细胞中排出乳酸[24,26],CAFs 与肿瘤细胞之间可通过MCT1、MCT4 实现乳酸的高效利用,促进糖酵解与氧化磷酸化能力的增强,促进肿瘤细胞的代谢与增殖[27-28]。 研究结果显示,EAELD 能够下调GLUT1、MCT1 的mRNA 表达,降低GLUT1、HK2、PKM2、MCT1、p-PKM2 蛋白的表达,因此EAELD 能够通过调控GLUT1、HK2、PKM2、MCT1 分子,抑制CAFs 条件培养基下EC9706 细胞的能量代谢。
此外,研究中发现MCT1、HK2、PKM2 mRNA 的水平随着EAELD 浓度的浓度升高而升高,其原因可能是MCT1 对乳酸亲和力高于MCT4,MCT4 在低氧条件下更为活跃,在缺少MCT4 的细胞中,MCT1根据细胞内外乳酸水平,决定乳酸进出细胞[29-30],由此推测在常氧环境中,EC9706 细胞主要由MCT1实现乳酸的转运。 由于肿瘤细胞的代谢途径会随环境变化而变化,有研究表明:血清饥饿后,人胶质瘤细胞U251 的氧化磷酸化水平会增加,糖酵解能力被抑制[31],因此推测肿瘤细胞在血清饥饿与EAELD 的干预下,其代谢方式主要为糖酵解,MCT1的表达升高用于转运乳酸。 而HK2、PKM2 虽然有升高趋势,但是并无统计学差异,其次从mRNA 到蛋白,中间受较多因素的调控,其中翻译效率、蛋白质的降解都会影响最终蛋白的表达,具体机制尚不明确,将进行进一步验证。
综上所述,EAELD 能够干预CAFM 下EC9706细胞的能量代谢的影响,其机制与其能够调控HK2、PKM2、GLUT1、MCT1、MCT4 的mRNA 和蛋白表达相关。 然而EAELD 调控能量代谢相关通路的机制有待进一步深入研究。
