COVID-19患者使用靶向IL-6药物的不良事件分析
——基于FAERS数据库
2023-12-13卞叶萍邓晓静
卞叶萍,邓晓静,吴 玲,徐 剑
0 引言
白介素-6(Interleukin 6,IL-6)是一种功能广泛的细胞因子,通过与膜结合型或可溶性受体结合,激活细胞信号传导途径,将多种生物信号传给不同的组织和细胞,参与多种细胞的生长、分化和功能调节,在免疫和炎症反应中具有重要作用,与多种疾病的病理生理过程密切相关[1]。研究显示,IL-6的临床适应证从关节病变为主的自身免疫性疾病延伸到巨细胞动脉炎、细胞因子释放综合征等其他多种疾病[2]。有报道,病毒感染导致机体过度炎症反应和炎性细胞因子风暴可能是新型冠状病毒感染(COVID-19)出现严重病理表现和临床表现恶化的原因[3]。COVID-19患者产生IL-6和巨噬细胞集落刺激因子,激活免疫细胞,以级联放大方式产生和分泌IL-6,形成严重的过度炎症反应;免疫细胞在杀死病毒的同时,也猛烈攻击肺泡组织中的正常细胞,导致极端的“自杀式攻击”,从而形成细胞因子风暴[4-6]。
靶向IL-6药物通过阻断IL-6相关信号传导,调控炎症反应,从而改善预后[7-9]。截至2022年底,FDA批准上市4种靶向IL-6药物:托珠单抗(Tocilizumab)、司妥昔单抗(Siltuximab)、萨瑞鲁单抗(Sarilumab)、萨特利珠单抗(Satralizumab)。托珠单抗为首个上市的靶向IL-6药物,为免疫球蛋白IgG1亚型的重组人源化抗IL-6受体单克隆抗体注射液,也是目前在FDA获批适应证最多的靶向IL-6药物[10-11],相继获批类风湿关节炎、巨细胞动脉炎、系统性硬化症相关间质性肺疾病、多关节型幼年特发性关节炎、全身型幼年特发性关节炎、细胞因子释放综合征及新型冠状病毒感染7项适应证。萨瑞鲁单抗是2017年FDA批准上市的首个直接靶向IL-6受体复合物α亚基(IL-6Rα)的全人源化单克隆抗体,免疫原性更低,但是在国内尚未上市使用[12]。萨特利珠单抗是一种pH值依赖性的人源化抗IL-6受体的单克隆抗体,于2020年由FDA批准上市。其采用再循环抗体技术,内吞入胞后在酸性条件下结合新生儿受体,使抗体免于被溶酶体降解,可再次循环使用,从而延长了药物半衰期[13]。司妥昔单抗于2014年上市,是目前FDA批准上市的唯一直接靶向作用于IL-6的拮抗剂,通过与IL-6结合,阻断IL-6与可溶性及膜结合型IL-6受体结合,从而发挥药理作用[14]。我国关于靶向IL-6药物的临床研究显示,该类药物已取得较好的治疗效果[15]。因此,在2020年3月,国家卫健委和国家中医药管理局发布的《新型冠状病毒感染诊疗方案(试行第七版)》纳入托珠单抗[16];2021年6月FDA紧急授权托珠单抗用于治疗COVID-19;2022年12月,FDA正式批准托珠单抗用于治疗COVID-19的成人住院患者。然而,针对靶向IL-6药物治疗COVID-19患者的研究以临床观察性研究为主,且因应用时间较短,其不良反应尚不明确。FAERS是药物上市后实际使用过程中的不良事件上报的公共数据库,对数据进行分析可以为临床安全用药提供重要的参考和指引。因此,本研究基于FAERS数据库,对COVID-19患者应用靶向IL-6药物的不良事件进行挖掘和探讨。
1 资料与方法
1.1 资料来源与筛选 应用靶向IL-6药物治疗COVID-19基本上集中在2020年以后,因此限定研究时间区间为2020年第1季度至2022年第4季度。从FAERS数据库下载这12个季度的ASCⅡ数据包,将数据导入到SAS 9.4软件中。先限定用药适应证为国际医学用语词典(Medical Dictionary for Regular Activities,MedDRA 25.1)编码10084268(COVID-19)、10084380(COVID-19 pneumonia)、10084451(Suspected COVID-19)、10084459(Asymptomatic COVID-19)、10084460(COVID-19 treatment)、10085503(Post-COVID syndrome),后将目标药物筛选观测词选定为“Actemra”“Atlizumab”“Tocilizumab”“Roactemra”“Siltuximab”“Sylvant”“Sarilumab”“Kevzara”“Sar153191”“Satralizumab”“Enspryng”,最后按照FAERS数据库中推荐的去除重复报告方法规则进行数据清理,删除重复数据和存疑数据后得到本研究的原始研究数据。
1.2 方法
1.2.1 数据整理及标准化 本研究选用MedDRA 25.1的系统器官分类(System organ class,SOC)及首选术语(Preferred term,PT)对药物不良事件(Adverse drug event,ADE)进行标准化阐述和分类。
1.2.2 信号强度计算及分析 目标药物与目标ADE之间的统计学关联需要通过ADE的信号强度来体现,为减少偏倚,保证敏感度和特异度,本研究采用比例失衡法中的报告比值比(Reporting odds ratio,ROR)法和贝叶斯可信区间递进神经网络(Bayesian confidence propagation neural network,BCPNN)法挖掘ADE信号强度[17],这2种计算方法均将生成1个信号确认为产生1个风险信号。通过公式分别计算出ROR值和信号指标信息成分值(Information component,IC),该数值越大,信号强度越强,表明目标药物与目标ADE之间的统计学关联越强。
2 结果
2.1 COVID-19患者使用靶向IL-6药物不良事件上报基本情况 提取FAERS数据库中2020年第1季度至2022年第4季度共12个季度的数据限定适应证为COVID-19相关诊断,在进行数据清洗剔除重复无效数据后,得到以4种靶向IL-6药物为首要怀疑药物的ADE共3 387例。4种靶向IL-6药物ADE的性别、年龄、报告者、报告国家及报告年份等基本信息见表1。结果显示,FAERS数据库中存在报告信息填写不完善的情况,出现较多未知数据;报告涉及的患者中,男性居多,年龄集中于45~65岁,上报事件来源以美国及欧洲国家为主,且呈逐年递增的趋势。
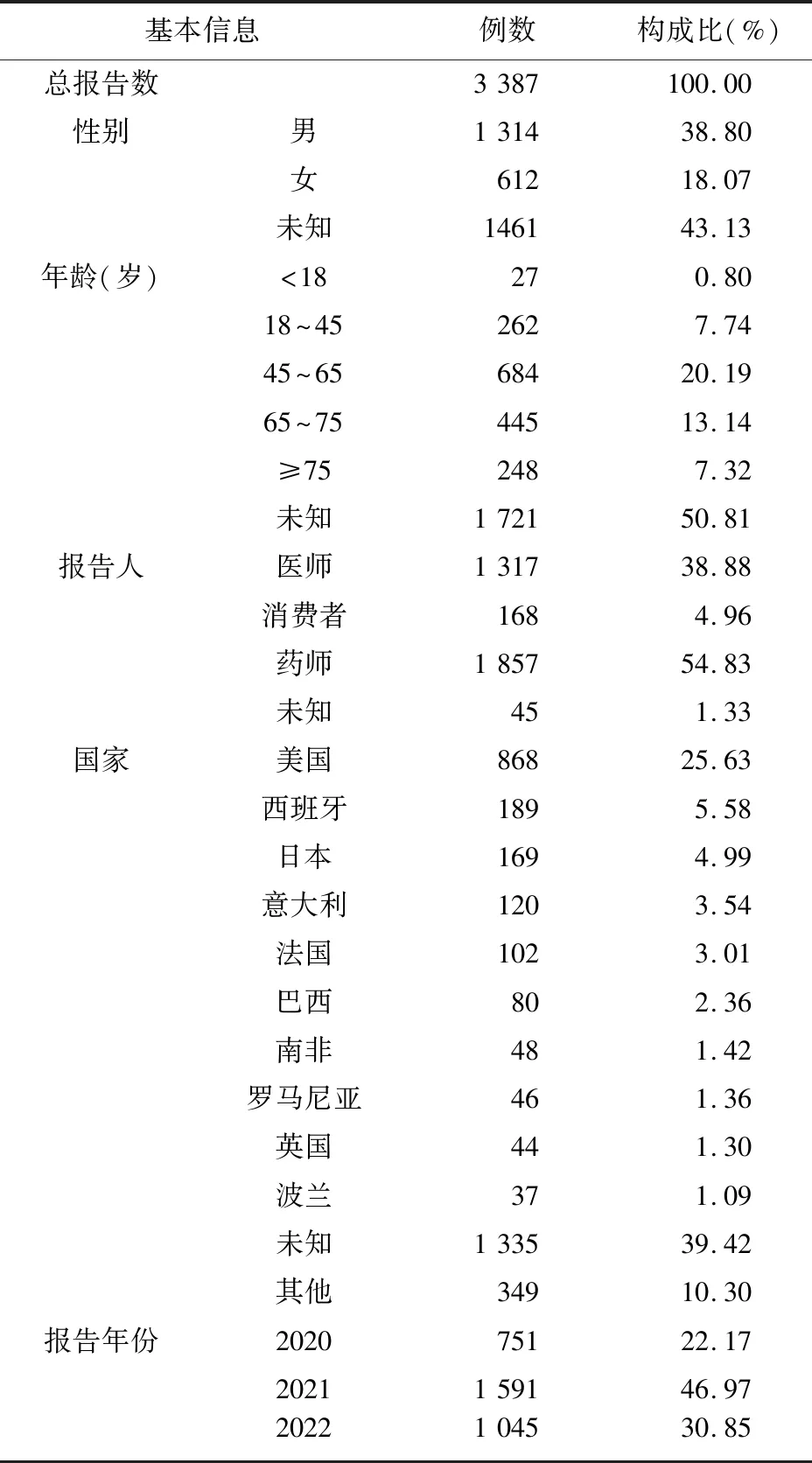
表1 靶向IL-6药物ADE报告的基本信息
2.2 COVID-19患者使用靶向IL-6药物ADE累及的SOC分析 经ROR法和BCPNN法挖掘,得到COVID-19患者使用靶向IL-6药物的ADE信号139个,涉及的ADE信号共累及15个SOC,其中含有信号个数最多的3个SOC分别为“感染及侵染类疾病”、“各类检查”及“呼吸系统、胸及纵隔疾病”。见表2。
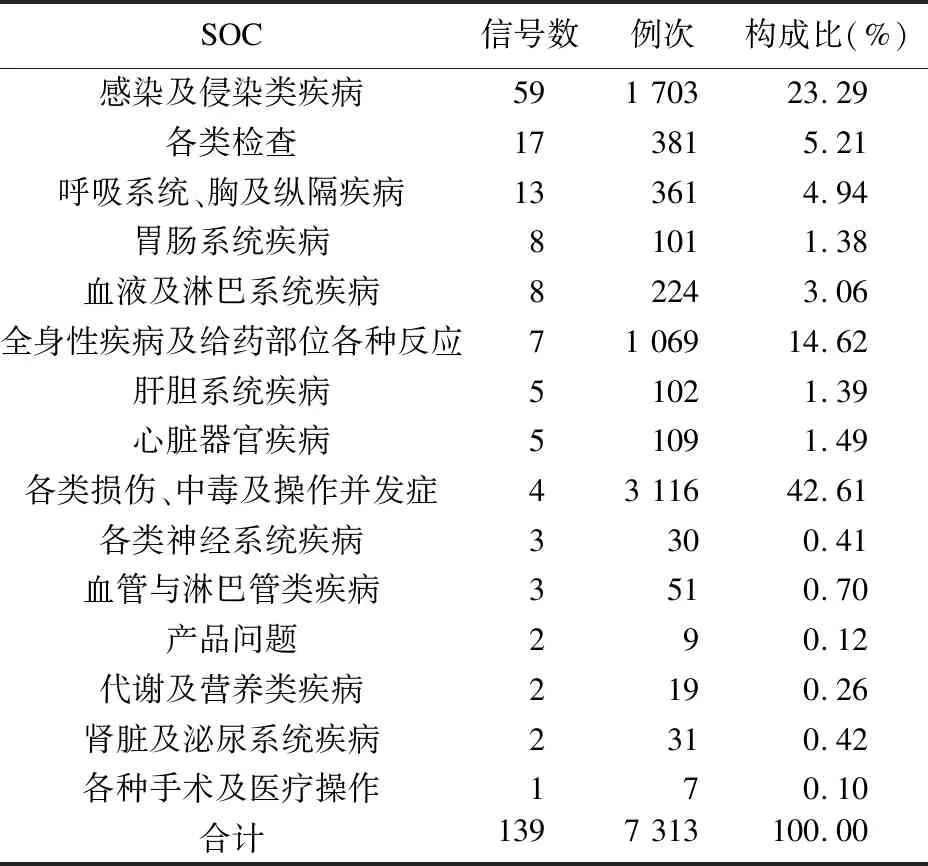
表2 靶向IL-6药物ADE累及的SOC信号数及构成比
由于FDA批准适应证中包括COVID-19的仅有托珠单抗,其他靶向IL-6药物还在临床观察性研究阶段,因此,本文主要参考托珠单抗的说明书。托珠单抗说明书中,COVID-19患者与安慰剂相比,主要不良反应为转氨酶升高、便秘、尿路感染、高血压、低钾血症、焦虑、腹泻、失眠症及恶心。将本研究挖掘筛选出的ADE累及的SOC信号与说明书对照(可能与目标药物本身关系不大的“各类损伤、中毒及操作并发症”、“各种手术及医疗操作”等不做进一步讨论),结果表明,有一些SOC信号在说明书中尚未提及,包括“感染及侵染类疾病”“呼吸系统”“胸及纵隔疾病”“血液及淋巴系统疾病”“全身性疾病及给药部位各种反应”“心脏器官疾病”“产品问题”。
对挖掘出的风险信号进行排序,筛选出报告例数前40位以及信号强度前40位的ADE,见表3及表4。其中信号强度排名前40位的ADE:①感染及侵染性疾病:感染部位涉及全身感染、肺部感染、血流感染、尿路感染、皮肤软组织感染、装置相关感染、伤口感染以及消化道相关感染等;病原学涉及真菌、细菌及病毒,细菌性以肠杆菌、变形杆菌、肠球菌、沙雷菌、葡萄球菌、不动杆菌、假单胞菌、埃希菌等为主,真菌主要为念珠菌,病毒有巨细胞病毒及单纯疱疹病毒。②各类检查:主要为病原学检查阳性,这部分与感染及侵染类疾病有所重合。 ③其他:低纤维蛋白原血症及中性粒细胞减少有较强信号,消化道穿孔、肝脏毒性也有较强信号。报告例数排名前40位的ADE与上述信号强度排名前40位的ADE相比:①超说明书使用报告例数多;②报告的死亡事件例数较多,呼吸衰竭、脓毒症、感染性休克、急性呼吸窘迫综合征、心脏停搏、多器官功能不全综合征等危重疾病报告例数也较多;③“各类检查”中以肝功能检查结果异常报告为主;④粒细胞减少、血小板减少、贫血、白细胞减少等各种血细胞减少等为“血液及淋巴系统疾病”最常见的ADE;⑤肺栓塞的报告例数在“呼吸系统、胸及纵隔疾病”中仅少于呼吸衰竭。
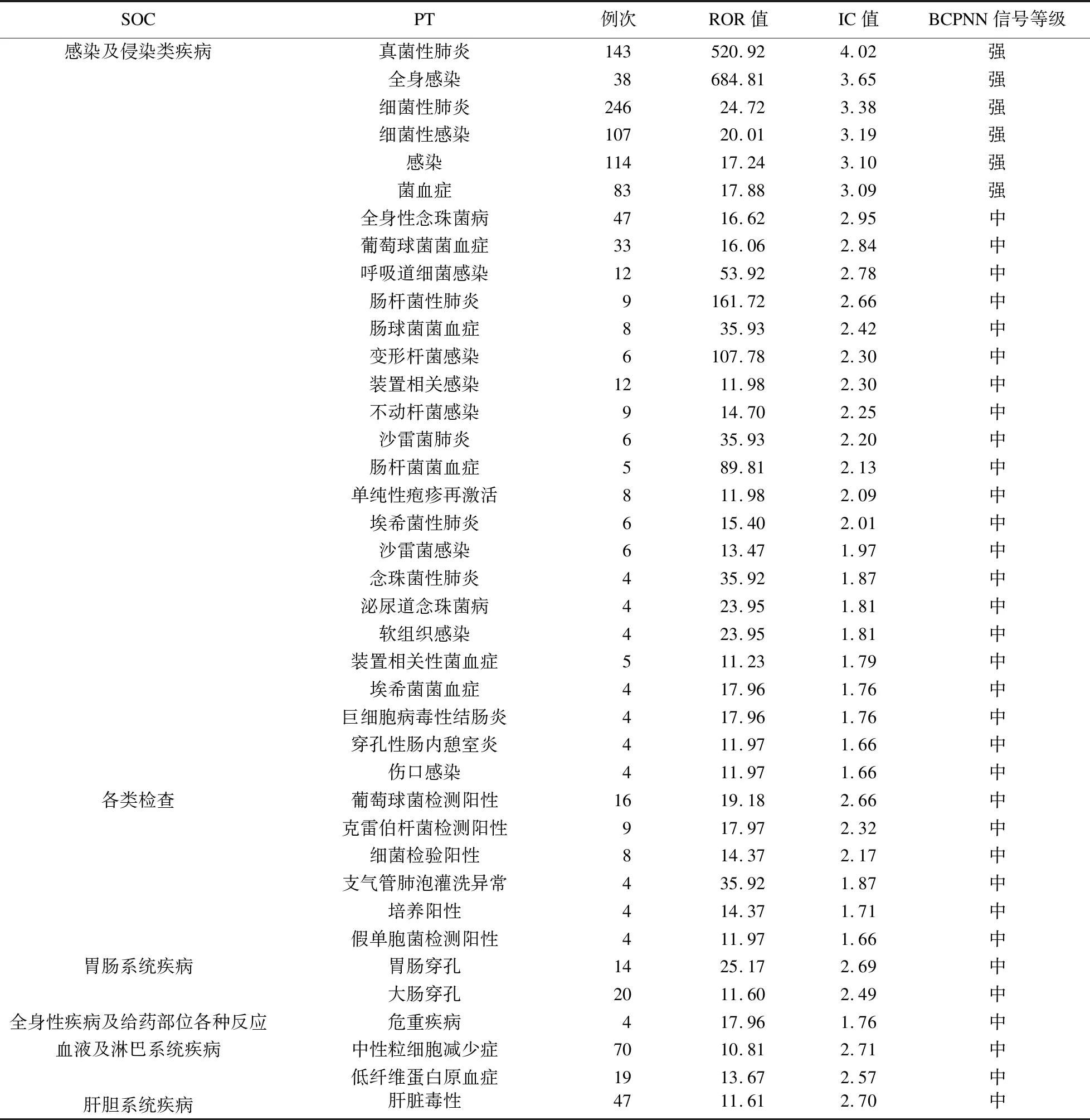
表3 信号强度排名前40位的PT及其所属SOC
3 讨论
研究表明,细胞因子风暴是导致COVID-19患者急性呼吸衰竭甚至死亡的原因之一,而IL-6是引发COVID-19患者细胞因子风暴的关键炎症因子之一,因此,阻断IL-6相关的信号传导可能用于阻断COVID-19患者的细胞因子风暴。国内外多个大规模随机对照临床研究也证实了该治疗手段的有效性[18-20]。然而,COVID-19患者使用靶向IL-6药物的不良反应尚不明确,且目前只有托珠单抗将COVID-19纳入说明书适应证,其他药物尚在临床试验阶段,因此,需要在真实世界中对COVID-19患者使用靶向IL-6药物的不良反应进行进一步探讨。
本研究收集了FAERS数据库中COVID-19患者使用靶向IL-6药物的不良事件报告,并进行真实世界研究,结果显示,ADE上报目标人群以男性患者居多,年龄主要集中于45~65岁,提示在临床应用过程中,对于这部分人群可能需要重点关注其不良反应的发生。上报事件来源以美国及欧洲国家为主,这与FAERS系统在欧美国家的使用率较高有关。上报数量逐年递增,这与靶向IL-6药物治疗逐步推广应用有关。另外,从基本信息来看,FAERS数据库中较多ADE报告存在信息填写不完整以及错误的情况,导致出现未知数据的量较大,影响分析结果。这点也为国内药物不良事件上报工作提供了一些经验,如何更好地优化上报系统、提供给用户更优的框架数据填写是不容忽视的问题。
托珠单抗说明书中,针对COVID-19应用的主要不良反应为转氨酶升高、便秘、尿路感染、高血压、低钾血症、焦虑、腹泻、失眠症及恶心[21]。本研究挖掘得到COVID-19患者使用靶向IL-6药物的ADE信号139个,涉及的ADE信号共累及15个SOC,其中含有信号个数最多的3个SOC分别为“感染及侵染类疾病”“各类检查”及“呼吸系统、胸及纵隔疾病”,除去可能与目标药物本身关系不大的“各类损伤、中毒及操作并发症”“各种手术及医疗操作”等不做进一步讨论。结果表明,有一些SOC信号是说明书中尚未提及的,包括“感染及侵染类疾病”“呼吸系统、胸及纵隔疾病”“血液及淋巴系统疾病”“全身性疾病及给药部位各种反应”“心脏器官疾病”“产品问题”。虽然在说明书中未在COVID-19患者相关事项中提及这些累及的SOC,但在其他适应证如类风湿性关节炎、全身型幼年特发性关节炎中已有阐述,可能因为COVID-19应用时间较短,且COVID-19本身就是感染性肺部疾病,全身炎症反应重,累及的器官功能较多,部分临床表现可能与不良反应重叠,无法有效鉴别出是药物不良反应还是疾病本身的表现。因此,这部分结果仅能作为风险提示,无法说明药物使用与不良事件的因果关系,需要大规模的临床研究进一步证实。
对报告例数前40位以及信号强度前40位的ADE进行分析,结果显示:①感染及侵染类疾病信号强度强、报告例数多,这与4种靶向IL-6药物的说明书不良反应的描述是一致的,也间接证实了本研究的可信度。这类药物不良反应可能与IL-6相关信号通路导致的免疫抑制和机会性感染有关。本研究目标人群是COVID-19患者,容易出现多部位及多种病原体感染,提示临床医生在使用靶向IL-6药物抑制过度炎症反应时,需要警惕二重感染的可能性。②超说明书使用报告例数较多,这与COVID-19暴发后临床研究推进和适应证的批准之间的时间差有关[18],此类报告例数随着适应证写入说明书将逐渐减少。③报告的死亡事件例数较多,呼吸衰竭、脓毒症、感染性休克、急性呼吸窘迫综合征、心脏停搏、多器官功能不全综合征等危重疾病报告例数也较多,但这部分信号强度排名较后,考虑可能与COVID-19本身导致的严重并发症有关,仅通过本研究的结果并不能完全说明是药物不良反应导致的,需要更多的随机对照研究进一步说明因果关系。④血液系统相关的血细胞减少较为常见,报告例数较多。中性粒细胞减少的信号强度排名在前列,除了病毒感染本身导致的严重骨髓抑制外,需要警惕与药物的相关性,因为在靶向IL-6药物治疗其他疾病的过程中观察到此类不良反应。⑤肝功能异常以及肺栓塞的报告例数较多,肝脏毒性及低纤维蛋白原血症的信号强度排名在前列,因此,在COVID-19患者使用此类药物过程中需要密切监测肝功能变化。另外,低纤维蛋白原血症和肺栓塞之间存在关联,信号强度及报告例数均提示其为风险程度较高的ADE,无法直接说明是药物不良反应导致的结果,未来需要进一步临床研究证实,但在临床使用过程中需要警惕这些情况。
本研究的局限性:FAERS数据库的上报数据本身存在填报信息不完善情况,因此,可能导致挖掘出的信号存在信息偏倚,结果对照部分仅选用托珠单抗的说明书也可能导致信息偏倚。另外,报告来源以美国为首的欧美国家占大多数,种族偏倚可能较大。本研究采用的比例失衡法只能从统计学上反映出目标药物与ADE的关联程度,并不能说明目标药物与ADE的因果关系,需要进一步的临床随机对照研究以及分子生物学实验进一步证实因果关系。此外,本研究尚未对风险ADE出现的原因和机制进行深入探讨。
综上所述,本研究通过对FARES数据库的挖掘分析,研究了真实世界中COVID-19患者临床使用靶向IL-6药物过程中发生的各系统ADE信号,结果发现了部分说明书尚未提及的ADE,在临床应用时,应对发生率高且信号强的ADE给予重点关注,密切监测上述指标变化,及时进行干预,减少不良反应的发生,保证用药安全。
