六味地黄汤对UUO大鼠肾组织β-catenin及EMT的影响
2023-12-12张海英高海波郭金晶
王 晖,张海英,高海波,郭金晶,裴 刚,唐 群
(湖南中医药大学 1.医学院、2.药学院,湖南 长沙 410208)
肾纤维化是各种原因引起的慢性肾脏病(Chronic kidney disease,CKD)持续发展的相同病理改变,是导致终末期肾病关键因素。其主要特征是炎症细胞浸润、成纤维细胞的持续大量活化增殖、细胞外基质(extracellular matrix,ECM)含量增多,实质细胞消失,肾组织原有的结构功能丧失[1]。EMT 在肾纤维化的进展中起重要作用,是肾纤维化的重要诱导因素[2]。全世界已有 10%~15% 的人患有 CKD[3],由于 CKD 患病率高,且能增加患心血管疾病的风险[4],成为了日益严重的公共卫生问题,但目前仍缺少特异性的治疗药物,因此有效的治疗药物对阻止 CKD 的发展至关重要。
六味地黄汤(Liuwei Dihuang decoction,LWDHD)出自北宋钱乙《小儿药证直诀》,具有抗炎、抗纤维化的作用,临床疗效明确,但其具体机制尚未明确,课题组前期研究证明LWDHD可上调 ZO-1 的表达,下调N-cadherin、Vimentin 的表达,缓解肾间质纤维化[5]。本研究旨在进一步探讨LWDHD是否通过调控 Wnt/β-catenin 信号通路抑制 EMT 干预肾纤维化,以期为其临床防治 CKD 提供实验依据。
1 材料与方法
1.1 材料
1.1.1实验动物 由湖南斯莱克景达实验动物有限公司提供 48 只 SPF 级 SD 大鼠,雄性,3月龄,体质量(200~220) g,动物许可证号:SCXK(湘)2019-0004,动物质量合格证号 ZS-202110120009。大鼠在湖南中医药大学动物中心适应性喂养 1 周后进行实验。
1.1.2实验药物 LWDHD(熟地黄 24 g,山药12 g,酒萸肉 12 g,牡丹皮 9 g,盐泽泻 9 g,茯苓 9 g),批号分别是 2205073、CK22080807、2022071401、NG22081602、2207180122、CK22081501,饮片经两次煎煮后过滤、浓缩至每 1 mL 水煎液中含有生药量约为 2 g。依那普利片购自杨子江药业集团(批号:22030111)。
1.1.3主要试剂 BCA试剂盒(AWB0104a)购自 Abiowell 公司,小鼠单克隆抗体 β-catenin(10023865)、兔单克隆抗体 α-SMA(00118182)、兔单克隆抗体 GAPDH(00113797)、Goat anti-Rabbit lgG(01F220927)均购自 Proteintech公司,兔单克隆抗体 E-cadherin(L22OC02)购自成都正能生物公司。主要仪器 化学发光成像分析仪(721BR17573,美国 Bio-Rad 公司);正置荧光显微镜(Axioscope,德国 Carl·Zeiss 公司);酶标仪(Spark 20M,瑞士 Tecan 公司);石蜡切片机(RM2235,徕卡);Pannoramic MIDI 数字玻片扫描系统(3DHISTECH 公司)。
1.2 方法
1.2.1UUO大鼠模型的建立及实验分组给药 将体质量(200~220) g的48只雄性SD大鼠随机分成 Sham 组、UUO 组、LWDHD低、中、高剂量组和依那普利组,每组8只。称质量后用 1%浓度的戊巴比妥钠溶液腹腔注射麻醉、消毒,采用俯卧位固定大鼠,在脊柱左侧 1.0 cm、髂腰点下约 0.5 cm处作一纵向长 1.5 cm 切口,逐层分离、剥离肾下极被膜,游离出输尿管后穿两根 4-0 手术线,一根靠近肾盂,另一根离肾盂 1 cm 左右结扎并从中间剪断。用注射器吸取含适量庆大霉素的生理盐水冲洗腹腔、吸净液体、逐层缝合、涂抹碘伏后放恒温垫上待大鼠苏醒,Sham 组除不结扎、不剪断输尿管外,其余步骤一致。造模 2 h后[6],根据人鼠等效计量换算并结合前期实验结果[7]给予LWDHD低、中、高剂量组(3.375、6.75 、13.5 g·kg-1)、依那普利组10 mg·kg-1相应浓度灌胃,UUO、Sham 组用同体积的生理盐水灌胃。每天1次,连续14 d。
1.2.2标本收集 实验结束将大鼠腹主动脉放血处死,取出大鼠患侧肾脏,用注射器抽取生理盐水冲洗后,沿矢状面切开,一部分置于4%多聚甲醛中固定进行后续HE、Masson 染色、免疫组化实验,另一部分剪取皮质部分装于冻存管于液氮中保存进行后续 Western blot 检测。
1.2.3HE、Masson染色 肾脏组织多聚甲醛固定 24 h,75 %、80 %、95 %、100 %乙醇梯度脱水、香柏油覆盖过夜、二甲苯透明、浸蜡3 h、包埋后置于4 ℃冰箱冷却,制成蜡块,厚3 μm切片进行后续染色。
1.2.4免疫组化染色 切片置于60 ℃融蜡箱 1 h,二甲苯脱蜡,常规复水,现配 pH 9.0的 EDTA 抗原修复液,高压锅加热 2 min 进行抗原修复,加入阻断内源性过氧化物酶阻断剂,37 ℃ 10 min,PBS 缓冲液洗 3 min×3次,滴加一抗 β-catenin(1 ∶50)、E-cadherin(1 ∶50)、a-SMA(1 ∶50)4 ℃ 冰箱孵育过夜,PBS 洗涤。滴加增强液,室温孵育 20 min,PBS 洗涤。滴加增强酶标羊抗小鼠/兔IgG聚合物,37 ℃ 20 min,PBS 洗涤。DAB 显色,浸入苏木精复染 3 min,分化 3 s、流水返蓝 1 h、脱水、透明、封片、阅片。
1.2.5Western blot 检测 取 40 mg 肾组织加入适量的 RIPA 裂解液和磷酸酶蛋白酶抑制剂放入 4 ℃研磨仪充分研磨后,离心取上清液,配置上样体系。每孔加 30~40 μg 总蛋白进行 SDS-PAGE 凝胶电泳、转膜、5% 脱脂牛奶封闭 2 h,加入 β-catenin(1 ∶5 000)、E-cadherin(1 ∶1 000)、α-SMA(1 ∶4 000)、GAPDH(1 ∶10 000)冰箱孵育过夜,TBST 洗膜 3×10 min,室温孵二抗(1 ∶15 000)摇 2 h,重复洗膜,滴加显影液曝光显影,采用 Image Lab 软件进行半定量分析。
1.3 统计学方法采用 SPSS 25.0 软件进行统计分析,多组比较采用单因素方差分析,组间两两比较采用LSD检验;若实验数据不符合正态性、方差齐性则用 Kruskal-wallis H检验。采用 GraphPad 8.0.1 绘制统计图。
2 结果
2.1 LWDHD对UUO大鼠肾脏组织结构的影响用HE 染色对大鼠肾脏组织进行染色观察,Sham 组大鼠肾小球结构清楚,肾小管集合管排列紧密规则,肾小管上皮细胞排列规整且基底膜完整;UUO 组中可见肾间质中大量炎细胞浸润,肾小球硬化,残存的少量肾小球出现代偿性肥大,大量肾小管扩张,上皮细胞扁平或有空泡变性;与 UUO 组相比,不同剂量 LWDHD 组,肾脏病变程度明显减轻(Fig 1),提示 LWDHD 对大鼠输尿管梗阻引起的肾纤维化有干预作用。
2.2 LWDHD对UUO大鼠肾脏中胶原纤维沉积的影响通过 Masson 染色对各组大鼠患侧肾组织进行染色观察,与 Sham 组相比,UUO 组大鼠肾间质可见大量染成蓝色的胶原纤维,纤维化严重;与 UUO 组相比,不同剂量 LWDHD 组肾纤维化程度减轻(Fig 2),表明 LWDHD 干预可减少输尿管梗阻引起的胶原纤维沉积,抑制肾纤维化的进展。
2.3 LWDHD对大鼠肾组织β-catenin、E-cadherin、α-SMA的影响采用免疫组化(IHC)和 Western blot 法分别对肾组织 β-catenin、E-cadherin、α-SMA 蛋白的表达位置以及表达量进行检测。IHC 结果显示:与 Sham 组相比,UUO 组大鼠肾组织中 β-catenin、α-SMA在肾小管上皮细胞胞质内表达增多,E-cadherin 的阳性表达明显减少(P<0.05);与UUO 组相比,不同剂量 LWDHD 组 β-catenin、α-SMA 阳性表达减少,E-cadherin 阳性表达增加(P<0.05)(Fig 3)。Western blot 实验结果显示:与 Sham 组相比,UUO 组大鼠肾组织中 β-catenin、α-SMA 蛋白表达增加,E-cadherin 蛋白表达减少(P<0.05);与 UUO 组相比,不同剂量 LWDHD 组 β-catenin、α-SMA 蛋白表达减少,E-cadherin 蛋白表达增加(P<0.05),该结果与免疫组化染色结果一致。结果提示 LWDHD 明显降低 UUO 大鼠肾脏中 β-catenin、α-SMA 的蛋白表达水平,升高 E-cadherin 的蛋白表达水平,使患侧肾脏的病理变化减轻,对肾纤维化有一定的治疗作用(Fig 4)。
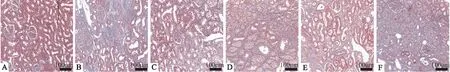
Fig 2 Masson staining results of rat renal tissue in each group(×400)

Fig 4 Expression of E-cadherin, β-catenin, α-SMA in rat renal tissue in different groups n=3)
3 讨论
肾纤维化主要有两个方面:一是肾小球硬化;二是肾间质纤维化。肾纤维化的主要特征有肾脏固有结构的损毁、成纤维细胞的激活和增殖,ECM 降解失衡导致在间质过度沉积。活化的肌成纤维细胞是合成 ECM 的主要来源,但大量研究证实在肾脏发生病变的过程中,各种细胞都会发生变化[8],其中肾小管上皮细胞经历了多种转化,最终具有肌成纤维样的细胞表型,这一过程被称为 EMT,是肾纤维化的重要机制之一[9]。在 EMT 过程中成熟的上皮细胞表型逐渐消失如 E-cadherin 表达逐渐下降,而未成熟的间充质表型明显如 Vimentin、α-SMA 表达量增加[10]。因此,抑制 EMT 的发生是缓解肾纤维化的重要环节。
EMT 的发生通常与一系列的信号通路协同作用有关,如 Wnt/β-catenin 信号通路、整合素通路、lL-6/STAT3 信号通路等[11],在成熟的肾脏中, Wnt/β-catenin 信号通路保持相对沉默的状态,当受到损伤时则被异常激活。α-SMA 和 E-cadherin 是 EMT 关键标志物。越来越多的研究表明,Wnt/β-catenin 信号通路的激活调控下游 α-SMA、E-cadherin 蛋白的表达,导致 α-SMA 蛋白表达量增加、E-cadherin 蛋白表达量减少,加速 EMT 进程,在肾纤维化的进展中发挥关键作用[12],下调 Wnt/β-catenin 信号通路可以抑制 EMT 减轻肾纤维化[13]。因此,抑制 Wnt/β-catenin 信号通路的异常持续激活是治疗 CKD 的重要策略。
LWDHD由熟地黄、山药、山茱萸、泽泻、牡丹皮、茯苓组成,组方有“三补三泻”之特点。以熟地黄滋阴补肾,填精益髓为主,辅以山茱萸补养肝肾,并能涩精,山药补益脾阴,亦能固肾,为“三补”。泽泻泻肾浊,丹皮清泻肝火,茯苓淡渗脾湿且以助山药益脾,为“三泻”。从中医角度探究肾纤维化的病机,即本虚标实,本虚指肾气虚衰,而标实以浊毒、瘀血为主[14],LWDHD的“三补三泻”起到既补肾虚,又能化痰(浊)、去瘀、毒。因此,LWDHD在临床上是用于治疗 CKD 的一种有效方剂[15]。本研究首先通过 UUO 手术方法构建大鼠肾纤维化模型,HE 染色结果显示,与 Sham 组相比,UUO组大鼠肾小球硬化、肾小管扩张,肾间质出现大量炎性细胞,不同剂量的 LWDHD 组均有不同程度的改善。Masson 染色结果显示,与 Sham 组相比,UUO 组大鼠肾间质增生,蓝色的胶原纤维增多,不同剂量的 LWDHD 组肾纤维化程度有不同程度减轻。免疫组化和Western blot实验结果显示,与Sham组相比,UUO组大鼠肾组织中 β-catenin 和α-SMA蛋白水平升高,同时E-cadherin 蛋白水平降低;与UUO组相比,不同剂量LWDHD组 β-catenin和α-SMA 蛋白表达水平下调,E-cadherin蛋白表达水平上调。该研究结果表明,LWDHD 在Wnt/β-catenin 信号通路中发挥了抑制作用,进而抑制与纤维化相关的蛋白表达和 EMT 的进展。
综上所述,本研究初步探讨了LWDHD对大鼠肾纤维化的保护作用及作用机制。结果显示 LWDHD 能改善大鼠的肾纤维化,其机制可能是抑制 Wnt/β-catenin 信号通路的异常持续激活,进而抑制 EMT 的进程缓解肾纤维化。本研究为临床防治 CKD 提供了新的思路及实验依据。
