从内质网应激研究高脂饮食对小鼠睾丸生精细胞凋亡的影响
2023-12-12周本文张长城陈思敏常言语杨焱娜付国庆赵海霞
周本文,张长城,邓 何,陈思敏,常言语,杨焱娜,付国庆,袁 丁,赵海霞
(三峡大学 1.国家中医药管理局中药药理科研三级实验室、2.基础医学院、3.健康医学院,湖北 宜昌 443002)
肥胖与饮食结构密切相关,临床研究表明,肥胖是引起男性生育能力低下的重要因素[1]。过量摄入脂肪酸会增加患弱精子症的概率;此外,精浆中总胆固醇和甘油三酯水平与精液质量呈负相关,与精子DNA碎片指数呈正相关[2]。动物研究发现,长期高脂饮食诱导的肥胖可导致小鼠[3]或大鼠[4]生殖细胞过度凋亡,进而导致睾丸组织结构损伤,精液质量下降,最终导致小鼠或大鼠生育能力低下甚至不育。因此,睾丸生精细胞的异常凋亡可能是肥胖相关的雄性生精功能障碍的关键。然而,其具体分子机制在很大程度上仍然未知。
研究表明[5],内质网应激(endoplasmic reticulum stress,ERS)与高脂饮食密切相关。而ERS对于维持睾丸正常的生殖功能发挥着不可或缺的作用,ERS损伤通常是引起睾丸精子发生异常的重要诱因[6]。然而,持续过度的ERS会诱导睾丸生精细胞凋亡,进而导致睾丸生殖功能受损,影响正常的精子发生[7]。有研究发现[8],高脂饮食可通过激活肝脏ERS诱导肝细胞凋亡。那么,高脂饮食诱导的生精细胞凋亡是否与睾丸ERS有关,还有待进一步研究。因此,本实验首先检测高脂饮食对生精细胞凋亡的影响,然后从内质网跨膜蛋白PERK、IRE1和ATF6介导的ERS的3条信号通路来研究高脂饮食对小鼠睾丸ERS的作用,初步探讨ERS在高脂饮食诱导的小鼠睾丸生精细胞凋亡中的作用机制。
1 材料与方法
1.1 动物12只5周龄无特定病原体级的C57BL/6J雄性小鼠购买并饲养于三峡大学实验动物中心,室温23 ℃~26 ℃、相对湿度60%~65%,照明系统自动控制12 h明暗交替循环。动物生产许可证号:SCXK(鄂)2017-0012。所有小鼠可进行自由进食与饮水,适应性饲养1周后分组处理。动物实验通过三峡大学动物实验伦理委员会的批准,并且按照“三峡大学实验动物护理和使用指南”开展,实验动物设施使用许可证号:SYXK(鄂)2017-0061。
1.2 试剂β-actin(AC026)购自ABclonal公司;GRP78(abs130538)购自Absin公司;p-IRE1(NB100-2323)购自Novus公司;XBP1(ab37152)、eIF2S1 (phospho S51)(ab32157)和ATF4(ab184909)购自Abcam公司;p-pERK(Thr 981)(sc-32577)和ATF6α(SC-166659)购自Santa cruz公司;Bcl-2(26593-1-AP)和Bax(50599-2-Ig)购自Proteintech公司;cleaved-caspase-12(#35965)购自Cell Signaling Technology公司;牛血清白蛋白(BSA)(154707)和anti-Rabbit lgG(H+L)(KR0023)购自武汉科瑞生物有限公司;anti-mouse lgG(H+L)(115-035-003)和Alexa Fluor488 Donkey Anti-Rabbit lgG(H+L)(711-545-152)购自Jackson immunoresearch公司;RIPA裂解液试剂盒(EXP202304)和BCA蛋白定量试剂盒(EXP202310)购自北京普利莱基因技术有限公司;ECL化学发光试剂盒(CR2204003)、4%多聚甲醛(CR2209049)和抗荧光淬灭封片剂(CR2207103)购自Servicebio公司;YF 594 TUNEL细胞凋亡检测试剂盒(T6014S)购自百赛生物公司。
1.3 仪器LEICA TP1020型全自动脱水机和LEICA EG1150H型包埋机购自德国Leica公司;YD-335型切片机购自湖北泽川科技有限公司;DP260全自动智能染色机购自深圳市达科为公司;AX224ZH/E型电子天平购自奥豪斯仪器有限公司;BX53光学显微镜购自日本Olympus公司;TYPE1500-458型酶标仪购自美国Thermo Electron公司;RX50荧光显微镜购自北京舜宇光学仪器公司;ChemiScope 6100型化学发光仪购自上海勤翔科学仪器公司;PowerPac 200型Western blot电泳仪购自英国Bio-Rad公司;DS1000型组织匀浆仪购自湖北新纵科公司。
1.4 方法
1.4.1分组给药 将12只6周龄无特定病原体级的C57BL/6J雄性小鼠按随机数字表法分为2组,即正常饮食(Normal diet,ND)组和高脂饮食(High-fat diet,HFD)组,每组6只,分笼(3~4只/笼)。HFD组小鼠给予含60%脂肪的高脂饲料喂养,ND组小鼠给予普通的维持饲料喂养,持续喂养5个月。高脂饲料(编号H10060)购于北京华阜康生物科技股份有限公司,能量配比(Kcal):脂肪占0.60,蛋白质占0.20,碳水化合物占0.20。
1.4.2小鼠体质量和睾丸指数的测定 造模结束后,所有小鼠禁食不禁水12 h,称体质量,以200 g·L-1的乌拉坦腹腔麻醉小鼠,颈椎脱臼法处死小鼠,于低温环境中迅速摘取并分离小鼠睾丸和附睾,称质量并计算睾丸指数,睾丸指数(mg·g-1)=睾丸质量(mg)/体质量(g)。
1.4.3精液分析 将两侧附睾组织迅速放入含有1 mL的生理盐水中,并将附睾组织剪碎,放置在37 ℃恒温箱中孵育3 min,使附睾中精子充分游离出来,制备精子悬液。将20 μL精子悬液和480 μL生理盐水充分混匀,取10 μL稀释后的精子悬液采用血球计数板在光镜下观察并计数精子的数量,计算精子浓度,精子浓度(mL)=计数板4象限中精子的平均数×104×稀释倍数。另取10 μL精子悬液与10 μL伊红Y溶液充分混匀后,滴加到载玻片上,染色30 s后在显微镜下观察精子的活率,计数活精子数和精子总数,计算精子活率,精子活率=活精子数/精子总数×100%。
1.4.4HE染色观察睾丸组织形态 睾丸组织脱水、包埋:睾丸组织取材后迅速放入含4%多聚甲醛的离心管中浸泡24 h,使组织充分固定。将组织转移置自动脱水机中进行脱水,脱水程序结束后将组织转移至石蜡包埋机中(提前预热包埋机),将组织放入包埋夹中制成石蜡块。石蜡切片:将组织蜡块用切片机进行切片,厚度为4 μm。HE染色和取图:采用自动染色机对组织切片进行HE染色,染色结束后立即用中性树脂进行封片。取图:将切片于光学显微镜下观察睾丸生精小管和生精上皮的形态结构并取图。根据光镜下采集的放大倍数为100倍的图片,使用ImageJ软件测量每个生精小管的直径和上皮厚度,每组统计6只小鼠,每只小鼠统计80~100个生精小管,计算平均值并进行统计分析。
1.4.5TUNEL染色检测睾丸凋亡细胞 将包埋好的睾丸石蜡块进行切片(方法同HE染色),将切片进行脱蜡水化,每个组织上加入100 μL蛋白酶K溶液,并置于37℃恒温箱孵育30 min,PBS漂洗3次,然后按照试剂盒说明书中的实验步骤进行TUNEL反应,反应结束后,将组织用PBS漂洗3次,随后DAPI复染,抗荧光淬灭剂封片,在荧光显微镜下观察,随机选取100个生精小管,计数TUNEL阳性细胞数,计算凋亡指数(凋亡指数=TUNEL阳性细胞数/100),每组统计3只小鼠。
1.4.6Western blot检测睾丸凋亡及ERS相关蛋白的表达水平 蛋白提取:使用电子天平称取20 mg的睾丸组织,加入400 μL的RIPA裂解液,放入匀浆仪中进行碾碎,然后置于冰上裂解1 h。提前预冷离心机,设置转速为12 000 r·min-1,将组织4 ℃离心10 min,收集上清液即蛋白提取完成。蛋白样品浓度的测定:于96孔板中每孔依次加入25 μL的PBS缓冲液、2.5 μL提取的蛋白母液和200 μL的BCA工作液,37 ℃恒温箱孵育30 min。采用酶标仪检测蛋白样品在562 nm处的A值,根据标准曲线计算蛋白母液的浓度。Western blot:取100 μL的蛋白液加入25 μL上样缓冲液,充分涡旋混匀,将蛋白样品于100 ℃水浴锅中加热10 min,使蛋白充分变性。将制好的蛋白样品进行电泳,转膜。将转膜完成的条带使用质量分数为5%的牛奶室温封闭1 h,然后在4 ℃孵育一抗12~14 h,TBST洗膜3次(6 min/次),室温继续孵育二抗1 h,TBST洗膜3次(6 min/次)后,最后在化学发光仪中显影。
1.4.7免疫荧光检测睾丸组织中GRP78的表达和定位 取睾丸组织切片在60 ℃烤箱中烘烤30 min,将切片浸入二甲苯中脱蜡(30 min),然后分别放入梯度乙醇(100%、95%、85%、70%)中复水(每次10 min),随后将组织切片放入柠檬酸修复液中,高压修复10 min,冷却至室温,在组织上加入质量分数为5% BSA溶液室温封闭60 min,随后去掉封闭液,在组织上加入GRP78一抗稀释液并将切片放入湿盒中,置于4 ℃孵育12~14 h。孵育结束取出湿盒,复温30 min。去掉一抗稀释液,采用PBS缓冲液漂洗5次(6 min/次)。滴加Alexa Fluor488 Donkey Anti-Rabbit lgG(H+L)抗体稀释液,在室温条件下孵育60 min,PBS浸洗30 min(同上,从此步骤开始全程均避光操作),滴加DAPI工作液染色10 min,PBS漂洗3次,每次10 min,使用抗荧光淬灭剂封片。在荧光显微镜下观察小鼠睾丸组织中GRP78蛋白的表达及定位,每个组织随机选取3~5个视野采集图像,每组检测3只小鼠。

2 结果
2.1 高脂饮食对小鼠体质量和睾丸指数的影响结果如Fig 1所示,与ND组相比,HFD组小鼠体质量明显增加(P<0.01),睾丸指数明显下降(P<0.05)。
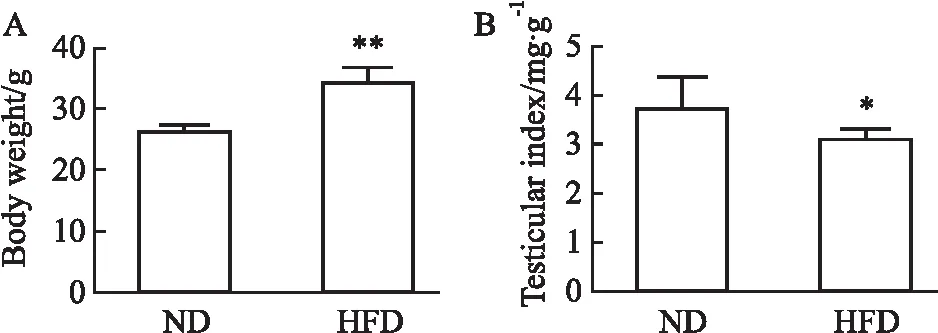
Fig 1 Effects of high-fat diet on body weight and testicular index of mice
2.2 高脂饮食对小鼠精子浓度和精子活率的影响结果如Fig 2A所示,活的精子不被伊红Y染色,而死精子则被伊红Y染成红色,与ND组相比,HFD组小鼠死的精子明显增多;统计结果显示,HFD组小鼠精子浓度(P<0.05)和精子活率(P<0.01)明显下降,见Fig 2B,C。

Fig 2 Effects of high-fat diet on sperm concentration and sperm viability of mice
2.3 高脂饮食对小鼠睾丸组织形态的影响结果如Fig 3A所示,ND组小鼠生精上皮结构完整,各级生精细胞从生精小管基底向管腔排列且紧密有序;与ND组相比,HFD组小鼠睾丸各级生精细胞排列松散、紊乱、基底层生精细胞出现脱落,生精细胞层数减少。生精上皮厚度和生精小管直径统计结果显示,与ND组相比,HFD组小鼠生精上皮厚度变薄(P<0.05),生精小管直径差异无统计学意义,见Fig 3B,C。
2.4 高脂饮食对小鼠睾丸生精细胞凋亡的影响TUNEL染色结果显示,与ND组相比,HFD组小鼠睾丸组织中TUNEL阳性的细胞明显增多。结果显示,与ND组相比,HFD组小鼠睾丸凋亡指数明显上升(P<0.01),见Fig 4。
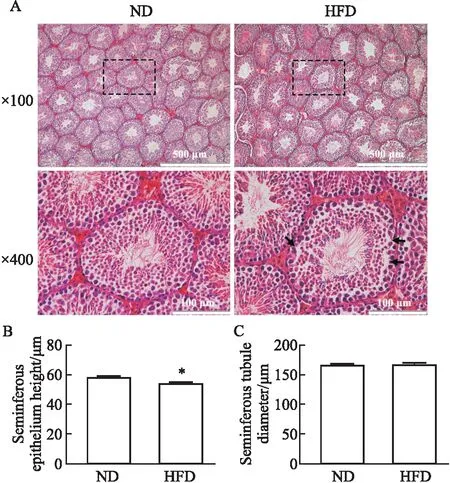
Fig 3 Effects of high-fat diet on morphology of testicular tissue of mice
2.5 高脂饮食对小鼠睾丸组织中Bax、Bcl-2和cleaved-caspase-12蛋白表达的影响采用Western blot法对睾丸组织中Bax、Bcl-2和cleaved-caspase-12的表达水平的进行检测,研究高脂饮食对小鼠睾丸生精细胞凋亡的影响,结果如Fig 5所示,与ND组相比,HFD组Bax和cleaved-caspase-12蛋白表达水平明显上升(P<0.05),抗凋亡蛋白Bcl-2表达明显下降(P<0.05),而Bax与Bcl-2蛋白表达水平的比值明显上升(P<0.01)。以上结果提示,高脂饮食可诱导小鼠睾丸生殖细胞凋亡。
2.6 高脂饮食对小鼠睾丸组织GRP78蛋白表达及定位的影响为了研究高脂饮食对小鼠睾丸ERS的影响,首先采用Western blot法检测睾丸ERS标志蛋白GRP78的表达量的变化,结果如Fig 6A所示,高脂饮食可明显上调睾丸组织GRP78蛋白表达水平(P<0.05)。随后采用免疫荧光法进一步检测睾丸生精上皮细胞中GRP78蛋白表达和定位的变化,结果如Fig 6B所示,在正常小鼠睾丸生精细胞中GRP78主要表达于生精上皮初级精母细胞的胞质中,呈圆环状包围在细胞核外侧(白色箭头所示)。与ND组相比,HFD组小鼠睾丸生精细胞中GRP78表达明显增多,表达位置无明显变化。结果提示,高脂饮食可诱导小鼠睾丸生精细胞ERS。
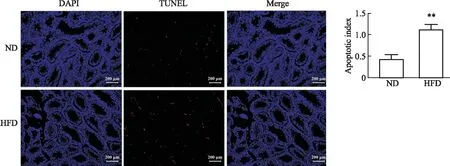
Fig 4 Effects of high-fat diet on apoptosis of germ cells
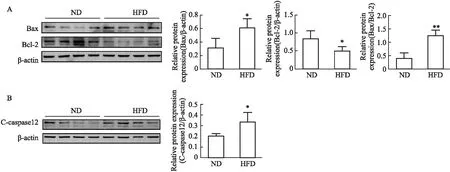
Fig 5 Effects of high-fat diet on apoptosis related protein expression of mouse testicular tissue
2.7 高脂饮食对小鼠睾丸组织PERK信号通路相关蛋白表达的影响Western blot结果显示,与ND组相比,HFD组小鼠睾丸组织中p-PERK和p-eIF2α蛋白表达有上升的趋势,但差异无统计学意义,而ATF4蛋白的表达无明显变化,见Fig 7。
2.8 高脂饮食对小鼠睾丸组织IRE1信号通路相关蛋白表达的影响结果如Fig 8所示,与ND组相比,HFD组小鼠睾丸组织中p-IRE1和XBP1蛋白的表达水平明显上调(P<0.05)。结果提示,高脂饮食可通过激活IRE1信号通路,引发睾丸ERS。
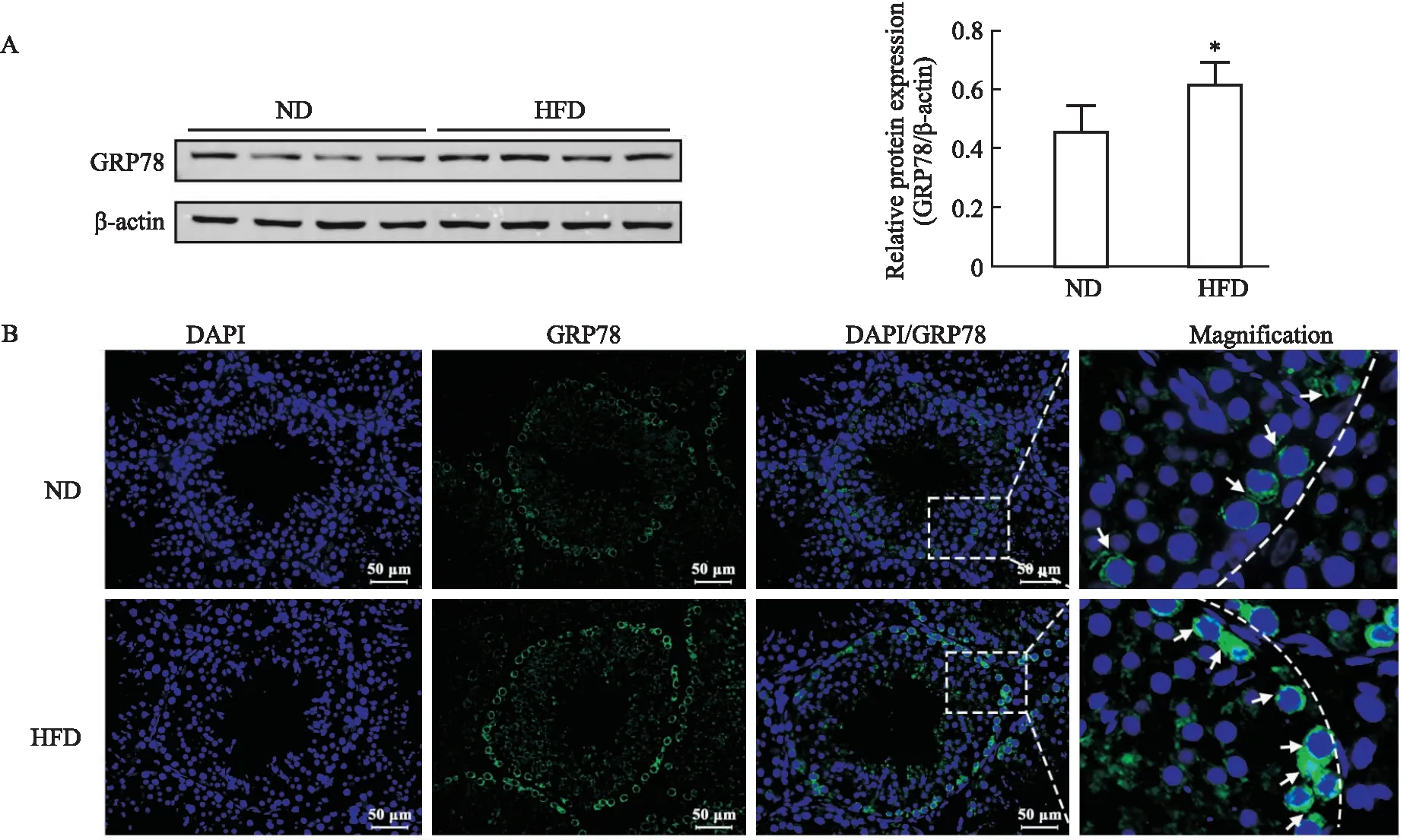
Fig 6 Effects of high-fat diet on GRP78 expression of mouse testicular or 4)

Fig 7 Effects of high-fat diet on expression of PERK signaling pathway related proteins in mouse testicular tissue

Fig 8 Effects of high-fat diet on expression of IRE1 signaling pathway related proteins in mouse testicular tissue *P<0.05 vs ND group.
2.9 高脂饮食对小鼠睾丸组织ATF6信号通路相关蛋白表达的影响结果如Fig 9所示,与ND组相比,HFD组小鼠睾丸组织中ATF6α蛋白表达水平明显上调(P<0.05)。结果提示,高脂饮食可激活ATF6信号通路。
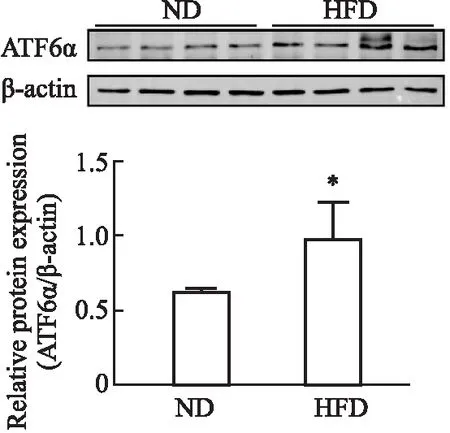
Fig 9 Effects of high-fat diet on expression of ATF6 signaling pathway related proteins in mouse testicular tissue *P<0.05 vs ND group.
3 讨论
在全球范围内,超重和肥胖的人群越来越多,约13%的成年人肥胖,并且在未来几年将继续迅速上升。肥胖与饮食结构密切相关,高脂肪高热量饮食更容易引起体质量增加,导致高脂血症,引发代谢相关等疾病,并且经常会导致雄性睾丸功能受损和生育能力低下[9]。研究表明,高脂饮食可诱导雄性小鼠和大鼠精子数量和活力降低,导致睾丸组织结构受损,生精细胞凋亡增加,进而导致其生育力受损甚至不育[10]。然而,外界条件刺激引起的生精细胞凋亡是导致雄性生殖功能障碍的关键因素之一。有研究发现,小鼠腹腔注射饱和脂肪酸棕榈酸可诱导睾丸脂质积累,生精细胞凋亡增多进而导致小鼠生殖功能障碍;体外实验亦表明棕榈酸可诱导凋亡相关蛋白Bax/Bcl-2表达的比值和cleaved-caspase-12蛋白的表达上调,导致精原细胞凋亡[11]。本研究发现,高脂饮食可诱导小鼠体质量明显增加,睾丸指数降低,小鼠精子浓度和活率明显下降,睾丸组织结构出现明显的损伤,生精细胞排列紊乱,生精上皮结构松散,基底层生精细胞脱落,生精上皮厚度变薄,睾丸组织中凋亡细胞数明显增多,凋亡指数明显增加。另外,Western blot结果显示,高脂饮食可诱导小鼠睾丸组织中凋亡相关蛋白Bax和cleaved-caspase-12的表达明显升高,而Bcl-2蛋白的表达明显下降,Bax与Bcl-2表达水平的比值明显升高。以上结果表明,高脂饮食可诱导睾丸生精细胞凋亡,进而导致小鼠睾丸功能损伤,与报道的研究结果一致。因此本实验将进一步从ERS的角度探究高脂饮食诱导睾丸生精细胞凋亡的机制。
内质网是细胞中调节蛋白质的合成与加工、脂质的生物合成、细胞凋亡和钙稳态等的重要细胞器。当细胞受到氧化应激、蛋白质错误折叠或脂质稳态失衡等刺激时,就会引发细胞ERS,进而激活细胞内的未折叠蛋白反应(unfolded protein response,UPR)信号通路。UPR通过调节下游相关基因的表达来提高内质网的应激处理能力,进而恢复内质网稳态。在正常生理水平状态下,内质网膜上的PERK、IRE1和ATF6蛋白与分子伴侣蛋白GRP78结合而处于非激活状态。当细胞内ERS发生时,GRP78就会与PERK、IRE1和ATF6蛋白发生解离,随后PERK和IRE1通过自磷酸化而被激活,进而激活下游分子;而ATF6则转移至高尔基体进而被活化,促进内质网靶基因的表达,促进细胞内稳态的维持。PERK信号通路激活能减少蛋白质的合成,IRE1和ATF6信号通路被激活能增加GRP78的合成,增强内质网对蛋白质的折叠、转运及降解。然而,当UPR不能有效缓解持续过度的ERS时,则会启动细胞凋亡程序,诱导细胞发生凋亡。caspase-12是结合在内质网膜上的天冬氨酸水解酶,在ERS诱导细胞凋亡的过程中发挥着关键作用,在ERS过程中被特异性地剪切为活化的cleaved-caspase-12,并进入到细胞的胞质中,激活caspase-3,诱导细胞进入凋亡程序[12]。
研究表明,持续过度的ERS是引发细胞凋亡的关键因素,而ERS的发生又与高脂饮食诱导的肥胖及糖尿病等代谢性疾病有密切关联[13]。有研究发现,高脂饮食可明显增加小鼠肝脏和附睾脂肪组织中GRP78的表达,通过促进GRP78与IRE1和ATF6的解离,激活IRE1和ATF6信号通路诱导持续过度的ERS,导致脂肪积累和胰岛素抵抗[14-15]。另有研究发现,高脂饮食可通过IRE1和eIF2α信号通路激活肝细胞ERS,进而诱导大鼠肝细胞凋亡[8];高脂饮食通过诱导小鼠膝关节软骨细胞中PERK信号通路相关蛋白p-PERK和ATF4以及IRE1信号通路相关蛋白p-IRE1和XBP1的表达增加,激活ERS,诱导软骨细胞凋亡[16]。本研究发现,高脂饮食可诱导小鼠睾丸组织中GRP78表达明显增加,同时,IRE1信号通路相关蛋白p-IRE1和XBP1以及ATF6信号通路相关蛋白ATF6α的表达明显上调,而PERK信号通路相关蛋白p-PERK、p-eIF2α和ATF4的表达无明显变化。然而,Xu等[17]通过体外研究发现,棕榈酸可通过激活PERK和IRE1信号通路上调p-PERK、ATF4和p-IRE1的表达激活ERS,诱导精原细胞系GC-1细胞凋亡;Mu等[11]的研究结果显示,高脂饮食可通过增加小鼠睾丸ERS相关蛋白GRP78,及ATF6和XBP1的表达诱导睾丸ERS,进而导致小鼠生精功能障碍,与本研究结果相一致,提示,高脂饮食可通过激活小鼠睾丸组织中IRE1信号通路和ATF6信号通路,诱导睾丸ERS。而Xu等[17]体外研究结果表明,棕榈酸诱导的脂毒性可激活精原细胞的PERK信号通路,诱导ERS,这可能是造模的方式不同所引起的生精细胞的损伤程度存在差异,因此,还需要后期通过体内外实验相结合的方式更加深入的研究其作用的分子机制。
综上所述,高脂饮食可通过诱导生精细胞凋亡进而导致小鼠睾丸功能障碍,与激活IRE1信号通路和ATF6信号通路诱导睾丸内质网应激有关。因此,缓解内质网应激、减轻生殖细胞凋亡可能是改善高脂饮食诱导的雄性生殖功能障碍的关键。本研究为治疗肥胖相关的雄性生殖功能障碍提供了一定实验数据和理论基础,但高脂饮食主要通过诱导哪一种生精细胞凋亡,并且抑制UPR中IRE1和ATF6信号通路是否能改善其凋亡还有待进一步研究。
