沙棘经PXR/NF-κB通路减缓免疫性肝损伤小鼠肝脏CYP2C下调
2023-12-12郝佩佩曹盈莹邹慧琼丁瑞峰白雪峰薛永志
郝佩佩,曹盈莹,邹慧琼,丁瑞峰,白雪峰,薛永志,
( 1.内蒙古科技大学包头医学院,2.内蒙古科技大学包头医学院基础医学与法医学院,3.内蒙古科技大学包头医学院第一附属医院,4.包头市肿瘤医院,内蒙古 包头 014060)
乙型肝炎病毒(HBV)感染后引起机体细胞免疫应答,一方面清除HBV,一方面引起肝损伤[1]。机体发生免疫性肝损伤,引起炎症反应,激活Kupffer细胞产生IL-1β、NF-κB等激活星状细胞,该过程是引起肝炎肝硬化中纤维组织增生和肝细胞发生癌变的重要发生机制[2-3]。在免疫性肝损伤过程中多种代谢酶表达下调,本实验之前偶然发现在免疫性肝损伤过程中CYP2C酶的活性下调[3],但其蛋白水平表达情况及其机制尚不清楚。CYP2C可以参与约30%的药物代谢[4], 其表达降低会导致其参与生物转化的药物在体内聚集,加重肝脏负担。因此,我们迫切需要寻找恢复CYP2C酶表达的药物。PXR不仅在肝损伤进展和修复及向肝细胞癌转变的过程中发挥重要作用[3-5],还可以调节肝脏中药物代谢酶CYP2C的表达[5-6]。有人提出PXR可以与NF-κB相互抑制来减轻炎症反应[6-7],Uehara等[8]证实, PXR可以通过抑制NF-κB的靶基因表达来保护DSS诱导的结肠炎,但其在免疫性肝损伤中CYP2C酶下调方面的作用尚不清楚。
已有研究证明沙棘可以通过抑制NF-κB减轻小鼠急性肝损伤[9]、脓毒症诱导的肝损伤[10],本实验室前期已证实沙棘可以改善免疫性肝损伤中CYP3A4的下调[11]。基于此我们提出沙棘可以通过调控PXR/NF-κB通路,来改善免疫性肝损伤小鼠CYP2C的下调这个假说。
1 材料与方法
1.1 材料
1.1.1实验动物 昆明种SPF级♂小鼠,体质量(18~22)g,购自斯贝福北京生物技术有限公司,动物许可证号SCXK(京)2022-0002。
1.1.2药品与试剂 沙棘颗粒(四川美大康药业股份有限公司,批号Z51020098);卡介苗(瑞楚生物,批号:202301)、PCN(APExBIO,批号C38841133C770)、玉米油(Solarbio,批号511H021);GAPDH、CYP2C、NF-κB p65抗体、PXR(NR1I2)抗体(武汉博士德生物公司,批号:BM3876、A02107-2、BA0610、A01133-3);ELISA试剂盒(江苏酶免实业有限公司,批号202209)。
1.1.3主要仪器 低温高速离心机(上海安亭科学仪器厂);凝胶成像仪(环亚生物科技);DF.D型恒压恒流电泳仪(北京市六一仪器厂);紫外-可见光全光谱分光光度计(Gene Company Limited);37 ℃恒温孵育箱(赛默飞世尔仪器有限公司);Multiskan FC型酶标仪(赛默飞世尔仪器有限公司)。
1.2 实验动物分组与模型制备
1.2.1实验动物分组 60只小鼠,随机分为control组、BCG组、BCG+SG(50、100、200 mg·kg-1)组和BCG+PCN组,每组10只。
1.2.2动物模型制备 实验小鼠适应性喂养1周后,除control组,其他各组均一次性尾静脉注射BCG 125 mg·kg-1制备免疫性肝损伤小鼠模型,BCG+SG组在(第8~14天灌胃相应剂量的SG,每日2次);将PXR的小鼠特异性激动剂PCN[8]溶于玉米油中,制备成20 g·L-1,BCG+PCN组分别在第11~14天给予腹腔注射100 mg·kg-1,每日1次。
1.3 取材第15天给予小鼠断头取血,置于肝素化的试管中,3 500 r·min-1离心20 min后,取上清液,即为血清置于-80 ℃用于后续实验,取部分相同部位肝脏组织浸泡于预先制备好的福尔马林溶液中,常规HE染色;用4 ℃生理盐水门静脉灌流冲洗后将剩余肝脏剖出,置于-80 ℃用于后续实验。
1.4 实验方法
1.4.1各组小鼠肝脏形态学观察 将小鼠肝脏置于福尔马林溶液中固定48 h后,石蜡包埋切片,HE常规染色,于显微镜下进行组织病理观察。
1.4.2小鼠血清肝功能的检测 血清丙氨酸转氨酶(alanine transarninase,ALT)、血清天冬氨酸转氨酶(aspartate aminotransferase,AST)水平检测采用ELISA试剂盒检测。提取的血清为待测样品,步骤严格按照试剂盒说明书操作。
1.4.3ELISA检测各组小鼠肝脏炎性因子TNF-α和IL-1β检测 小鼠肝脏TNF-α和IL-1β采用ELISA试剂盒检测。取小鼠肝脏组织0.1 g加入PBS 0.9 mL充分研磨匀浆后,在3 000 r·min-1离心20 min,取上清液,即为待测样品。步骤严格按照试剂盒说明书操作。
1.4.4Western blot检测各组小鼠肝组织NF-κB p65、PXR、CYP2C蛋白表达水平 用NP-40裂解液提取小鼠肝脏总蛋白,用胞浆胞核提取试剂盒提取肝脏核蛋白。利用BCA法检测肝脏组织蛋白的含量。按30 μg上样于已制好的10%胶上,电泳,将蛋白质转移至PVDF膜上,用 5%脱脂奶粉封闭1 h,放入一抗GAPDH(1 ∶2 000)、CYP2C(1 ∶200)、PXR(1 ∶500)、NF-κB p65(1 ∶100),4 ℃孵育过夜,次日敷二抗1 h,用ECL显色液显色,凝胶成像仪曝光、拍照,用ImageJ软件分析蛋白条带灰度值,计算目的蛋白相对表达量。

2 结果
2.1 各组小鼠肝脏病理变化Fig 1结果显示,control组小鼠肝索以中央静脉为中心呈放射状排列,肝小叶结构清晰可见,细胞质丰富,细胞核位于细胞中央。BCG模型组小鼠肝索排列紊乱,肝细胞出现大片状坏死,肝实质与汇管区可见大量的炎症细胞浸润。BCG+SG组小鼠与BCG模型组比较,均出现不同程度的点状坏死,肝实质及汇管区炎症细胞浸润出现不同程度的减轻,大剂量组减轻最为明显。BCG+PCN组小鼠与BCG模型组小鼠比较肝脏组织病理均出现明显的改善。

Fig 1 Effect of sea-buckthorn on liver pathology of mice with
2.2 各组小鼠血清转氨酶水平的变化Fig 2结果显示,尾静脉注射BCG制备免疫性肝损伤小鼠模型15 d后,BCG组ALT、AST水平明显高于control组(P<0.01),分别应用PXR小鼠特异性激动剂PCN及SG后小鼠血清转氨酶水平明显受到抑制(P<0.01)。
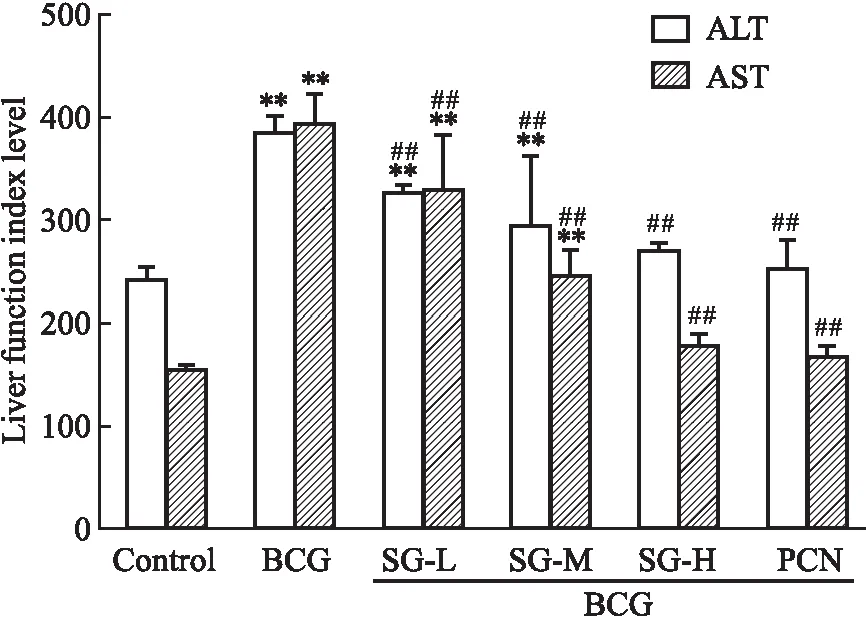
Fig 2 Effect of sea-buckthorn on serum transaminase of mice with
2.3 各组小鼠肝组织炎性因子TNF-α和IL-1β含量Fig 3结果显示,与control组相比,BCG组TNF-α和IL-1β含量均明显增高(P<0.01),BCG+PCN组、BCG+SG相较BCG组TNF-α和IL-1β含量均下降(P<0.01),提示SG和PCN可以改善肝损伤和肝脏炎症。

Fig 3 Effect of sea-buckthorn on IL-1β and TNF-α content in liver of mice with BCG-induced immune-mediated
2.4 各组小鼠肝组织NF-κB p65、PXR与CYP2C蛋白水平Western blot结果表明(Fig 4),BCG组小鼠肝脏细胞的细胞核中NF-κB p65蛋白过表达,PXR、CYP2C蛋白受到抑制(P<0.01),在用PCN进行干预后与模型组对比,NF-κB p65蛋白表达有所下降且PXR和CYP2C蛋白表达增加(P<0.01),说明PXR可以抑制NF-κB p65,促进CYP2C表达。在使用SG进行干预后,呈剂量依赖性的上调PXR、CYP2C蛋白表达,下调NF-κB p65蛋白的表达,尤其是高剂量组更加明显(P<0.01),说明SG可以通过调控PXR/NF-κB通路来改善免疫性肝损伤中CYP2C的下调。

Fig 4 Effect of sea-buckthorn on expression of PXR, NF-κB and CYP2C protein in liver of mice with BCG-induced immune-mediated liver n=10)
3 讨论
本实验采用尾静脉注射BCG制备免疫性肝损伤模型,BCG组肝脏病理呈现肉芽肿性团块,ALT、AST活性和肝脏中TNF-α、IL-1β含量升高可以得出造模成功,可用于后续实验。乙肝患者肝损伤与T淋巴细胞介导的细胞免疫有关[2]。在感染HBV后Th1相关的细胞因子TNF-α在机体清除HBV和导致肝损伤方面发挥核心作用[12]。在BCG诱导的免疫性肝损伤中Th1型细胞因子TNF-α同样发挥重要作用[13],与乙型病毒性肝炎发生肝损伤的发病机制相似,常被用来慢性乙型肝炎相关研究。
之前提到在BCG诱导的免疫性肝损伤过程中CYP2C酶活性下调。从本实验的结果可以得到,在BCG诱导的免疫性肝损伤小鼠中肝脏CYP2C酶在蛋白水平降低。既往国内外研究多集中在其基因多态性发面,本实验证明影响其表达的因素不仅仅局限于基因多态性这个因素,肝炎肝损伤也是影响其表达的重要因素。在应用PXR的特异性激动剂后,进一步研究证明,PXR可以抑制NF-κB p65表达来减缓免疫性肝损伤小鼠肝脏CYP2C的表达,下调其下游炎性因子TNF-α和IL-1β表达来减轻肝炎、肝损伤,与之前提出的PXR可以通过抑制NF-κB p65来减轻炎症一致[7]。PXR是一种配体依赖的转录因子,不仅可以调节药物代谢和异常情况下葡糖糖、胆汁酸的代谢,还在炎症、癌症等疾病方面发挥重要作用[7]。正常状态下PXR无生物活性,当与配体结合后与RXR结合形成异二聚体,调控靶基因的表达[6,14]。PXR在免疫性肝损伤中不仅可以减轻肝损伤,还对CYP2C的下调发挥重要作用。SG是由沙棘和葡萄糖组成,可以用于研究沙棘方面的实验,其已用于临床,主要治疗止咳祛痰、消食化滞、活血散瘀,但其对免疫性肝损伤方面研究较少。本实验在应用沙棘对免疫性肝损伤小鼠进行干预后,PXR、NF-κB p65和CYP2C蛋白的表达均有所恢复,且肝脏病理显示炎症减轻,血清转氨酶下降。证明SG可以通过调控PXR/NF-κB通路,来减缓免疫性肝损伤小鼠中CYP2C的下调和减轻肝损伤,为免疫性肝损伤中代谢酶的下调提供新的思路。
之前有学者提出,CYP2C参与代谢的产物类花生酸有抗炎作用[15],还可能与肝细胞癌(HCC)的发生、预后有关,其表达降低促进HCC的发生和发展[4]。本实验采用BCG诱导免疫性肝损伤模型,而免疫性肝损伤是HCC的重要发生机制[16],BCG组肝实质区和汇管区有大量的炎症细胞浸润,当给予沙棘干预后,CYP2C的表达增加,病理结果显示肝脏炎症也同样减轻。由此我们猜想CYP2C可能在肝脏炎症消退过程中发挥着重要作用,并且还可以通过减轻免疫性肝损伤来减缓乙肝向HCC发展的进程。沙棘减轻肝炎肝损伤可能不仅仅是通过PXR/NF-κB通路下调其下游炎症因子TNF-α和IL-1β来达到此效果,也能与其可以恢复CYP2C的表达有关。但本实验有一定的局限性,后期我们会使用基因敲除技术来对上述猜想进行实验验证。
综上所述,沙棘可以通过调控PXR/NF-κB通路,来减缓免疫性肝损伤中CYP2C的下调。
