氟唑帕利治疗铂敏感型复发性上皮性卵巢癌的疗效及安全性
2023-12-12王灵芝范丽丽吴向辉薛秀珍
王灵芝,范丽丽,吴向辉,薛秀珍
(河南科技大学第一附属医院妇产科,河南 洛阳 471000)
卵巢癌发病率仅低于宫颈癌和子宫内膜癌,居于妇科恶性肿瘤的第3位;但卵巢癌的病死率却超过宫颈癌和子宫内膜癌,高居妇科癌症之首,严重威胁女性健康[1-3]。 卵巢癌90%以上是上皮性卵巢癌,早期症状不明显,70%左右的患者就诊时已是晚期,治疗难度大且预后不佳。虽然,近些年出现了一些新的、疗效好、靶向性强的抗肿瘤药物,但卵巢癌患者5 a生存率依旧仅有40%左右[4-5]。卵巢癌经过初次细胞减灭术和术后标准化的化学治疗后仍有超过2/3复发,这也是导致卵巢癌患者预后不佳的主要原因[6]。复发性卵巢癌治愈概率很小,治疗的主要目的是缓解症状,减少并发症,延长患者无进展生存期。近几年来,随着多腺苷二磷酸核糖聚合酶(polyadenosine diphosphate ribose polymerase,PARP)抑制剂的问世和临床应用,卵巢癌的治疗进入了一个全新的模式,从以往“手术+化学治疗+观察等待”模式进入到了“手术+化学治疗+维持治疗”的全程管理模式,使得卵巢癌迈入了精准治疗时代[7-9]。本研究旨在探讨PARP抑制剂氟唑帕利治疗铂敏感型复发性上皮性卵巢癌的疗效及安全性,以期为临床铂敏感型复发性上皮性卵巢癌的治疗选择提供参考。
1 资料与方法
1.1 一般资料
选择2019年1月至2020年12月河南科技大学第一附属医院收治的铂敏感型复发性上皮性卵巢癌患者107例为研究对象。病例纳入标准:(1)符合复发性上皮性卵巢癌诊断标准[10],以往接受以铂类为主或紫杉醇联合铂类的一线化学治疗,且临床已获得临床缓解,患者又出现下列情况中至少一项:查体、磁共振成像或CT等影像学检查发现包块;胸腹水;肿瘤标志物如CA125水平升高;不明原因的肠梗阻[11]。(2)从最后1次铂剂量开始至进展期的时间间隔至少6个月。(3)预计生存期>3个月。(4)签署知情同意书者。排除标准:(1)合并其他恶性肿瘤者;(2)已发生远处转移者;(3)合并有严重肝、肾功能障碍者;(4)对本研究药物过敏者;(5)曾有肿瘤相关出血病史者等。根据治疗方式将患者分为对照组(n=50)和观察组(n=57)。对照组:年龄46~77(62.88±6.49)岁;组织类型:浆液性38例,黏液性6例,子宫内膜样3例,透明细胞癌3例;国际妇产科联盟(Federation International of Gynecology and Obstetrics,FIGO)分期:Ⅰ期10例,Ⅱ期9例,Ⅲ期31例。观察组:年龄45~78(63.55±6.76)岁;组织类型:浆液性45例,黏液性4例,子宫内膜样6例,透明细胞癌2例;FIGO分期:Ⅰ期8例,Ⅱ期11例,Ⅲ期38例。2组患者的年龄、组织类型及FIGO分期等一般资料比较差异无统计学意义(P>0.05),具有可比性。本研究符合《赫尔辛基宣言》,且已获得医院医学伦理委员会批准。
1.2 治疗方法
对照组采用紫杉醇联合铂类一线化学治疗方案,第1 天,静脉滴注紫杉醇注射液(北京协和药厂,国药准字H20083786,规格:10 mL60 mg)135 mg·m-2;第1~3 天,静脉滴注顺铂(江苏豪森药业集团有限公司,国药准字H20040813,规格:6 mL30 mg)50~60 mg·m-2,顺铂在化学治疗前后均予以水化; 21 d为1个化学治疗周期。观察组在对照组基础上给予氟唑帕利胶囊(江苏恒瑞医药股份有限公司,国药准字H20200014,规格:50 mg)口服,每次150 mg,每日2次,连续治疗至疾病进展或出现不可接受的毒性反应。2组患者均连续接受3个化学治疗周期。
1.3 观察指标
(1)临床疗效:依据世界卫生组织实体瘤疗效评价标准(response evaluation criteria in solidtumors,RECIST 1.1)[12]评估2组患者化学治疗3个周期后的临床疗效,分为完全缓解(complete remission,CR)、部分缓解(partial remission,PR)、疾病稳定(stability disease,SD)和疾病进展(progression disease,PD),计算疾病控制率(disease control rate,DCR)和客观缓解率(objective remission rate,ORR), DCR=(CR例数+PR例数+SD例数)/总例数×100%,ORR=(CR例数+PR例数)/总例数×100%。(2)生存情况:每月进行1次电话或微信随访了解患者生存情况,2组患者均随访至首次化学治疗后2 a,统计2组患者的疾病无进展生存期(从化学治疗开始至疾病进展或患者死亡的时间)及1、2 a生存率。(3)健康状况:采用卡氏(Karnofsky performance status,KPS)评分[13]评估化学治疗前及化学治疗3个周期后2组患者的健康状况,KPS评分0~100分,分值越高代表患者健康状况越好。(4)不良反应:按照美国国家癌症研究院不良事件通用术语标准版本[14]评估2组患者化学治疗期间不良反应发生情况及严重程度,包括血液系统毒性(如贫血、血小板减少症、中性粒细胞减少症、白细胞减少症、淋巴细胞减少症)和非血液系统毒性[如恶心、呕吐、乏力、食欲减退、血肌酐升高、丙氨酸转氨酶(glutamic pyruvic transaminase,ALT)升高]。
1.4 统计学处理

2 结果
2.1 2组患者的临床疗效比较
化学治疗3个周期后,观察组患者的DCR和ORR显著高于对照组,差异有统计学意义(χ2=5.420、4.220,P<0.05)。结果见表1。

表1 2组患者的临床疗效比较Tab.1 Comparison of clinical efficacy of patients between the two groups 例(%)
2.2 2组患者2 a内生存情况比较
随访至24个月,观察组患者的无进展生存期长于对照组,差异有统计学意义(t=6.702,P<0.05); 2组患者的1 a生存率比较差异无统计学意义(χ2=0.415,P>0.05);观察组患者的2 a生存率显著高于对照组,差异有统计学意义(χ2=5.420,P<0.05)。结果见表2。

表2 2组患者生存情况比较Tab.2 Comparison of survival of patients between the two groups
2.3 2组患者化学治疗前及化学治疗3个周期后的KPS评分比较
化学治疗前,2组患者化学治疗前的KPS评分比较差异无统计学意义(t=0.537,P>0.05);2组患者化学治疗3个周期后的KPS评分显著高于化学治疗前,差异有统计学意义(t=5.604、9.378,P<0.05);化学治疗3个周期后,观察组患者的KPS评分显著高于对照组,差异有统计学意义(t=2.608,P<0.05)。结果见表3。
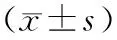
表3 2组患者化学治疗前及化学治疗3个周期后KPS评分比较Tab.3 Comparison of KPS scores of patients before and after 3 cycles of chemotherapy between the two groups
2.4 2组患者化学治疗期间不良反应比较
2组患者在化学治疗期间均出现血液系统和非血液系统不良反应,其中血液系统不良反应主要为骨髓抑制,且多为Ⅲ°及Ⅳ°不良反应;非血液系统不良反应有脱发、胃肠道反应和肝肾功能异常等,且多为Ⅰ°和Ⅱ°不良反应;2组患者均未出现化学治疗相关性死亡病例。对照组患者化学治疗期间贫血、血小板减少症、中性粒细胞减少症、白细胞减少症、淋巴细胞减少症、恶心、呕吐、乏力、食欲减退、脱发、血肌酐升高、ALT升高发生率分别为68.00%(34/50)、72.00%(36/50)、58.00%(29/50)、68.00%(34/50)、22.00%(11/50)、26.00%(13/50)、24.00%(12/50)、46.00%(23/50)、30.00%(15/50)、50.00%(25/50)、20.00%(10/50)、10.00%(5/50),观察组患者贫血、血小板减少症、中性粒细胞减少症、白细胞减少症、淋巴细胞减少症、恶心、呕吐、乏力、食欲减退、脱发、血肌酐升高、ALT升高发生率分别为61.40%(35/57)、63.16%(36/57)、49.12%(28/57)、52.63%(30/57)、21.05%(12/57)、22.81%(13/57)、24.56%(14/57)、42.11%(24/57)、29.82%(17/57)、47.37%(27/57)、21.05%(12/57)、10.53%(6/57);对照组与观察组患者化学治疗期间贫血、血小板减少症、中性粒细胞减少症、白细胞减少症、淋巴细胞减少症、恶心、呕吐、乏力、食欲减退、脱发、血肌酐升高、ALT升高发生率比较差异均无统计学意义(χ2=0.047、0.000、0.041、0.694、0.056、0.000、0.208、0.041、0.184、0.160、0.233、0.102,P>0.05)。结果见表4。

表4 2组患者化学治疗期间不良反应发生情况比较Tab.4 Comparison of occurrence of adverse reactions during chemotherapy of patients between the two groups 例
3 讨论
近些年,以铂类为基础的化学治疗在卵巢癌患者治疗中始终占据着举足轻重的地位,但对于反复复发的卵巢癌患者来说,不仅可选的化学治疗药物变少,化学治疗效果不佳,而且还会产生耐药现象,给患者的生命带来极大威胁[15]。2010年妇科癌症国际小组在温哥华举行了第4次国际卵巢癌共识会议中明确指出从最后一次铂剂量开始到疾病进展期的时间间隔称为铂类再治的间隔,并据此,将复发性卵巢癌分为铂难治性、耐药性、部分敏感性和完全敏感性。目前,对于铂敏感型复发性卵巢癌的治疗以延长患者生存时间,降低并发症为主。目前,外科手术切除[16]及多种单抗制剂如贝伐珠单抗[17]已广泛应用于铂敏感型复发性卵巢癌的治疗,但患者的长期生存率仍不理想。
PARP抑制剂是通过“合成致死”效应使乳腺癌易感基因(breast cancer susceptibility genes,BRCA)突变的肿瘤细胞无法修复已损伤的DNA而导致肿瘤细胞死亡的新型抗肿瘤药[18]。美国食品药品监督管理局于2014年批准了第一个PARP抑制剂奥拉帕尼用于对铂敏感型复发性晚期卵巢癌的治疗,随后我国也上市了多个PARP抑制剂。BRCA1/2突变将导致DNA的结构稳定性受到影响,使细胞发生癌变的概率显著增加[19]。氟唑帕利为小分子PARP抑制剂,其可抑制BRCA1/2功能异常细胞中的DNA修复过程,诱导细胞周期阻滞,进而抑制肿瘤细胞增殖而产生抗肿瘤效果,或者说其主要是通过参与肿瘤DNA缺陷修复途径来杀灭肿瘤细胞,该药物主要适用于铂敏感型复发性上皮性卵巢癌的患者[20-21]。本研究结果显示,化学治疗3个周期后,观察组患者的DCR和ORR显著高于对照组,KPS评分明显高于对照组;随访至24个月,观察组患者疾病无进展生存期显著长于对照组,2 a生存率显著高于对照组;提示,对于从最后1次铂剂量开始至疾病进展期的时间间隔至少6个月的铂敏感型复发性卵巢癌患者,在紫杉醇联合铂类化学治疗的基础上联合氟唑帕利,可更有效地提高抗肿瘤效果,延长患者疾病无进展生存期,提高患者生存率,改善其生存质量。但本研究结果显示,2组患者的1 a生存率比较差异无统计学意义,这可能与本研究样本量较小的缘故有关。FOO等[22]研究也发现,在常规化学治疗基础上增加PARP抑制剂,可提高其疾病控制率,改善患者生存质量。
化学治疗药物的安全性一直以来是肿瘤科医师研究的焦点问题,也是患者最为关注的问题之一。本研究结果显示,2组患者在化学治疗期间均出现有血液系统和非血液系统不良反应,其中血液系统不良反应主要为骨髓抑制,且多为Ⅲ°及Ⅳ°不良反应;非血液系统不良反应有脱发、胃肠道反应和肝肾功能异常等,且多为Ⅰ°和Ⅱ°不良反应;2组患者均未出现化学治疗相关性死亡病例;且2组患者化学治疗期间不良反应发生率比较差异无统计学意义;提示,在紫杉醇联合铂类化学治疗的基础上联合氟唑帕利治疗铂敏感型复发性卵巢癌患者,并未增加其不良反应发生率。但是,本研究中2组患者血液系统不良反应均有明显的骨髓抑制,且多为 Ⅲ°及 Ⅳ°不良反应;因此,在临床使用过程中,需要严密检测患者血象,发现骨髓抑制后及时给予重组人粒细胞刺激因子或作为预防用药,以减轻骨髓抑制程度。
4 结论
在紫杉醇联合铂类化学治疗的基础上联合氟唑帕利可以更有效地提高对铂敏感型复发性卵巢癌患者的抗肿瘤效果,延长患者疾病无进展生存期,提高生存率,改善生存质量,且不良反应可控,推荐临床使用。
