阿魏酸哌嗪预处理对脓毒症大鼠急性肾损伤的保护作用及机制
2023-12-12王建刚刘新宇
李 堤,王建刚 ,刘新宇
(1.新乡医学院研究生院,河南 新乡 453003;2.南阳市中心医院血液净化科,河南 南阳 473000)
脓毒症是造成急性肾损伤(acute kidney injury,AKI)的主要原因之一[1],约60%的脓毒症患者并发AKI[2],而重症监护病房中脓毒症并发AKI患者病死率高达41%[3]。既往研究表明,脓毒症在AKI的病因和发病机制中起重要作用,肾组织对脓毒症的反应机制与AKI有关[4]。目前,脓毒症并发AKI患者的治疗方法有限,主要包括抗生素控制感染、及时应用液体复苏、血液净化技术等治疗手段[5]。阿魏酸哌嗪(piperazine ferulate,PF)是由川芎的有效成分阿魏酸和哌嗪环缩合成的化合物,通过抗凝血、舒张血管、抑制血小板聚集和炎症、减少血管内膜、松弛血管平滑肌、扩张肾血管等作用,改善肾血流动力学和微循环;PF在临床中主要应用于慢性肾小球肾炎、肾病综合征、高血压肾病以及糖尿病肾病的治疗[6-7]。有研究表明,PF联合黄芪注射液能有效降低AKI患者β2微球蛋白、中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinase-associated lipocalin,NGAL)水平,从而改善肾功能[8]。有研究报道,PF可抑制转化生长因子-β1和纤连蛋白(fibronectin,FN)的表达,从而改善高血压肾病大鼠的肾功能[9]。但是,目前PF治疗AKI患者的具体机制仍不清楚。本研究主要观察PF对Toll样受体 4(Toll-like receptor 4,TLR4)/核因子κB(nuclear factor-κB,NF-κB)/NOD样受体热蛋白结构域相关蛋白3 (NOD-like receptor thermal protein domain associated protein 3,NLRP3)信号通路的影响,探讨PF在AKI治疗中的作用机制,以期为PF的临床应用提供理论基础。
1 材料与方法
1.1 实验动物
清洁级雄性Sprague Dawley(SD)大鼠32只,购自湖南斯莱克景达实验动物有限公司,动物许可证:SCXK(湘)2019-0004,体质量(300±20) g;饲养于南阳医学高等专科学校动物实验室,温度(23±2) ℃,湿度50%,12 h/12 h光-暗循环;用标准的实验室饲料喂养,自由饮水。所有动物实验程序均按照中国《实验动物护理与使用指南》执行。
1.2 主要试剂与仪器
PF分散片购自山东希尔康泰药业有限公司(国药准字H20052333),9 g·L-1氯化钠溶液购自石家庄第四制药有限公司,血清肌酐(serum creatinine,Scr)、血尿素氮(blood urea nitrogen,BUN)检测试剂盒购自南京建成生物工程研究所,NGAL、白细胞介素-6(interleukin-6,IL-6)、降钙素原(procalcitonin,PCT)酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测试剂盒购自上海酶联生物科技有限公司,多聚甲醛固定液购自武汉赛维尔生物科技有限公司,苏木精染色液购自美国Sigma公司,伊红染色液、无水乙醇、二甲苯、盐酸、包埋石蜡、中性树胶均购自上海国药集团化学试剂有限公司,磷酸酶抑制剂和放射免疫沉淀法(radio immunoprecipi-tation assay,RIPA)裂解液购自大连美仑生物技术有限公司,二喹啉甲酸(bicinchoninic acid,BCA)蛋白检测试剂盒购自广州捷倍斯生物科技有限公司,鼠单抗TLR4购自武汉三鹰生物技术有限公司,甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体购自杭州贤至生物有限公司,兔多抗NF-κB、兔多抗NLRP3购自美国Affinity公司;Multiskan FC酶标仪购自美国Thermo Scientific公司,DS-Fi3光学显微镜购自日本尼康公司,DK-20000-IIIL电热恒温水浴锅购自河北菲斯福仪器有限公司。
1.3 实验方法
1.3.1 动物分组与处理
PF混悬液制备:将PF分粉碎,溶于9 g·L-1氯化钠溶液,充分摇匀震荡。按照随机数字表法将32只SD大鼠分为假手术组、模型组、低剂量PF组、高剂量PF组,每组8只。低剂量PF组、高剂量PF组大鼠每天分别给予50、100 mg·kg-1PF混悬液灌胃,连续7 d;假手术组、模型组大鼠每天灌胃9 g·L-1氯化钠溶液(0.1 mL·kg-1),连续7 d。假手术组大鼠仅打开大鼠腹腔缓慢翻动并找到盲肠后将其归位,缝线关闭腹腔。模型组、低剂量PF组、高剂量PF组大鼠采用盲肠结扎穿孔手术构建大鼠AKI模型[10-11]:术前禁食12 h,可自由饮水。在无菌条件下,大鼠腹腔注射0.04 mL·kg-1水合氯醛麻醉。麻醉下进行腹部正中线切开约2 cm,缓慢找到盲肠,在回肠盲肠瓣下3-0缝线结扎盲肠,维持肠道连续性。在盲肠表面上3个间隔约0.8 cm的位置用18G针头贯穿3次盲肠,轻轻挤压,挤出少量粪便。之后按大鼠肠道生理位置还纳盲肠,逐层缝合关闭腹腔,手术操作后立即用9 g·L-1氯化钠溶液(0.1 mL·kg-1)皮下注射,防止大鼠出现休克死亡。术后大鼠可以自由进食饮水。造模前药物灌胃后出现2只大鼠死亡(高剂量PF组 1只,低剂量PF组 1只),造模过程出现4只大鼠死亡(模型组2只,高低剂量PF组和低剂量PF组各1只),最后分别剔除假手术组Scr最高和最低值各1只,纳入后续实验共24只大鼠,假手术组、模型组、低剂量PF组、高剂量PF组各6只。
1.3.2 血液及肾脏组织标本收集
造模24 h后,各组大鼠腹腔注射0.04 mL·kg-1水合氯醛进行麻醉,在麻醉状态下剪开大鼠颈动脉,取血并置于不含抗凝剂的血液生化管中,室温静置2 h后,3 000 r·min-1离心15 min,收集血清备用。断头处理各组大鼠,打开腹腔,切除肾脏,采用9 g·L-1氯化钠溶液清洗肾脏组织;取部分肾组织,40 g·L-1多聚甲醛固定液固定;剩余肾组织置于-80 ℃ 冰箱保存备用。
1.3.3 生物化学法检测大鼠Scr、BUN水平
取各组大鼠血清标本,应用生物化学法检测Scr、BUN水平,严格按试剂盒说明书进行操作。
1.3.4 ELISA法检测大鼠血清NGAL、IL-6和PCT水平
取各组大鼠血清标本,应用ELISA法检测血清NGAL、IL-6和PCT水平,严格按照试剂盒说明书进行操作。
1.3.5 苏木精-伊红(hematoxylin-eosin,HE)染色观察大鼠肾组织病理变化
取固定于40 g·L-1多聚甲醛溶液中的肾组织,流水冲洗,梯度乙醇脱水,二甲苯透明,石蜡包埋,制作厚约4 μm切片;取组织切片,行HE染色,显微镜下观察大鼠肾组织病理变化。
1.3.6 Western blot法检测大鼠肾组织中TLR4、NF-κB、NLRP3蛋白表达
取保存于冰箱中的大鼠肾组织,使用 200 μL RIPA裂解液裂解肾组织,用含蛋白酶磷酸酶抑制剂混合物提取总蛋白,BCA蛋白检测试剂盒检测蛋白浓度;应用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白样品,电转移至聚偏二氟乙烯膜,用脱脂奶粉溶液在室温下封闭2 h;然后,滴加TLR4(滴度为14 000)、兔多抗NF-κB(滴度为11 000)、兔多抗NLRP3(滴度为11 000)和GAPDH(滴度为11 000)一抗,4 ℃孵育过夜;滴加二抗辣根过氧化物酶,室温孵育2 h;使用增强型电化学发光溶液显影,应用Image Pro Plus软件分析灰度值,以GAPDH为内参对照,目的蛋白相对表达量以目的蛋白条带灰度值与内参蛋白条带灰度值的比值表示。
1.4 统计学处理

2 结果
2.1 4组大鼠Scr、BUN水平比较
模型组和低剂量PF组大鼠Scr、BUN水平显著高于假手术组,差异有统计学意义(P<0.05);高剂量PF组大鼠Scr水平显著高于假手术组,差异有统计学意义(P<0.05);高剂量PF组与假手术组大鼠BUN水平比较差异无统计学意义(P>0.05);低剂量PF组和高剂量PF组大鼠Scr、BUN水平显著低于模型组,差异有统计学意义(P<0.05);高剂量PF组大鼠Scr、BUN水平显著低于低剂量PF组,差异有统计学意义(P<0.05)。结果见表1。
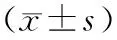
表1 4组大鼠Scr、BUN水平比较Tab.1 Comparison of the levels of Scr and BUN of rats among the four groups
2.2 4组大鼠血清NGAL、IL-6和PCT水平比较
模型组和低剂量PF组大鼠血清NGAL、IL-6、PCT水平显著高于假手术组,差异有统计学意义(P<0.05);高剂量PF组大鼠血清PCT水平显著高于假手术组,差异有统计学意义(P<0.05);高剂量PF组与假手术组大鼠血清NGAL和IL-6水平比较差异无统计学意义(P>0.05)。低剂量PF组和高剂量PF组大鼠血清NGAL、IL-6和PCT水平显著低于模型组,差异有统计学意义(P<0.05);高剂量PF组大鼠血清NGAL、IL-6和PCT水平均显著低于低剂量PF组,差异有统计学意义(P<0.05)。结果见表2。

表2 4组大鼠血清NGAL、IL-6和PCT水平比较Tab.2 Comparison of serum NGAL,IL-6 and PCT levels of rats among the four groups
2.3 4组大鼠肾组织病理学变化
假手术组大鼠肾组织无明显异常改变(图1A)。模型组大鼠肾小管上皮细胞明显肿胀变性,细胞质内有较多红染物,可见肾小管充血、变性坏死,管腔有大量炎症细胞浸润,系膜毛细血管间细胞增殖(图1B)。低剂量PF组大鼠部分肾小管上皮细胞呈现轻中度肿胀,部分肾小管上皮细胞变性坏死,未见大量炎症细胞浸润(图1C)。高剂量PF组大鼠肾小管上皮细胞轻度肿胀,未见明显变性坏死及炎症细胞浸润(图1D)。

A:假手术组;B:模型组;C:低剂量PF组;D:高剂量PF组。
2.4 4组大鼠肾组织中TLR4、NF-κB和NLRP3蛋白水平比较
模型组和低剂量PF组大鼠肾组织中TLR4、NF-κB、NLRP3蛋白水平显著高于假手术组,差异有统计学意义(P<0.05);高剂量PF组大鼠肾组织中TLR4蛋白水平显著高于假手术组,差异有统计学意义(P<0.05)。高剂量PF组与假手术组大鼠肾组织中NF-κB、NLRP3蛋白水平比较差异无统计学意义(P>0.05);低剂量PF组和高剂量PF组大鼠肾组织中TLR4、NLRP3蛋白水平显著低于模型组,差异有统计学意义(P<0.05);PF高剂量组大鼠肾组织中NF-κB水平显著低于模型组,差异有统计学意义(P<0.05);低剂量PF组与模型组大鼠肾组织中NF-κB水平比较差异无统计学意义(P>0.05)。高剂量PF组大鼠肾组织中TLR4、NLRP3蛋白水平显著低于低剂量PF组,差异有统计学意义(P<0.05);高剂量PF组与低剂量PF组大鼠肾组织中NF-κB水平比较差异无统计学意义(P>0.05)。结果见表3。
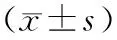
表3 4组大鼠肾组织中TLR4、NF-κB和NLRP3蛋白相对表达量比较Tab.3 Comparison of the relative expressions of TLR4,NF-κB and NLRP3 protein in renal tissues of rats among the four groups
3 讨论
脓毒症是目前临床中急危重症患者主要面临的并发症之一[12]。NGAL是近年来发现的与脓毒症并发AKI相关的生物标志物;正常情况下,NGAL主要在中性粒细胞及肾小管上皮细胞中呈低水平表达[13]。而在AKI模型大鼠尿液及血浆中NGAL水平会明显升高,认为其可作为AKI的判断依据[14]。Scr和BUN是常用的反映肾功能的指标。本研究结果显示,模型组、低剂量PF组大鼠Scr、BUN及血清NGAL水平显著高于假手术组,高剂量PF组大鼠Scr水平显著高于假手术组,低剂量PF组和高剂量PF组大鼠Scr、BUN及血清NGAL水平显著低于模型组,高剂量PF组大鼠Scr、BUN及血清NGAL水平显著低于低剂量PF组。另外,肾组织病理学检测显示,假手术组大鼠肾组织无明显异常改变;模型组大鼠肾小管上皮细胞明显肿胀变性,细胞质内有较多红染物,可见肾小管有充血变性坏死,管腔有大量炎症细胞浸润,系膜毛细血管间细胞增殖;低剂量PF组大鼠部分肾小管上皮细胞呈现轻中度肿胀,部分肾小管上皮细胞变性坏死,未见大量炎症细胞浸润;高剂量PF组大鼠肾小管上皮细胞轻度肿胀,未见明显变性坏死及炎症细胞浸润;提示PF预处理对AKI具有保护性作用,且这种作用呈一定的剂量依赖性。
IL-6和PCT在全身炎症反应中起重要作用,与机体感染严重程度及脓毒症患者的预后密切相关[15]。有研究表明,IL-6对脓毒症具有较高的诊断效能、敏感度及特异度[16-17]。PCT水平在全身炎症反应尤其是细菌感染导致的炎症反应时会明显升高,可作为脓毒症或脓毒性休克早期诊断的血清标志物,且动态监测PCT水平有助于指导脓毒症感染患者的治疗[18]。本研究结果显示,模型组和低剂量PF组大鼠血清IL-6、PCT水平显著高于假手术组,高剂量PF组大鼠血清PCT水平显著高于假手术组,低剂量PF组和高剂量PF组大鼠血清IL-6、PCT水平显著低于模型组,高剂量PF组大鼠血清IL-6、PCT水平显著低于低剂量PF组;提示PF预处理可能通过抑制IL-6和PCT水平对脓毒症肾损伤发挥保护效应。
TLR4受体是免疫细胞表面识别病原的识别受体家族成员之一,在脓毒症发生过程,可激活NF-κB,引起IL-6、PCT及肿瘤坏死因子-α等炎症因子的表达,加重炎症反应[19-20]。NLRP3炎症复合体是一组多蛋白组成的分子,由NLRP3、凋亡相关斑点样蛋白和半胱天冬酶前体-1组成的多蛋白复合体[21-22]。研究表明,NLRP3炎症复合体主要参与AKI病理过程,可促进Scr水平升高,增加中性粒细胞浸润,促进炎症反应[23]。本研究结果显示,模型组和低剂量PF组大鼠肾组织中TLR4、NF-κB、NLRP3 蛋白水平显著高于假手术组,高剂量PF组大鼠肾组织中TLR4蛋白水平显著高于假手术组,低剂量PF组和高剂量PF组大鼠肾组织中TLR4、NLRP3蛋白水平显著低于模型组,高剂量PF组大鼠肾组织中NF-κB水平显著低于模型组,高剂量PF组大鼠肾组织中TLR4、NLRP3蛋白水平显著低于低剂量PF组;提示AKI大鼠肾组织中TLR4、NF-κB、NLRP3 蛋白表达水平显著升高,而PF可抑制TLR4、NF-κB、NLRP3 的表达,进而调控TLR4/NF-κB/NLRP3信号通路,从而对脓毒症AKI发挥保护作用。
4 结论
PF干预可有效降低大鼠Scr、BUN及血清NGAL、IL-6和PCT水平,对AKI大鼠肾脏发挥一定保护性作用,其作用机制可能与抑制TLR4、NF-κB、NLRP3 的表达,进而调控TLR4/NF-κB/NLRP3信号通路有关。
