Survivin基因沉默诱导宫颈癌细胞凋亡的实验设计
2023-12-11刘艳红
刘艳红, 李 静, 王 娜, 张 骥, 李 坤
(四川大学a.基础化学实验教学中心;b.化学学院,成都 610064)
0 引 言
癌症是恶性肿瘤细胞快速增殖导致的一种系统性疾病。传统的癌症治疗方法主要有手术治疗、化疗和放射治疗。但由于手术治疗难以精准地切除所有癌细胞,而化疗和放射治疗存在毒副作用强、肿瘤细胞容易出现耐药性等不足,导致癌症的治疗和术后效果不佳[1]。近年来,核酸类药物的出现为癌症的治疗带来了新的希望[2]。
RNA 干扰(RNA interference,RNAi)是由双链RNA(dsRNA)分子在细胞中高效特异性结合同源mRNA,从而引起靶基因降解现象。目前发现具有诱导RNA沉默功能的核酸分子有3 类,即内源性微小miRNA(microRNA,miRNA)、小干扰RNA(Small interefering RNA,siRNA)和发夹RNA(shRNA)。其中,siRNA 是人工合成的长度为21 ~25 bp 的双链RNA分子(导链和随从链),经运载体传输进入细胞后,被DICER酶处理,随从链被降解,导链组装到RNA诱导产生的沉默复合体(RNA-induced silencing complex,RISC)中,与信使RNA(mRNA)的特定基因序列进行碱基互补配对形成新的双链。随后,RISC 中Argonaute 2 蛋白对双链进行切割,导致靶基因被降解,最终达到基因表达沉默的目的[3-6]。由于siRNA对靶基因降解的特异性、高效性和安全性,使得siRNA成为恶性肿瘤、遗传性疾病、神经类疾病和病毒感染等领域研究最为活跃的核酸类药物之一[7-8]。2018 年,全球首个siRNA 类药物Onpattro 上市,到2022 年,siRNA类药物已增加至5 个[9]。siRNA药物的快速发展进一步推动了精准化、个性化基因治疗在临床应用。
由BIRC5 基因编码的Survivin蛋白是凋亡抑制蛋白(Inhibitor of apoptosis protein,IAP)家族中最小的成员,也是迄今为止发现的最有效的凋亡抑制蛋白。Survivin蛋白通过抑制半胱天冬酶的活性,发挥抗凋亡作用。动物组织分布研究显示,Survivin具有高度的肿瘤组织表达和分布特异性,在几乎所有的肿瘤细胞中有表达,而在正常终末分化组织中几乎不表达,为此,在癌症筛查检测研究中,Survivin常被作为恶性肿瘤早期病变的标志物。Survivin 在癌细胞中的高表达可以降低癌细胞对化疗药物和放射治疗的敏感性,抑制癌细胞的凋亡[10-11]。另外,Survivin 表达的上调与肿瘤复发和不良预后密切相关[12]。Norouzi 等[13]研究显示,降低Survivin基因表达,有效提高了4T-1 细胞对抗肿瘤药物阿霉素的敏感性,抑制了肿瘤细胞的增殖。
现以BIRC5 基因为靶点,通过传输特异性siRNA,有效敲低了Survivin蛋白的表达,探讨Survivin蛋白水平下调对Hela 细胞凋亡的影响。实验将siRNA 分子的递送、基因表达水平检测、细胞周期和细胞凋亡检测等实验技术进行了系统性设计,完整展现了基因干扰实验研究的全过程,对于学生基础科学思维的训练和实践探究能力的培养具有重要的意义。
1 实验试剂和仪器
1.1 实验试剂
聚乙烯亚胺(PEI,25KD)美国Sigma-Aldrich 公司;DMEM 培养基、胰蛋白酶、OPTI-MEM 培养基、Hoechst 33342、胎牛血清、SYBR Green 预混液、琼脂糖和BCA蛋白检测试剂盒,美国赛默飞世尔科技公司;Survivin siRNA (siSur)序列(正义链:5′-AGTCTGGCGTAAGATGATGGATTTG-3′;反义链5′-CACAGCAGTGTTTGAAATGACAGG-3′), GAPDH siRNA 序列(siGAPDH),EGFP siRNA(siEGFP),Negtive siRNA,Survivin和GAPDH qPCR 引物,广州锐博生物科技有限公司;Gelred、肝素钠GreenNucTM活细胞Caspase-3 活性检测试剂盒和Caspase-3 活性检测试剂盒,上海碧云天生物技术有限公司;Tris-base、甘氨酸、十二烷基磺酸钠(SDS)、氯化钠、氯化钾、磷酸二氢钠、磷酸氢二钾均为国产分析纯。
1.2 实验仪器
TS-100 型倒置显微镜,日本尼康公司;流式细胞仪,美国BD 公司;荧光定量PCR 仪和二氧化碳培养箱,美国赛默飞世尔科技公司;超净工作台,苏州安泰空气技术有限公司;多功能分子荧光成像系统,美国Azure Biosystems 公司;多功能酶标仪,瑞士帝肯公司等。
2 实验方法
2.1 凝胶阻滞实验
PEI与siRNA按照不同的质量比1、3、5、10 和20分别进行复合,其中,siRNA的用量为0.142 8 μg。二者在室温孵育20 min 后,加入上样缓冲液混合均匀,点样至2 %琼脂糖凝胶中进行电泳,并通过凝胶成像系统成像。
2.2 血清稳定性检测
PEI与siRNA按照质量比7.5 进行复合,复合过程见2.1。然后,在体系中加入50 %的血清(v/v),37 ℃分别孵育0、0.5、1、3、6 和24 h后,每管加入终浓度为2.5 mg/mL的肝素钠,37 ℃放置1 h 后,加入上样缓冲液,采用琼脂糖凝胶电泳进行分析。
2.3 PEI介导的siRNA转染实验
Hela细胞消化计数后,按照1 ×105个/孔的细胞数量接种于24 孔细胞培养板中,于37 ℃二氧化碳培养箱中培养过夜。次日,进行转染实验。实验设置空白对照组、Negtive 阴性对照组、siRNA 对照组和转染组。转染组中,PEI/ siRNA 复合物的制备方法:①取一定体积的PEI用Opti-MEM培养基稀释至50 μL;②用Opti-MEM培养基将siRNA 稀释至50 μL;③将稀释后的siRNA滴加至稀释好的PEI溶液中,轻轻混匀,室温下继续复合20 min。然后,将细胞培养板内的培养基更换为无血清培养基,每孔400 μL。吸取PEI/siRNA复合物滴加至孔中,前后推板混合均匀,置于37 ℃培养箱中孵育4 h 后,再将板内的培养基更换新鲜的完全培养基(500 μL/孔),继续培养。
2.4 蛋白和基因表达水平的检测
PEI介导siEGFP 转染48 h后,通过倒置荧光显微镜观察绿色荧光蛋白(EGFP)的表达。同时,采用流式细胞术检测有血清和无血清条件下,Hela/EGFP 细胞株中EGFP 蛋白的表达情况。PEI/siSur 转染48 h后,采用Trizol法提取细胞总RNA,并通过实时荧光定量PCR 法检测Survivin 基因水平的表达情况。Survivin qPCR 的引物为正义链:5′-AGTCTGG CGTAAGATGATGGATTTG-3′;反义链:5′-CACAGCAGTGTTTGAAATGACAGG-3′。PCR 的反应条件为95℃预变性5 min,95 ℃变性5 s,60 ℃退火延伸30 s,共40 个循环。GAPDH 作为内参基因。采用2-ΔΔCt法计算目的基因Survivin在mRNA水平的相对表达。
2.5 流式细胞术检测细胞周期
Hela细胞经PEI/siSur 转染48 h 后,用胰酶消化细胞,然后,将细胞转移至1.5 mL 的EP 管中,离心(1 000 r/min×5 min),弃上清。在收集到的细胞中加入预冷的70 %乙醇,每管1 mL,4 ℃固定24 h,1 000 r/min离心5 min,弃上清。用预冷的PBS缓冲液漂洗2次后,每管加入500 μL PI染色液(含50 μg/mL PI、50 μg/mL RNase A 和0.2% Triton X-100 的PBS缓冲液)室温染色30 min,用流式细胞仪进行检测。
2.6 Caspase-3 活性检测
2.6.1 原位染色检测Caspase-3 活性
PEI/siSur 转染48 h 后,吸去孔中培养基,加入PBS缓冲液,每孔500 μL。在不同处理组中分别加入5 μM Caspase-3 酶荧光底物,37 ℃孵育30 min 后,在倒置荧光显微镜下观察并随机选取3 ~6 个视野成像。荧光底物的最大激发和发射波长为500/530 nm。
2.6.2 荧光法测定Caspase-3 活性
细胞消化后离心收集,在每200 万个细胞中加入100 μL细胞裂解液后,置于冰上裂解15 min,4 ℃离心(20 000 g ×10 min),吸取上清并测定蛋白浓度。然后,参照Caspase-3 活性检测试剂盒说明书,将底物pNA进行稀释,测定405 nm处的吸光值,并绘制标准曲线。按照Caspase-3 活性检测方法分别加入检测缓冲液、待测样品和底物Ac-DEVD-pNA,37 ℃反应3 h后测定405 nm处的吸光值,并根据标准曲线,计算待测样品中pNA的含量。
2.7 统计学分析
采用SPSS 13.0 统计软件进行统计学分析。数据用均数± 标准差(X±s)表示,实验结果用t检验,P<0.05 表示差异有统计学意义。
3 结果与讨论
3.1 PEI/siRNA复合物的稳定性
由于siRNA是一种表面带有较强负电荷的柔性生物大分子,很难通过扩散的方式进入细胞。另外,siRNA的结构不稳定,容易被环境或血浆中的核酸酶降解。而高效、安全的运载体可以有效维持siRNA 结构的稳定性并将其传输到细胞中[14]。PEI 是具有高效基因转染性能的阳离子聚合物,通过静电相互作用的方式快速结合并压缩核酸分子,形成稳定的复合物,保护核酸分子免受核酸酶的降解[15]。实验通过凝胶阻滞电泳分析了PEI与siRNA 复合的质量比,结果显示,当PEI/siRNA复合的质量比为1 时,可以清晰地观察到siRNA的条带,当二者的质量比为3 时,siRNA分子在凝胶电泳上的迁移完全被阻滞[见图1(a)],表明siRNA分子与PEI形成了稳定的复合物。图1(b)进一步探讨了血清对siRNA分子稳定性的影响,实验结果显示裸siRNA分子与血清孵育0.5 h 后,条带的亮度明显降低,孵育3 h 后,条带消失,表明siRNA 分子被血清中的核酸酶降解。而PEI/siRNA 复合物与血清共孵育24 h后,依然可以清晰地观察到核酸条带。该结果表明PEI与siRNA复合后,有效阻断了核酸酶对siRNA的降解,延长了siRNA在血清中稳定的时间。
3.2 EGFP表达水平检测
PEI与siRNA的复合质量比可以影响siRNA传输的效率,降低靶基因沉默的效果。实验通过敲低稳转细胞株Hela/EGFP 中报告基因EGFP 的表达,考察了PEI与siRNA不同复合质量比对基因沉默的影响。其中Hela/EGFP稳转细胞设为空白对照组。结果显示,在空白对照组和siEGFP 组中可以观察到大量的绿色荧光点,该绿色荧光点即为表达EGFP 的阳性细胞。而PEI/siEGFP按不同质量比复合的转染组中,绿色荧光蛋白的表达量明显降低,其中,当PEI 与siEGFP 的复合质量比为5 时,绿色荧光信号显著减弱,当复合质量比为7.5 时,视野中观察到微弱的荧光信号,EGFP荧光蛋白几乎不表达(见图2),这是由于PEI 介导的siEGFP传输有效干扰了靶基因EGFP 的翻译过程,敲低了EGFP蛋白的表达。该结果表明PEI复合siEGFP沉默基因表达的最佳复合质量比为7.5。

图2 EGFP表达的荧光成像图
3.3 血清对siRNA基因传输的影响
实验通过流式细胞术检测了有血清和无血清条件下,PEI/siEGFP 对靶基因的沉默效率,进一步考察了血清对siRNA传输的影响。结果如图3所示,与空白对照组相比,在无血清转染条件下,EGFP 蛋白的表达量下调了55.6%,而有血清转染条件下,EGFP蛋白的表达量仅下降了38.4%,该结果表明有血清条件下,PEI/siRNA的转染效率明显降低。这是由于血清中大量存在的血清蛋白与PEI/siEGFP 结合,导致PEI/siEGFP复合物不稳定,降低了siRNA的传输效率[16]。
3.4 Survivin基因水平检测
PEI/siSur转染Hela 细胞后,采用实时荧光定量PCR的方法检测Survivin基因水平表达的情况。结果如图4 所示,PEI 介导的SiSur 基因转染组中,Survivin基因的表达水平仅为空白对照组的42% (P<0.001)。表明PEI/siSur 的高效递送有效降低了Survivin基因mRNA水平的表达。
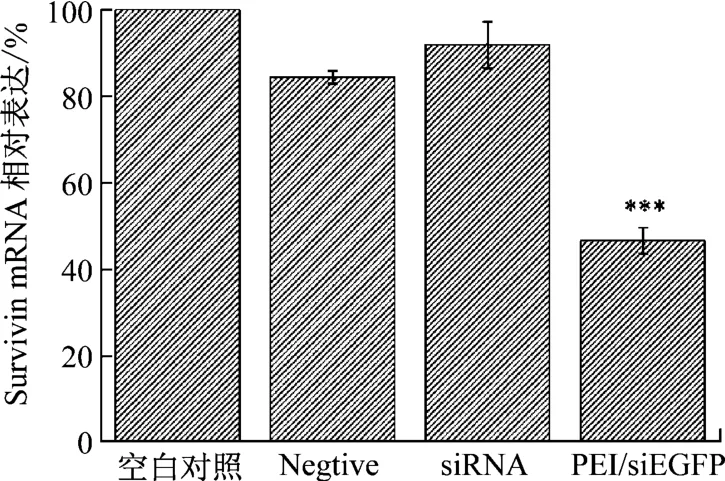
图4 qPCR检测Survivin基因的表达
3.5 细胞周期检测
Survivin在肿瘤组织中特异性分布和高表达抑制了肿瘤细胞的凋亡,研究显示,在细胞有丝分裂过程中,Survivin可以与调节细胞周期的关键性激酶CDK1相互作用,稳定有丝分裂期的细胞,抑制细胞死亡[17]。实验通过分析肿瘤细胞的周期变化,探讨敲低Survivin蛋白表达对细胞凋亡的影响。实验结果见图5,与空白对照组和阴性对照组相比,PEI/siSur 基因转染后,细胞周期发生了明显的变化,其中G0/G1 期的细胞比例显著减少,而G2/M期的细胞比例显著增加,且出现了明显的细胞凋亡峰。该结果表明沉默Survivin 基因,下调Survivin蛋白表达后,Hela 细胞的细胞周期阻滞于G2/M期,细胞的凋亡率明显增加。

图5 Survivin基因沉默对细胞周期的影响
3.6 Caspase-3 活性检测
Caspase-3 是细胞凋亡信号通路中的关键性激酶。当细胞凋亡通路被激活时,Procaspase-3 被剪切形成有活性的Caspase-3 激酶。活化的Caspase-3 激酶剪切反应底物,去除与荧光染料耦链的DEVD 多肽,使荧光染料与细胞DNA结合,从而检测到绿色荧光。实验通过原位荧光染色探讨了降低Survivin 蛋白表达对细胞凋亡信号通路的影响。结果见图6(a),与空白对照组相比,PEI介导SiSur基因转染组中检测到明显的绿色荧光,表明Survivin蛋白表达下调后,Caspase-3 激酶被激活。荧光检测结果同样显示siSur 基因转染组中,Caspase-3 激酶的活性显著高于空白组和阴性对照组[见图6(b)],提示敲低Hela 细胞中Survivin 蛋白的表达后,Procaspase-3 剪切形成有活性的Caspase-3 激酶,细胞凋亡信号通路被激活。

图6 Caspase-3的活性检测
4 结 语
基于患者基因修正的精准治疗是未来恶性肿瘤和先天性疾病治疗重要策略,而核酸类药物的持续性研究为个性化基因治疗提供了更多可选择的靶点。实验通过基因干扰方法敲低了宫颈癌细胞中高表达的Survivin基因,结果表明下调Survivin 表达后,Hela 细胞的细胞周期发生了明显变化,G0/G1 期细胞比例减少,G2/M期细胞比例显著增加,且出现明显的细胞凋亡峰,同时,与细胞凋亡相关的关键性激酶Caspase-3活化,细胞凋亡通路被激活。该研究表明Survivin 基因的高表达在宫颈癌发生发展中发挥着重要作用,敲低Survivin 表达促进了宫颈癌细胞的凋亡。Survivin基因有望成为未来宫颈癌治疗重要靶点。
