Golgi-Cox法标记小鼠脑神经方法的比较
2023-12-11文柏清康亚妮
文柏清, 张 倪, 康亚妮
(上海交通大学生物医学工程学院,上海 200240)
0 引 言
卡米洛·高尔基(Camillo Golgi)于1873 年发现,利用铬酸银溶液浸泡大脑切片,可以使小部分神经元全部染色,即高尔基染色(Golgi staining)[1]。高尔基方法的主要优点之一是神经染色具有随机性的,因为它只染色任何一个选定区域大约1% ~10%的神经元。这种随机染色使得单个神经元几乎所有结构可视化,包括体细胞、轴突、树突和树突棘。随后,多种研究对该方法进行了改良,如由Cajal提出的快速高尔基染色法(Rapid Golgi method)、高尔基-柯普奇法(Golgi-Kopsch)和高尔基-考克斯(Golgi-Cox)。
Golgi-Cox法以氯化汞取代硝酸银进行神经标记,并通过铬酸钾缓和溶液的过度酸性反应。该方法优于快速高尔基染色法,标记的神经元更多,且重复实验结果更加稳定,被广泛用于观察神经元和神经胶质细胞的形态,但其性质不确定、一致性差、染色时间长等因素阻碍了其作为首选方法应用[2]。FD Rapid Golgi StainTMKit是基于Golgi-Cox方法研发的,其以试剂盒的形式为分析神经元形态提供了一种简单、可靠、可重复性好的神经浸渍方法,且目前已广泛用于神经研究[3]。
目前基于Golgi-Cox染色原理,已有多种改良创新方法被提出,其中,FD Rapid GolgiStain Kit 的开发,使神经形态的观察研究更加简便[4-6]。李方等[7]通过多聚甲醛固定组织、缩短浸胶时间、组织块外包石蜡壳等实验调整,发现改良Golgi-Cox神经元染色法在大鼠脑缺血研究中,染色结果较恒定,且省时。冯宝峰等[8]对固定、切片、脱水和显色等环节进行改良后,证明相较于传统的Golgi-Cox染色方法,该方法更加稳定和敏感,为海马区神经元树突和树突棘形态与结构研究提供了一种可靠的技术方法。王蕾等[9]比较了冷冻切片、石蜡切片和振动切片3 种切片方式对结果的影响,并阐述了各自的优缺点。
本研究采用4 种不同的灌注方法后使用相同的固定、染色和显色液,结合流程化的商用实验步骤,进行振动切片脱水后,再使用明胶包埋的载玻片封片,最后使用光学显微镜成像比较不同灌注方法的脑切片制备效果。探索一种简单有效的神经标记方法,为实验科研、教学及神经研究提供可选方案。
1 实验材料与方法
1.1 实验材料
(1)动物。6-8 周龄C57/BL小鼠4 只,分别编号为1#、2#、3#、4#。
(2)试剂。实验所使用的试剂如表1 所示。
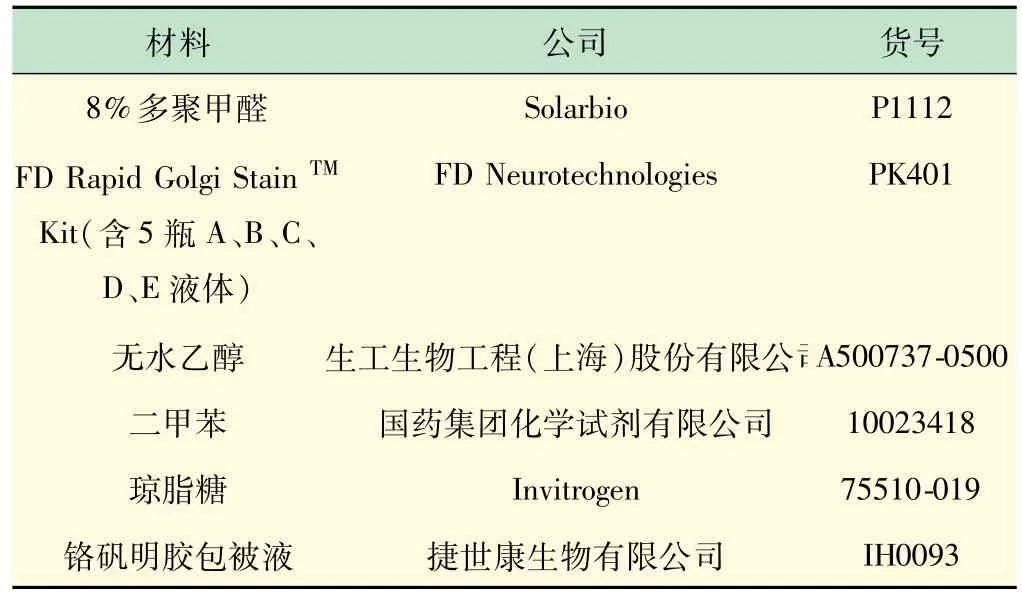
表1 实验所需试剂
1.2 实验方法
(1)准备。实验前24 h将A\B液按1∶1混合,在混合时尽量避免摇晃与碰撞,且避光保存,使用锡纸包覆试管外壁。
(2)灌注。①1#小鼠断颈后,不做灌注处理;②2#、3#、4#小鼠均先使用1.5 ml 10%水合氯醛麻醉,然后使用生理盐水灌流去血;③3#小鼠使用4%多聚甲醛(Paraformaldehyde,PFA)灌注固定;④4#小鼠用AB混合液灌注。
(3)取材。打开小鼠的头骨,小心取出脑组织。
(4)固定。使用提前配制的AB混合液浸泡24 h后,置换试管中的AB混合液,继续浸泡13 d。然后将脑组织转移至C液中室温避光72 h,首次浸泡24 h后更换C液1 次。具体参见FD Rapid Golgi StainTMKit protocol[6]。
(5)切片和贴片。将脑组织用3%的琼脂糖包埋后进行振动切片,切片厚100 和200 μm。载玻片提前用钾矾明胶包被液进行涂布,干燥后,将切好的脑片贴于明胶玻片上,用吸水纸吸干多余的C液。
(6)染色。将D液、E 液与双蒸馏水以1∶1∶2的体积比混合,现配现用,然后于混合溶液中10 min;再用双蒸馏水冲洗切片2 次,每次4 min。
(7)脱水脱脂。使用50%、75%和95%的乙醇梯度脱水,各4 min,再使用无水乙醇脱水4 次,每次4 min;二甲苯浸泡3 次,每次4 min。
(8)封片。使用中性树脂封片。
(9)成像。使用光学显微镜进行观察。
2 实验结果与分析
2.1 切片性能
图1 所示为Golgi-Cox 方法的实验流程。通过观察4 种不同灌注方式处理后的小鼠脑组织切片,对比分析了其在光学显微镜下的神经标记情况,如图2、3所示。实验中,发现进行振动切片时,尽管都经过AB混合液固定,但3#切片更稳定,切片更完整。4#效果最差,无法获得完整切片,将一张100 μm 的切片进行染色后发现,组织破碎严重,几乎全是非特异性黑色沉积物[图2(j)]。结果表明PFA 灌注更有利于切片的完整性。

图1 Golgi-Cox方法实验流程

图2 100 μm厚小鼠脑片的神经标记结果 (1#:断颈,无灌注;2#:麻醉,生理盐水灌注;3#:麻醉,生理盐水、PFA 灌注;4#:麻醉,生理盐水、AB混合液灌)
2.2 光学显微成像结果及分析
2.2.1 1#制备方法
依据FD Rapid Golgi StainTMKit说明书指示,无需进行去血灌注操作,取出脑组织后直接浸泡于AB 混合液中。1#结果表明其切片背景呈黑灰色,神经元数量随着切片厚度增加而增多[见图2(a)、图3(a)]。海马区呈带状排列的神经细胞染色不清晰,无法有效地区分出单个神经元的胞体及树突[见图2(b)、图3(b)]。大脑皮层区域神经细胞的胞体、树突染色标记模糊,树突相互交错似网状[见图2(c)、图3(c)]。
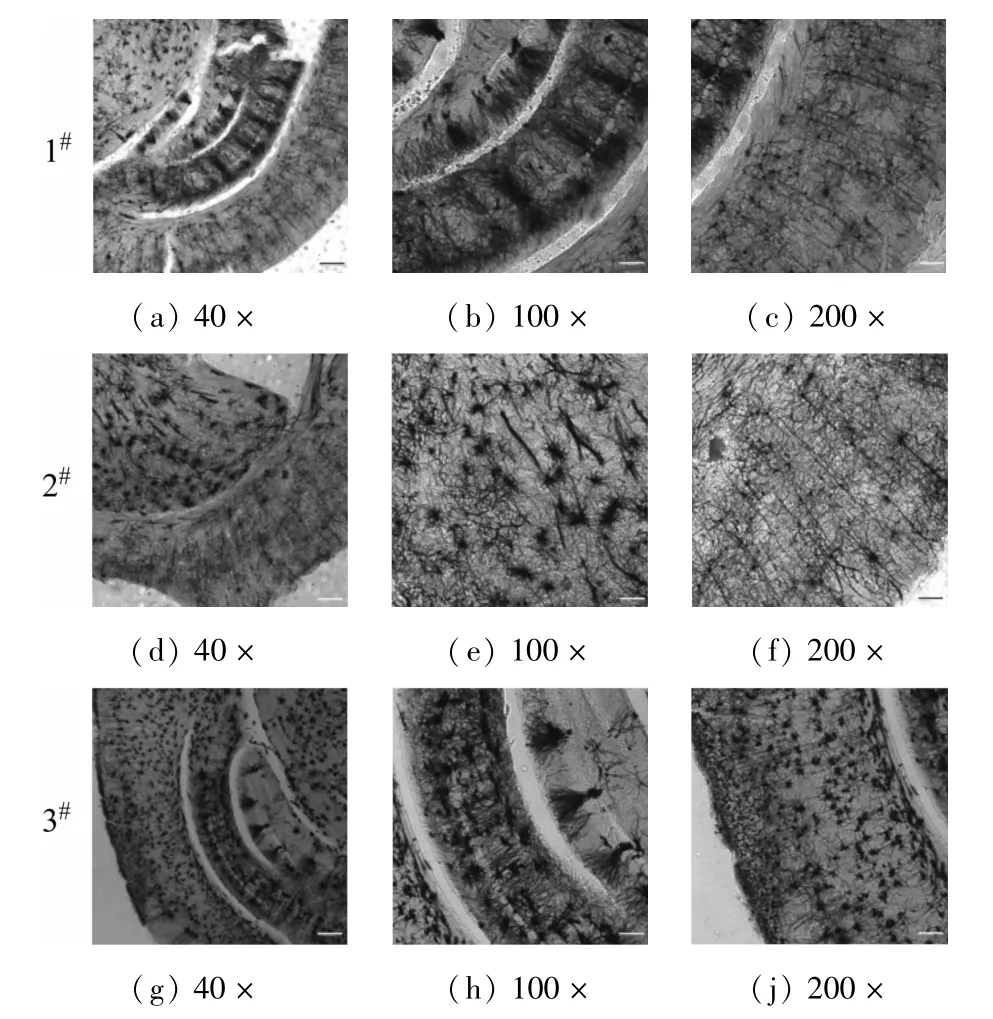
图3 200 μm厚小鼠脑片的神经标记结果 (1#:断颈,无灌注:2#:麻醉,生理盐水灌注;3#:麻醉,生理盐水、PFA灌注)
2.2.2 2#制备方法
在1#的基础上,增加了灌流去血的步骤,结果表明,背景依然呈灰黑色[见图2(d)、图3(d)]。因为切片位置的差异,本文展示了不包含海马区域的切片,其内部核团区域的颗粒细胞明显标记[见图2(e)、图3(e)]。大脑皮层相较于1#标记清晰,但依然存在与背景无法明显区分的问题[见图2(f)、图3(f)]。
2.2.3 3#制备方法
3#通过PFA 灌注,在脑组织离体前进行固定,取出脑后再在AB 混合液中浸渍,可见背景干净呈灰白色,于黑色标记的神经元呈明显反差[见图2(g)、图3(g)]。海马区域的神经元呈规则排列,大脑皮层的神经元胞体及树突也被清晰标记上[见图2(h)~图2(i)、图3(h)~图3(i)]。
2.2.4 脑组织结构分析及意义
按照图1 的实验流程,经过普通光学显微镜成像后,观察到如图2、3 中的海马和大脑皮层结构。海马在学习记忆功能中扮演着重要的角色,且结构相对较简单,适合作为脑模型的重点观察研究部位。此外,研究发现海马的结构功能完整性对癫痫、阿兹海默症等相关精神疾病也尤为重要[10]。海马结构是由海马齿状回和下托三部分构成,该区域细胞紧密排列,界限明显,细胞排列呈带状[见图2(g)][11]。当海马在更高倍数下成像后,可以观察到海马的主要神经元是锥体细胞,齿状回则是颗粒细胞。海马的皮质可分为CA1、CA2、CA3和CA4四部分,可分为分子层(stratum moleculare)、腔隙层(stratum lacunosum)、辐射层(stratum radiatum)、锥体层(stratum pyramidale)和始层(stratum oriens)。齿状回皮质分为分子层、颗粒细胞层和多形细胞层3 层,呈马蹄铁形。
大脑皮层是人脑的高级中枢,思考、感知、处理、理解语言信息等过程都与大脑皮层密切相关,其主要的功能分区有感觉区、运动区、言语区、联合区。大脑皮层主要有三大细胞类型:锥体细胞、颗粒细胞和梭形细胞,其中颗粒细胞最多,锥体细胞次之。如图2(i)所示,大脑皮层由浅至深又可以分为6 层:分子层(神经元小而少)、外颗粒层(包含星形细胞和少量锥体细胞)、外锥体细胞层、内颗粒层(主要是星形细胞)、内锥体细胞层、多形细胞层(以梭形细胞为主)[12]。
2.2.5 树突棘结构的观察
将100 μm的脑片切换到40 倍物镜下进行更高分辨的观察,可见图4 中的红色箭头所指示的突起状结构-树突棘,其密度和形态表明了参与神经可塑性的细胞过程,这与学习和记忆等认知功能相关,并且在一些神经病变中是表现有症状的,如智力迟钝和神经退行性疾病。值得注意的是,通过本研究所建立的实验方法,在高倍镜下成功观察到树突棘,后期可结合高分辨的成像技术及有效的数据分析,在不同的动物模型或疾病模型中对树突棘进行结构和数量的差异分析。树突棘是由许多类型的神经元的树突突起产生的,主要由一个稍细的与树突小分支相连的棘柄和一个与棘柄末端相连的终球组成。根据棘柄和终球的形态特征可分为三类:纤细型、蘑菇型和短粗型[13]。树突棘密度和大小在不同个体间也是不相同的,一个神经元上也可能出现几种不同类型的棘突。Nishiyama 等[14]研究发现树突棘的结构变化是突触可塑性的关键,表明树突棘的形态和可塑性在神经发育障碍中会发生改变。Weir等[15]也报告了自闭症病例中树突棘密度增加。

图4 100 μm厚小鼠神经元树突棘的标记结果 (红色箭头指示的结构为树突棘)
3 结 语
本文主要开展了基于4 种小鼠脑组织样品制备方法,探索一种简单有效的神经标记方法的实验研究。通过观察4 种脑切片在光学显微镜下的制备效果,一方面发现通过在小鼠麻醉后使用PFA灌流,再取脑组织进行AB混合液浸渍所制备的切片背景干净,神经元呈明显反差,海马和大脑皮层神经结构被标记清晰;同时还对切片进行了高倍成像,证明该样品制备方法也能为树突棘结构的研究提供参考。然而,对于海马及大脑皮层的细胞类型和树突棘的类型,需要进一步进行更高分辨率的成像。
综上,本文基于该商业化的试剂盒,结合前期有效的生物样品处理方式及后期脱水、包埋等实验步骤,探索了一套简便,快捷的神经标记方法,为教学、实验科研及神经研究提供可选方案,使神经研究在基础设施有限的实验环境和实验教学中也能高效进行。
