酵母中乙酰辅酶A的代谢工程研究进展
2023-12-11王招悬刘营航刘萌萌祁庆生
王招悬,刘营航,刘萌萌,祁庆生
(山东大学 微生物技术国家重点实验室(微生物技术研究院),山东 青岛 266200)
随着现代生物技术的发展,利用生物技术将可再生碳源转化为工业化学产品已成为理想选择。代谢工程通过调控细胞内代谢网络的通量平衡达到生产目标产物的目的[1]。代谢工程通常致力于满足经济生产和提高产品滴度、产量和速率的需求[2],满足这些需求通常不仅需要优化产物合成的代谢产物途径,而且还需要改造细胞的中心碳代谢途径[3]。
乙酰辅酶A(acetyl-CoA)是微生物中心碳代谢的初级代谢物,参与许多代谢途径,因此代表了代谢的关键节点[4]。它由辅酶A和乙酸通过硫酯键连接组成,充当中间分子,可以在分子之间转移乙酰基,直接参与三羧酸循环(TCA)、脂类代谢、萜类代谢和氨基酸代谢等生化反应。乙酰辅酶A还被用于生产各种高值的平台化学品,包括脂肪酸、1-丁醇、聚羟基链烷酸酯、萜类、聚酮化合物和类异戊二烯等。因此,许多代谢工程学者致力于增加细胞内乙酰辅酶A的水平,以此用作一系列不同产品的前体[3]。
与原核生物相比,酵母中乙酰辅酶A的代谢是分区室进行的,在细胞质、线粒体、过氧化物酶体和细胞核中都存在乙酰辅酶A的代谢途径,且不同的区室之间乙酰辅酶A不能自由穿梭[5]。此外,酵母中乙酰辅酶A合成酶(ACS)对底物亲和力较低,并需要消耗能量,是酵母细胞生长代谢的一个关键限速步骤。由于酵母中乙酰辅酶A的分区现象,只将ACS过表达难以增加总的乙酰辅酶A的含量[6],因此,研究人员常用代谢工程改造乙酰辅酶A的合成途径,以大幅提高酵母乙酰辅酶A的含量。
研究者已经使用了多种策略来提高胞内乙酰辅酶A的供应,包括丙酮酸脱氢酶(PDH)旁路途径、PDH途径、磷酸转酮酶和磷酸转乙酰酶(PK-PTA)途径以及柠檬酸裂解、β-氧化和添加乙酸以增加乙酰辅酶A的含量[7-10],还有研究者引入了异源的乙酰辅酶A合成途径,以达到增加目标产物产量的最终目的[6-11]。本文在概述酵母乙酰辅酶A的代谢途径基础上,总结酵母代谢工程中增加乙酰辅酶A的策略及研究进展。
1 酵母中乙酰辅酶A代谢途径
酵母中的乙酰辅酶A代谢途径主要存在于胞质(胞浆、细胞器)以及细胞核中(图1)。在目前的代谢工程改造中,大多数参与乙酰辅酶A合成途径的酶通常在酵母胞浆中表达,因此产物产量取决于胞浆中乙酰辅酶A的含量[12]。在细胞质中,有2种需要消耗ATP合成乙酰辅酶A的途径:一是PDH旁路途径,即从丙酮酸到乙醛再到乙酸,最后生成乙酰辅酶A;另一个是柠檬酸裂解酶(ACL)途径,以柠檬酸为底物,消耗1分子ATP,生成乙酰辅酶A和草酰乙酸[13]。
胞质中的PDH旁路途径是酿酒酵母生产乙酰辅酶A的主要途径,该途径的关键在于acs基因。ACL途径则是产油酵母所特有的乙酰辅酶A合成途径,如解脂耶氏酵母中的ACL基因能够高效催化柠檬酸产生乙酰辅酶A。在代谢工程改造中,通常借鉴2种酵母的优势途径,由此提高胞质中乙酰辅酶A 的含量。
除胞浆外,线粒体和过氧化物酶体等细胞器也是重要的乙酰辅酶A生成场所。细胞器中合成乙酰辅酶A的途径有4种:一是线粒体中的PDH途径,由丙酮酸脱氢酶复合体催化丙酮酸生成乙酰辅酶A;二是线粒体中通过支链氨基酸(亮氨酸和赖氨酸)和脂肪酸的降解来产生乙酰辅酶A;三是过氧化物酶体中乙酰辅酶A合成酶催化乙酸合成;最后一个是在过氧化物酶体中通过脂肪酸的β-氧化合成[14]。另外,由线粒体中相关途径产生的一部分乙酰辅酶A也可能被转运到细胞质中用于脂肪酸合成[15]。
1.1 胞质中乙酰辅酶A合成途径
PDH旁路途径是酵母胞质中的乙酰辅酶A生产途径,由丙酮酸脱羧酶(PDC)、乙醛脱氢酶(ALD)和乙酰辅酶A合成酶(ACS)组成。PDH旁路途径是厌氧条件下酵母细胞能够进入TCA循环的关键途径。当酵母细胞在厌氧条件下生长时,丙酮酸脱氢酶的酶活性受到抑制[16-17],因此,在厌氧条件下,PDH途径不能为TCA循环提供乙酰辅酶A。而PDH旁路途径中丙酮酸脱羧酶的活性却不会因厌氧条件而被抑制,因此糖酵解产生的丙酮酸经过丙酮酸脱羧酶产生乙醛,然后将乙醛转化为乙酸,最后生成乙酰辅酶A[18-19]。在PDH旁路途径中,乙醛脱氢酶(ALD2-6)以烟酰胺腺嘌呤二核苷酸(NAD+)或NADP+作为辅因子将乙醛转化为乙酸酯[20];ACS1/2催化的是从乙酸合成乙酰辅酶A,这一步中ATP被水解为AMP[21-22]。整个过程消耗2个ATP,而ATP的消耗会降低以葡萄糖为底物生产的乙酰辅酶A衍生物的产量[22]。
柠檬酸裂解途径的酶是ATP:柠檬酸裂解酶(ACL),ACL是糖代谢和脂肪酸生物合成的关键酶,它作用的底物和产物都是糖代谢中的关键中间产物。柠檬酸裂解酶在生物体中发挥重要的作用,如,生成胞间乙酰辅酶A、作为脂肪酸合成的调控酶、提高产油作物的产油量、提高植物的抗逆性以及参与有性生殖的调节等[23]。
由于乙酰辅酶A无法穿过线粒体膜,因此需要利用TCA循环生成的柠檬酸进行穿梭,即线粒体中的乙酰辅酶A在柠檬酸合酶的作用下先与草酰乙酸生成柠檬酸,然后柠檬酸通过柠檬酸转运系统穿过线粒体到细胞质中,在ACL的作用下与CoA生成乙酰辅酶A和草酰乙酸,ACL能将1分子柠檬酸裂解为1分子乙酰辅酶A和1分子草酰乙酸,消耗1分子ATP[24],通过间接将线粒体中的乙酰辅酶A转运至细胞质中,从而实现细胞质中乙酰辅酶A的积累。以这种方式提供胞质乙酰辅酶A也依赖于线粒体形成柠檬酸的活性,且酵母细胞中葡萄糖会抑制线粒体活性,这种抑制则可能影响线粒体中柠檬酸的形成及其在线粒体和细胞质之间的转运过程[25]。
磷酸转酮酶(PK)是在异型发酵和兼性同型发酵乳酸菌以及双歧杆菌中发现的,用于替代糖酵解途径来异化葡萄糖的酶[26]。PK同时具有木酮糖-5-磷酸磷酸转酮酶和果糖-6-磷酸磷酸转酮酶2种活性,分别作用于木酮糖-5-磷酸和果糖-6-磷酸,产生1分子的二碳单元乙酰磷酸,剩余的碳单元甘油醛-3-磷酸以及赤藓糖-4-磷酸则进入戊糖磷酸途径回收利用[27]。磷酸转乙酰酶(PTA)则在此之后将乙酰磷酸催化成乙酰辅酶A。在此途径中,PK以1分子果糖-6-磷酸、木酮糖-5-磷酸或核酮糖-5-磷酸为底物,将糖磷酸盐和无机磷酸盐转化为1分子乙酰基-磷酸和赤藓糖-4-磷酸或甘油醛-3-磷酸[28],乙酰磷酸进而再被PTA催化生成乙酰辅酶A,或被乙酰激酶催化生成乙酸,最后由乙酰辅酶A合成酶催化生成乙酰辅酶A,最终1分子葡萄糖通过PK-PTA途径合成3分子乙酰辅酶A,消耗1分子ATP,比PDH旁路途径多合成1分子乙酰辅酶A,少消耗1分子ATP[29]。
1.2 细胞器中乙酰辅酶A合成途径
PDH旁路途径是线粒体中由丙酮酸产生乙酰辅酶A的途径。经糖酵解产生并进入线粒体部分的丙酮酸经丙酮酸脱氢酶(PDH)复合体催化生成乙酰辅酶A。PDH复合体是酿酒酵母中最复杂的蛋白复合体之一,由E1、E2、E3和6种辅因子(二磷酸硫胺、硫辛酸、FAD、CoA、NAD+和Mg2+)构成,它不可逆地催化丙酮酸生成乙酰辅酶A,同时酿酒酵母可从转录和转录后水平对PDH 复合体进行调控[30]。硫胺素焦磷酸与E1结合并参与丙酮酸脱羧;硫辛酸酯共价连接到E2的保守赖氨酸残基上,并介导E1、E2和E3活性位点之间的中间体易位,而黄素腺嘌呤二核苷酸(FAD)和NAD+是E3对二氢硫辛酸酯再氧化所必需的[31]。然而,乙酰辅酶A不能自由地在不同细胞器之间穿梭[32],只可通过乙醛酸循环或肉碱/乙酰肉碱穿梭作用提供给其他区室[33],所以酵母线粒体中的PDH旁路途径不能满足胞质乙酰辅酶A需求[34]。因此,在酵母中引入了细菌的PDH旁路途径,可以在细胞质中利用PDH旁路途径产生更多的乙酰辅酶A[10]。
通过降解支链氨基酸(如亮氨酸)也可以合成乙酰辅酶A。在真菌中,L-赖氨酸可由α-氨基己二酸途径的可逆反应而降解,该途径的前半部分开始于赖氨酸逐步降解为糖精、2-氨基己二酸酯-6-半醛、2-氨基己二酸酯、戊二酰二氢脂酰胺和戊二酰辅酶A,然后戊二酰辅酶A通过一系列酰基辅酶A中间体修饰以生成乙酰辅酶A[35]。
1.3 乙酰辅酶A的降解途径
乙酰辅酶A最重要的降解途径是乙醛酸途径。在这个途径中,胞质乙酰辅酶A和乙醛酸在苹果酸合酶(MLS)的催化下生成苹果酸,苹果酸脱氢生成草酰乙酸,草酰乙酸再与乙酰辅酶A生成柠檬酸。此过程会消耗乙酰辅酶A结合生成琥珀酸以合成葡萄糖[36]。在酿酒酵母中,乙酰辅酶A会流向脂肪酸和甾醇的代谢,参与蛋白质的乙酰化过程[37]。在解脂耶氏酵母中,大多数胞质乙酰辅酶A均流向脂质生物合成。因此,调节细胞质中乙酰辅酶A的降解途径对于提高异源代谢产物的产量至关重要。
2 提高乙酰辅酶A产量的代谢工程策略
2.1 PDH旁路途径
通过PDH旁路途径基因的过表达可以实现目标产物的增加。对PDH旁路途径的优化,可以使酵母细胞工厂表现出更佳的乙酰辅酶A衍生产品的生产优势。对PDH旁路途径的改造主要集中在ADH、ALD和ACS等酶的改造。钱泓[7]考察单独或组合ACS和ALD的过表达来研究其对乙酰辅酶A产量的影响,结果发现:在酿酒酵母中过表达了ALD6,乙酰辅酶A的含量在摇瓶水平和发酵罐水平,分别提高了41.59%和24.62%;单独过表达ACS1及ACS2,而过表达ACS1的细胞中乙酰辅酶A的含量在摇瓶水平和发酵罐水平分别提高了44.34%和56.34%,而过表达ACS2产生乙酰辅酶A的含量则分别提高了42.60%和30.94%;对ACS1定点突变后,乙酰辅酶A的含量提高了1.04倍;共表达ALD6和ACS1,导入双倍体菌株中,乙酰辅酶A的含量提高了63.70%;再将共表达片段转入单倍体菌株中,乙酰辅酶A的含量提高了1.5倍。
引入外源基因以替代酵母内源基因亦会对乙酰辅酶A及终产物产生影响,Song等[38]在酿酒酵母中引入了密码子优化的大肠杆菌乙酰化乙醛脱氢酶基因eutE,并删除ALD6的编码基因,成功提高了细胞内乙酰辅酶A的水平,并使终产物乳酸的产量在40 h内达到142 g/L。
Shiba等[6]研究发现,改造酿酒酵母PDH旁路途径中的adh、ald6和acs基因可增强细胞内乙酰辅酶A的供应,从而增加倍半萜烯化合物吗啡二烯的产量。为了在解脂耶氏酵母细胞质中提供更多的乙酰辅酶A,Chen等[39]使用可响应不同葡萄糖浓度的HXT7启动子过表达内源性ADH2编码基因、乙酰转移酶ERG10编码基因以及ALD6编码基因,结果发现,这些基因的过表达使α-檀香烯的产量提高了4倍。Liu等[40]对ALD6、ACS1/ACS2和ADH2进行过表达后发现,同时过表达ADH2、ALD6、ACS1时β-amyrin产率最高,为(4.4±0.2) mg/g,与对照菌株相比提高了42%。Kocharin等[11]在酿酒酵母中将含有ADH2、ALD6、ERG10和来自Salmonellaenterica变体的ACS(ACSL641P)的乙酰辅酶A增强质粒和含有编码乙酰辅酶A乙酰转移酶(PhaA)、NADPH连接的乙酰乙酰辅酶A还原酶(PhaB)和来自RalstoniaeutrophaH16的聚3-羟基丁酸酯聚合酶(PhaC)基因的质粒共同转进酿酒酵母,工程菌上罐发酵36 h后,PHB的滴度为43.11 mg/L。Liu等[41]基于毕赤酵母构建了一个新的生物合成系统(ESAD),以生产莫纳克林L(DML)的菌株为例来测试ESAD系统,以此表达了异源的DML合成途径的基因,并使用GAP启动子来组成过表达ADH2和乙酰化位点突变体ACS1与巴斯德毕赤酵母ACC1(ACC1的保守位点突变)[13]以增加乙酰辅酶A的含量,结果发现:基因的共同过表达可改善DML的生物合成,并且通过增强乙醇转化为丙二酰辅酶A的代谢步骤,DML的产量提高了2倍,达到125.6 mg/L。
2.2 柠檬酸裂解途径
在酵母中,柠檬酸主要在线粒体中产生,在TCA循环中被消耗。线粒体中生成的柠檬酸一部分被柠檬酸转运蛋白CTP1转运至细胞质[42],经ACL催化产生胞质乙酰辅酶A。在代谢工程改造中,常过表达或引入外源ACL基因以增加胞质乙酰辅酶A的含量。Jin等[8]在解脂耶氏酵母中过表达ACL2增加乙酰辅酶A水平,使总三萜和白桦酸的产量分别增加1.23和1.30倍。Huang等[36]以解脂耶氏酵母为模型,利用新构建的基因组级代谢模型分析代谢网络,将异源ACS或内源性ACL1基因过表达,使胞质乙酰辅酶A的含量增加50%以上。Liu等[40]引入异源乙酰辅酶A合成途径——ACL途径,并在培养基中添加柠檬酸以提高β-amyrin产量,结果发现:当添加1 g/L柠檬酸时,β-amyrin的最高产率达到(4.2±0.4) mg/g,提高了36%。在产油酵母中,控制柠檬酸通量从TCA循环向ACL转移的主要调节机制是由抑制线粒体异柠檬酸脱氢酶(ICDH)实现的[43]。酿酒酵母包含NADP+和NAD+依赖性线粒体ICDH,在野生型细胞中,NAD+依赖的线粒体ICDH介导了大部分细胞通量分配[44-45]。因此,为增加酿酒酵母柠檬酸的含量以促进ACL途径产生乙酰辅酶A,Rodriguez等[46]结合ACL基因的过表达和敲除线粒体NAD+依赖的异柠檬酸脱氢酶(IDH1)基因,使甲羟戊酸的产量比对照组增加了3倍。
2.3 PDH途径
酵母胞质中没有内源的PDH途径,因此,为增加胞质乙酰辅酶A含量,许多研究引入了外源的PDH途径。Liu等[10]将细菌复杂的PDH途径与解脂耶氏酵母的代谢相结合,组装了编码PDH的3个催化亚基E1、E2和E3的基因[47],这3个基因一起组装后再与G.hybrida的2-吡喃酮合酶(GH2PS)一起过表达。脂蛋白连接酶A在PDH的E2亚基脂化中起关键作用[4,48]。因此,Liu等[10]共表达了脂酸盐-蛋白质连接酶A(LplA),使三乙酸内酯(TAL)产量增加了1.5倍,达到0.67 g/L。Zhang等[49]在酿酒酵母胞质中表达了由pdhA、pdhB、aceF和lpd及来自E.faecalis的lplA和lplA2编码的PDH复合体,同时表达了脂酸连接酶以及Streptococcusmutans中的NADP+依赖性甘油醛-3-磷酸脱氢酶(GapN),在表达胞质丙酮酸复合体前还删除了酵母细胞内的磷脂酸磷酸酶基因(pah1、dpp1和lpp1)和主要的固醇酯形成基因are1,最终得到的菌株,在NAD+依赖性甘油-3-磷酸脱氢酶编码基因gpd1和gpd2缺失的条件下,游离脂肪酸(FFA)产量增加了83%,达到840.50 mg/L。
在PDH途径中,除E1、E2和E3这3个PDH亚基外,还有6个重要的辅因子,因此对辅因子进行改造也可增加乙酰辅酶A含量。Cardenas等[50]对酿酒酵母中的辅因子和转运机制进行了改造,以增强乙酰辅酶A和聚酮化合物的生物合成。在酵母中表达了大肠杆菌丙酮酸脱氢酶复合物(PDHm)的NADP+变体[51],并将NADPH/NADP+的比率和乙酰辅酶A产量与基础菌株进行了比较,随后将PDHm过表达与葡萄糖6-磷酸脱氢酶zwf1基因缺失相耦联,进一步驱使碳通量流向乙酰辅酶A,额外的途径设计结合了关键的基因破坏,从而减少了丙酮酸和乙酰辅酶A的线粒体转运,结果发现:分批培养24 h时,表达PDH和PDHm菌株的乙酰辅酶A含量分别增加了2.3和2.4倍;将zwf1基因敲除与PDHm过表达结合时,乙酰辅酶A含量增加了3倍,并导致TAL的含量增加了4.5倍。
2.4 氨基酸途径
尽管以上途径都不同程度地增加了乙酰辅酶A的含量,但由丙酮酸或柠檬酸转化为乙酰辅酶A必定会导致碳损失[52],因此有必要开发以其他前体途径来增加乙酰辅酶A含量。
利用氨基酸合成途径来增加乙酰辅酶A的含量。Kim等[18]通过操纵TCA循环中间体的利用途径(如苏氨酸生物合成途径)来增加通过TCA循环的通量,还利用氨基酸生物降解途径来增加乙酰辅酶A的含量。然而这些策略只存在理论阶段,需要进一步的应用研究。
Liu等[53]通过增强辅酶A的合成来提高乙酰辅酶A的产量,结果发现:在酿酒酵母中,泛酸激酶(PanK)由cab1基因编码,为了提高辅酶A的合成,在强组成型启动子(截短的HXT7启动子)下过表达cab1,使柚皮素达到0.88 mg/L,与未表达cab1基因的对照相比,柚皮素的产量提高了2倍。
2.5 乙酰辅酶A降解途径
调节细胞质中乙酰辅酶A的竞争途径对于提高异源代谢产物的产量至关重要。一方面,可使用抑制剂来阻断下游产物的生成。Marsafari等[54]使用浅蓝菌素作为抑制剂,抑制3-酮酰基-ACP合酶Ⅰ和Ⅱ来阻断脂质的合成,最终使目标产物紫杉二烯产量达到171.45 mg/L,提高了231.13%。另一方面,可敲除乙酰辅酶A生成过程中的竞争途径。在酿酒酵母中,Lian等[55]通过敲除编码催化乙醇形成的基因adh1和adh4以及催化产生甘油的基因gpd1和gpd2,使糖酵解通量更多流向乙酰辅酶A,最终使正丁醇产量提高4倍。
在过氧化物酶体中,乙酰辅酶A能通过ACS1催化乙酸生成乙酰辅酶A[56],Cit2和Mls1分别催化乙酰辅酶A与草酰乙酸或乙醛酸的缩合反应,乙酰辅酶A在过氧化物酶体中通过乙醛酸途径转变成四碳有机物(苹果酸和琥珀酸)[39]。迄今为止,对酵母中过氧化物酶体的乙酰辅酶A生成途径的改造很少,主要是敲除cit2和mls1以阻断乙酰辅酶A流向乙醛酸途径,增加胞质中乙酰辅酶A的积累。如,Huang等[36]为保障乙酰辅酶A流向目标产物,分别将解脂耶氏酵母中编码过氧化物酶体柠檬酸合酶和苹果酸合酶的基因cit2和mls1敲除,结果发现:这2种基因的缺失都有利于胞质乙酰辅酶A的积累,其中cit2基因的去除使乙酰辅酶A产量增加了66.7%。Chen等[39]在酿酒酵母菌株中敲除cit2和mls1,以乙醇为碳源,改造菌株的α-檀香烯产率提高了2~3倍。
2.6 PK-PTA途径
在酵母细胞质中引入PK和PTA的基因,使酵母能够通过PK-PTA途径来生成乙酰辅酶A,利用PK-PTA代谢途径来增加合成乙酸和乙酰辅酶A的碳流量。目前,在酿酒酵母中成功异源表达PK和PTA[9],并将此途径与胞质中其他途径(如PDH旁路途径及乙酰辅酶A降解途径)相结合,实现增加乙酰辅酶A含量的目的。
Murarka等[9]在酿酒酵母中表达PK、PTA、乙酰化乙醛脱氢酶(A-ALD)和NADH-HMGr,以此重新构建乙酰辅酶A的代谢途径,结果发现:这不仅可以降低乙酰辅酶A合成过程中能量的需求和碳的损失,还能平衡途径中的NADH,最终以葡萄糖为底物,重组菌株的法尼烯产量增加了25%。Meadows等[57]通过乙酰磷酸(ACP)来产生乙酰辅酶A,该途径绕过CO2释放反应来保存碳[29,58],并用乙酰化的ALD替代酿酒酵母的ALD6、ACS1和ACS2,用NADH特异性HMG辅酶A(NADH-HMGr)替换依赖NADPH的天然HMGr,以减少法呢烯合成过程中辅因子使用的变化,最终在过表达ADA、NADH-HMGr、PK和PTA且删除甘油-3-磷酸酶(RHR2)基因的条件下,法呢烯的时空产率为2.24 g/(L·h),产量提高了17.3%。Liu等[40]表达5-磷酸木酮糖(X5P)特异性PK和PTA,将PK-PTA途径与其他乙酰辅酶A供应途径整合,结果发现:辅酶A与大肠杆菌的乙酰化乙醛脱氢酶(A-ALD)共表达可催化乙醛向乙酰辅酶A的转化;此外,用NADH-HMGr替换天然依赖NADPH的HMGr,同时破坏菌株中的乙醛酸途径以进一步去除乙酰辅酶A的竞争途径,最终在过氧化物酶体柠檬酸合酶基因(cit2)缺失的条件下,β-amyrin的产量提高了42%。
PK-PTA途径还可以耦合外源的非氧化糖酵解(NOG)途径,一同增加乙酰辅酶A含量。Qiao等[59]为使解脂耶氏酵母中脂质的产量最大化,设计解脂耶氏酵母工程化胞质非氧化糖酵解(NOG)途径,使糖代谢绕过糖酵解(EMP)途径,结果发现:该策略可由1 mol葡萄糖产生3 mol乙酰辅酶A;为激活NOG途径,在菌株中同时表达了PK和PTA,最终重组菌株在摇瓶发酵中细胞干质量增加了41%,脂质含量增加了16.4%。
在细胞质内,丙酮酸可以通过丙酮酸氧化酶(PO)催化脱羧生成乙酰磷酸,随后,PTA将乙酰磷酸转化为乙酰辅酶A。为了恢复丙酮酸羧化酶缺陷(PDC-)酿酒酵母菌株在过量葡萄糖培养基中的生长性能,Dai等[60]在PDC-酿酒酵母菌中建立了不依赖ATP的胞质乙酰辅酶A生成途径,用异源的PTA和PO替代天然的乙酰辅酶A合成酶ACS1和ACS2,结果发现:该策略的比生长速率为0.086 h-1;在此条件下,乙酰辅酶A衍生物法呢烯和3-羟基丙酸的产量分别为20.50和61.40 mg/L。
代谢工程的最新研究进展为生产所需化合物提供了理论和实践的指导。乙酰辅酶A是微生物细胞内一个非常重要的中间代谢产物,不仅参与多种代谢途径,维持细胞正常生长水平,同时也是多种化合物的前体。表1列出了部分酵母提高乙酰辅酶A的策略。通常,研究人员采取的措施包括过表达天然乙酰辅酶A合成途径中关键基因,删除或弱化下游竞争途径,在酵母中引入异源的乙酰辅酶A合成途径以及通过引入异源的基因与天然乙酰辅酶A合成途径进行重新连接。
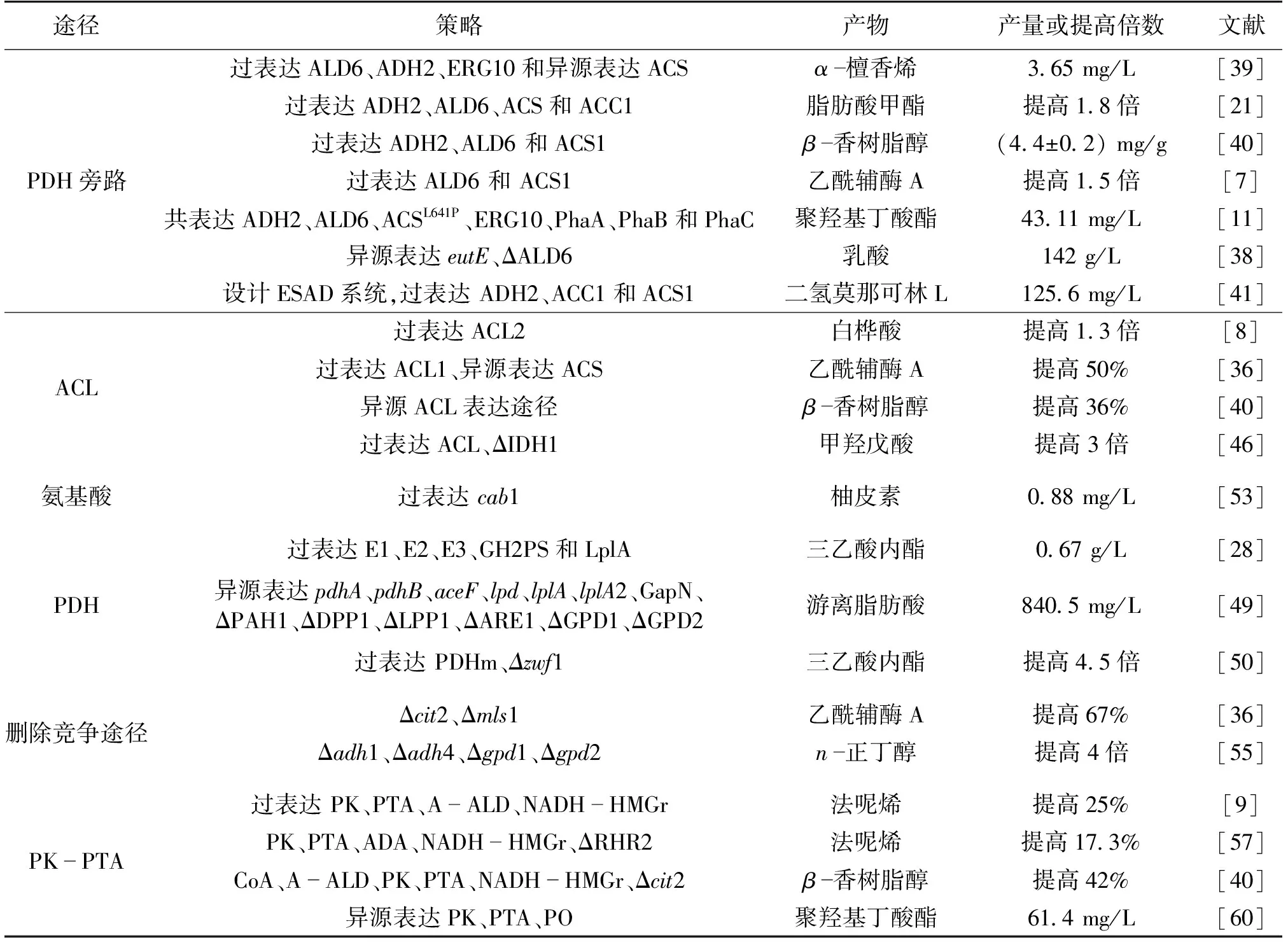
表1 酵母提高乙酰辅酶A产量的策略
3 总结与展望
代谢工程的操作工具和生物信息学的发展为生物合成途径的进一步设计提供了条件,基因组规模的代谢网络分析,特别是机器学习,为开发新的代谢工程策略以增加各种化合物的生产率和产量提供了有效的方法。如大肠杆菌存在的NOG途径、反向乙醛酸途径、丙二酰辅酶A-甘油途径和苏氨酸旁路途径。若将大肠杆菌中的反向乙醛酸途径、丙二酰辅酶A-甘油途径和苏氨酸旁路途径结合在一起,能实现由1分子的磷酸烯醇式丙酮酸或丙酮酸生成2分子的乙酰辅酶A,这为酵母的乙酰辅酶A代谢工程设计提供了借鉴。此外,一些新兴的基因编辑技术和工具也可为酵母代谢工程提高乙酰辅酶A产量提供有效的方法,如CRISPR-CAS9、胍基/胸腺嘧啶(GT)DNA组装标准GTS、pMRI介导的分散组装、染色体整合技术以及模块化控制系统等。
总之,本文综述了酵母中乙酰辅酶A的代谢途径和代谢工程方法,通过不同种类酵母的乙酰辅酶A代谢途径的比较和分析,为提高酵母代谢工程提供了依据,也为利用酵母进行绿色制造提供了帮助。
