Al/Cr2O3对硝化棉热分解过程的影响
2023-12-11赵宁宁马海霞姚二岗赵凤起
赵宁宁,马海霞,姚二岗,安 亭,赵凤起
(1.西安理工大学 理学院,陕西 西安 710054;2.西北大学 化工学院,陕西 西安 710069;3.西安近代化学研究所 含能材料全国重点实验室,陕西 西安 710065)
引 言
燃烧催化剂是含能材料的关键组分,主要用于调控含能材料能量释放、改善推进剂燃烧波结构、调节固体推进剂性能[1-3]。伴随纳米科学技术的发展,纳米燃烧催化剂得到开发利用。通过改变高能组分和黏合剂的热导系数、热解能垒、反应热和气相反应机理,纳米燃烧催化剂可提高含能材料的分解速率、燃烧速率和燃烧效率[4]。与传统金属燃烧催化剂相比,纳米燃烧催化剂界面接触得到改善,扩散距离减小,有助于传质和传热,在高热效率和能量密度、高反应速率和灵敏度调控方面独具优势[5]。纳米铝热剂是纳米燃烧催化剂的典型代表,因其固体颗粒间接触紧密、传输距离短,故表现出更高的燃烧性能、更多的能量释放、更快的反应速率[6]。此外,由于其高表面积、小颗粒尺寸和高表面原子迁移率,纳米铝热剂展现出优异的热催化活性,能够显著提高含能材料体系热效率、点火、导热、燃烧等综合性能[7-8]。
硝化棉(NC)具有成本低、燃烧焓高、易燃易爆和无烟等突出特点,广泛应用于火药、炸药、发射药、爆炸胶、推进剂等民用和军事领域[9-11]。作为高能黏合剂,评估NC热分解过程的活化能、反应模型、热解途径和热安全性等对NC及NC基含能材料的燃烧和爆轰性能至关重要。研究表明,添加纳米铝热剂可调节NC及NC基含能材料的热分解特性和能量性能。Al(70nm)/Fe2O3(5nm)使NC(含氮量11.6%)热分解放热量增加38.59%,表观活化能降低14.5%[12]。Al/CuO对NC催化性能优于CuO,可更大程度降低NC热分解能垒,Al/CuO(片状)/NC复合物自加速分解温度、临界热点火温度低,说明Al/CuO(片状)/NC更易被点燃[13]。Al/MnO2使NC热分解放热量增加150%,点火温度降低8℃,表观活化能减少42kJ/mol,传播指数提高261%[14]。可见,添加纳米铝热剂是提高NC基含能材料性能的有效方式[15-17]。
鉴于此,本研究基于前期工作基础,为探究Al/Cr2O3对NC热分解特性的影响,首先采用超声复合法得到Al/Cr2O3,进而运用差示扫描量热法(DSC)和热红联用技术(TG/DTG-FTIR)分析了Al/Cr2O3/NC复合含能材料的热行为、分解动力学及催化热解机理,以期为Al/Cr2O3在含能材料领域的应用提供参考。
1 实 验
1.1 原料和仪器
纳米Al粉(粒径约50nm),焦作伴侣纳米材料工程有限公司;纳米Cr2O3(粒径约100nm),自制[18];正己烷(C6H12,分析纯),天津市富宇精细化工有限公司;NC(含氮量12.6%),西安近代化学研究所。
Quanta400型扫描电镜(SEM),美国FEI公司;INCA ENERGY 350型X射线能谱仪(EDS),英国Oxford Instruments 公司;Carl Zeiss SMT Pte Ltd型透射电镜(TEM),德国蔡司公司;D/MAX-3C型X射线粉末衍射仪(XRD),日本理学Rigaku公司;TA Q2000型差示扫描量热仪(DSC),美国TA公司;Netzsch STA409/Brucker V70型热重/红外光谱联用仪(TG/DTG-FTIR),德国耐驰仪器/德国Bruker公司。
1.2 Al/Cr2O3的制备
将纳米Cr2O3和纳米Al粉分别置于装有正己烷的反应容器中超声分散1h,随后将分散好的两种样品置于同一反应容器中,在60℃下继续超声分散2h。待分散剂蒸发后于室温下老化,最后移至真空干燥箱中将样品干燥。所得样品标记为Al/Cr2O3。
1.3 样品表征
采用扫描电镜(SEM)对Al/Cr2O3形貌进行表征,场发射电压为30kV,电流为4A。采用X射线能谱仪(EDS)对材料组成进行分析,探测器实测分辨率为125~130eV,分析元素范围Be4~U92。采用透射电镜(TEM)分析样品结构和形貌,操作电压200kV,点分辨率≤0.24nm,信息分辨率≤0.14nm,能量分辨率≤0.7eV。采用X射线粉末衍射仪(XRD)对样品物相组成进行解析,X射线源为CuKα,波长为0.15406nm,测角仪精度±0.02°,重现性±0.03°(2θ),强度综合稳定度±0.5%。
1.4 热分解特性测试
采用差示扫描量热仪(DSC)在动态高纯N2气氛(50mL/min)下,测试分析Al/Cr2O3对NC热分解过程的影响,温度范围为50~300℃,升温速率为5、10、15、20、25、30℃/min。利用热重/红外光谱联用仪(TG/DTG-FTIR)在高纯N2气氛下(20mL/min)分析Al/Cr2O3/NC复合物热分解反应产生的气体产物。
2 结果与讨论
2.1 形貌及结构表征
Al/Cr2O3的SEM、TEM和EDS图如图1所示。

图1 Al/Cr2O3的SEM图、TEM图和EDS谱图Fig.1 SEM image, TEM image and EDS pattern of Al/Cr2O3
由图1(a)可知,Al粉与Cr2O3均为颗粒状,颗粒尺寸分布较均匀。由于两者颗粒均较小,表面能较大,纳米Cr2O3颗粒与纳米Al颗粒复合后相互“粘附”,呈团聚现象。由图1(b)可知,纳米Cr2O3颗粒为不规则椭球体,纳米Al小颗粒表面粗糙,两者团聚现象较明显。由图1(c)可知,样品中含Cr、O和Al元素,与Al/Cr2O3样品元素组成一致。
图2为Al/Cr2O3的XRD谱图。从图2可知,2θ为25.40°、34.39°、37.10°、39.69°、42.27°、45.41°、50.86°、55.49°、58.89°、63.93°、65.70°、73.46°、77.40°和79.17°处的特征衍射峰,依次对应于Cr2O3(JCPDS No. 38-1479)的(0 1 2)、(1 0 4)、(1 1 0)、(0 0 6)、(1 1 3)、(2 0 2)、(0 2 4)、(1 1 6)、(1 2 2)、(2 1 4)、(3 0 0)、(1 1 9)、(2 2 0)和(3 0 6)晶面,属于六方晶系,空间群R-3c(167),晶胞参数a=b=4.9619Å,c=13.7128Å,α=β=90°,γ=120°。2θ为39.41°、45.50°、65.75°和78.77°的特征衍射峰依次对应于Al(JCPDS No. 65-2869)的(1 1 1)、(2 0 0)、(2 2 0)和(3 1 1)晶面,属于立方晶系,空间群Fm-3m(225),晶胞参数a=b=c=4.05Å,α=β=γ=90°。XRD谱图无其他杂质峰,说明样品为Al和Cr2O3的复合物,且未发生化学反应。由于两者掺杂,致使相应XRD衍射峰略微发生红移。

图2 Al/Cr2O3的XRD谱图Fig.2 XRD pattern of Al/Cr2O3
2.2 Al/Cr2O3/NC热分解行为分析
NC和Al/Cr2O3/NC在加热速率10.0℃/min的DSC曲线如图3所示。
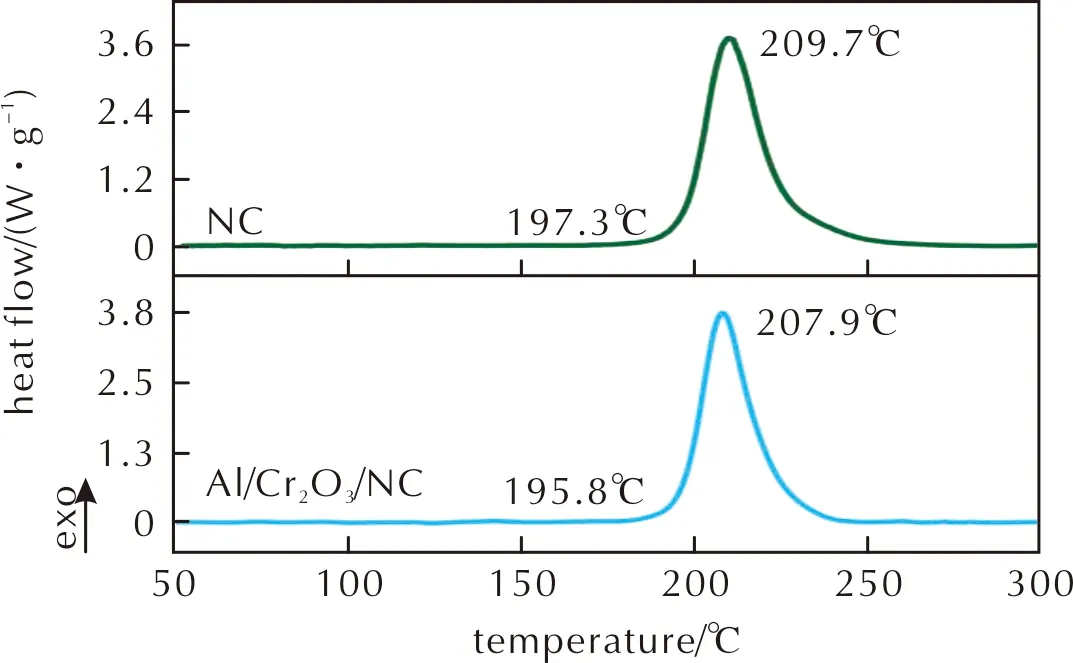
图3 NC和Al/Cr2O3/NC在加热速率10.0℃/min下的DSC曲线Fig.3 DSC curves of NC and Al/Cr2O3/NC at the heating rate of 10.0℃/min
由图3可知,NC和Al/Cr2O3/NC热分解过程均仅呈现一个放热峰,对应于NC热分解过程中O—NO2的断裂,随后为自催化平行反应[19-20]。在10.0℃/min加热速率下,NC热分解峰温为209.7℃,该值与文献报道值(209.2℃)非常接近[21]。当加热速率为10.0℃/min时,Al/Cr2O3/NC的起始热分解温度比NC的低1.5℃;Al/Cr2O3/NC的热分解峰温比NC的低1.8℃,比文献[13]报道CuO(b)-NC、CuO(f)-NC、Al/CuO(b)-NC和Al/CuO(f)-NC的热分解峰温分别低1.3、1.3、1.6和1.4℃,说明Al/Cr2O3能够加快NC的热分解反应。
2.3 Al/Cr2O3//NC热分解动力学
基于加热速率分别为5、10、15、20、25和30℃/min的DSC测试数据,通过Flynn-Wall-Ozawa (FWO)方程[式(1)][22]、Kissinger-Akahira-Sunose (KAS)方程[式(2)][23]和Friedman方程[式(3)][24]研究了NC和Al/Cr2O3/NC热分解动力学过程。通过反应转化率α与温度T的关系曲线(见图4),采用FWO法、KAS法和Friedman法确定NC和Al/Cr2O3/NC的动力学参数(表观活化能Eα、指前因子A)。
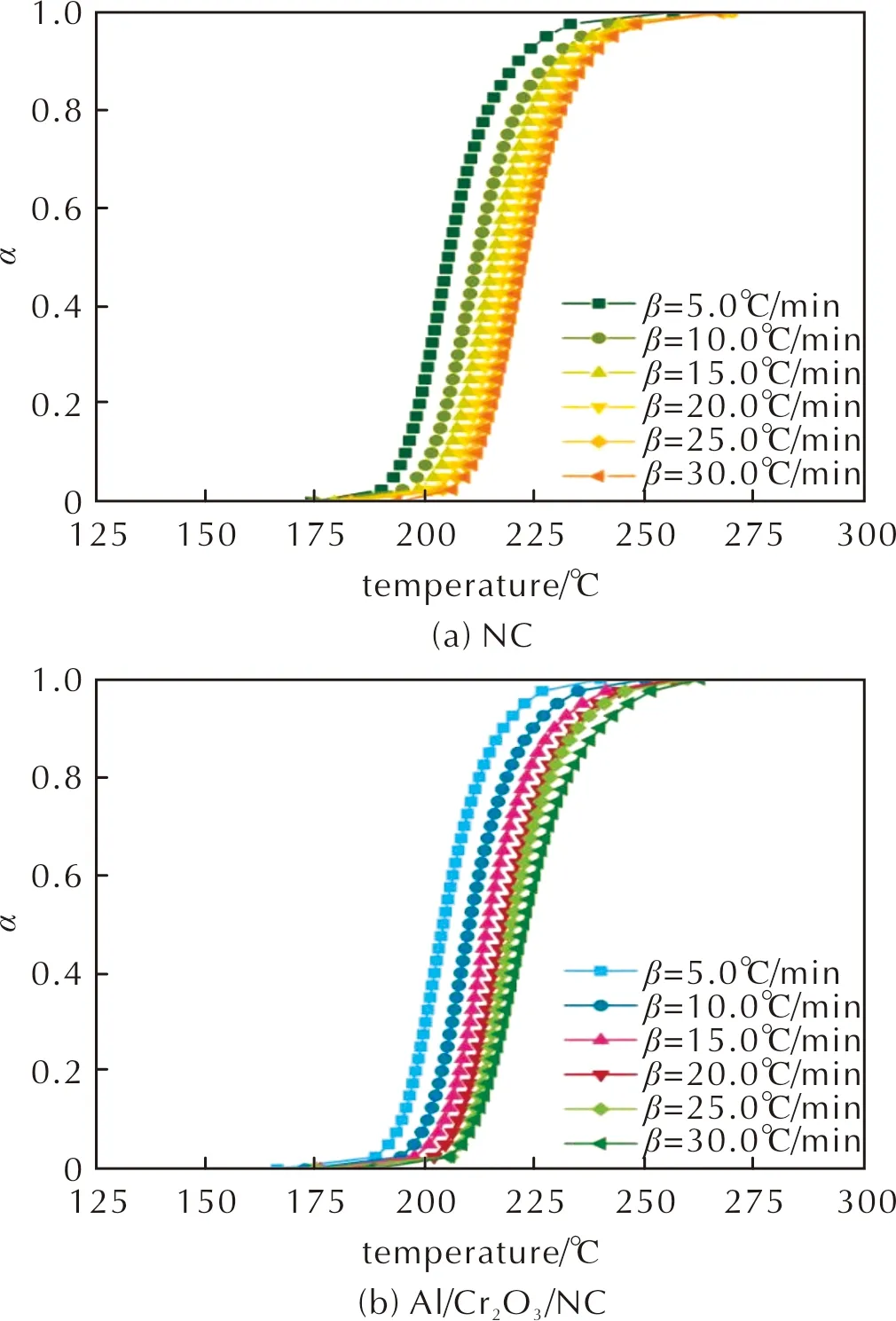
图4 NC和Al/Cr2O3/NC在不同加热速率下的转化率—温度曲线Fig.4 α—T curves of NC and Al/Cr2O3/NC at the different heating rates
(1)
(2)
(3)
式中:β为加热速率,℃/min或K/min;Ea为表观活化能,kJ/mol;const为常数;R为摩尔气体常数,kJ/(mol·K);T为热分解温度,K;α为反应转化率。
经上述3种等转化率方法分析,获得了NC和Al/Cr2O3/NC的Eα值(包含相应置信区间)与反应转化率α的关系曲线,结果如图5所示。在α为0~1.0时,随NC热分解反应进行,其Eα值趋于增加;而Al/Cr2O3/NC热分解反应过程中,其Eα值呈现降低趋势。对于同一样品,通过FWO和KAS法获得的Eα值较为接近。与纯NC相比,添加Al/Cr2O3可明显降低Al/Cr2O3/NC复合物的Eα值。由FWO法、KAS法和Friedman法计算得到纯NC的Eα值依次为(201.4±4.6)、(203.8±4.8)和(212.1±6.6)kJ/mol;Al/Cr2O3/NC复合物的Eα值依次为(180.3±6.4)、(180.8±6.7)和(178.4±10.6)kJ/mol。纯NC的lg(A/s-1)值依次为(19.5±0.9)、(18.6±0.9)和(20.6±1.7);Al/Cr2O3/NC复合物的lg(A/s-1)值依次为(18.4±0.8)、(18.7±0.8)和(18.4±1.5)kJ/mol。上述计算所得NC和Al/Cr2O3/NC复合物的Eα平均值均对应于含能材料热分解动力学参数的合理范围(Eα取值为80~250kJ/mol,lg(A/s-1)取值为7~30)[25]。基于以上数据,Al/Cr2O3/NC复合物的Eα平均值比NC的Eα平均值最多降低33.7kJ/mol。

图5 用FWO法、KAS法和Friedman法计算的NC及Al/Cr2O3/NC的Eα—α曲线Fig.5 Eα—α curves of NC and Al/Cr2O3/NC calculated by FWO, KAS and Friedman methods
为验证Eα值准确性,基于单组分NC和Al/Cr2O3/NC的热分解峰温及加热速率实验数据,采用Kissinger法[式(4)][26]、Starink法[式(5)][27]、Kissinger-迭代法[式(6)~(8)][28]和Ozawa-迭代法[式(7)~(10)][29-30]计算得到NC和Al/Cr2O3/NC的Eα值。
(4)
(5)
(6)
(7)
(8)
(9)
(10)
式中:H(u)或Q4(u)为u(u=Eα/RT)的变量;G(α)为积分机理函数。
Kissinger法、Starink法、Kissinger-迭代法和Ozawa-迭代法计算所得Al/Cr2O3/NC的Eα值依次为182.2、181.7、182.1和182.1kJ/mol,均低于NC的Eα值(200.0、199.4、199.8和199.8kJ/mol)。且上述4种方法计算值相差不大,NC的Eα平均值为199.8kJ/mol,接近于文献报道数值[31-32]。Al/Cr2O3/NC的Eα平均值为182.0kJ/mol,与NC相比,Al/Cr2O3/NC的Eα平均值降低了17.8kJ/mol。由于热分析技术、NC的氮含量、动力学方法和实验条件等差异,目前文献报道的NC的Eα值有所不同,尤其是催化剂对NC热分解过程影响各异。例如,通过Kissinger法和FWO法获得Cr2O3/NC的Eα值分别为190.9和189.2kJ/mol[18],均高于上述Al/Cr2O3/NC的Eα值,说明Al/Cr2O3催化NC热分解性能优于纳米Cr2O3颗粒。
为得到NC和Al/Cr2O3/NC热分解反应的动力学机理函数,将常见固相反应遵循的理论反应模型[33]与NC、Al/Cr2O3/NC热分解实验数据建立的模型曲线进行对比研究,见图6,在转化率大于0.5范围内,由热分解实验数据所得NC和Al/Cr2O3/NC的反应模型曲线接近三维扩散(D3)模型理论曲线。但在转化率小于0.5范围内,由热分解实验数据所得NC和Al/Cr2O3/NC的反应模型曲线与D3模型理论曲线差别巨大,其曲线趋势类似随机链断裂(L2)模型曲线,但仍与之相关性极差。为获得相关性较理想的物理模型,引入修正后的esták-Berggren经验方程[34],经反应动力学模型重建,NC和Al/Cr2O3/NC热分解反应模型均可描述为n级反应动力学模型,其表达式(见图6)分别为f(α)=8.79α0.76(1-α)2.36和f(α)=7.25α0.73(1-α)2.12。

图6 NC和Al/Cr2O3/NC反应模型曲线与理想反应模型建立的理论主曲线之间的比较Fig.6 Comparison between normalized plots of the reaction models for NC and Al/Cr2O3/NC and theoretical master plots established from the ideal reaction models
2.4 热安全性评价
自加速分解温度(Te0或TSADE)、热分解峰温Tp0、热点火温度(Tbe0或TTIT)及热爆炸临界温度(Tbp0或Tb)是评价含能材料热安全性能的重要参数[式(11)和式(12)]。EK、AK分别为Kissinger方程对应的表观活化能、表观指前因子。当T=Tp0,Ea=EK,A=AK时,活化熵(ΔS≠)、活化焓(ΔH≠)和活化自由能(ΔG≠)可由式(13)、式(14)和式(15)计算得到[35]。NC和Al/Cr2O3/NC的热安全参数见表1。

表1 NC和Al/Cr2O3/NC的热安全参数Table 1 Termal safety parameters of NC and Al/Cr2O3/NC
(11)
(12)
(13)
ΔH≠=Ea-RT
(14)
ΔG≠=ΔH≠-TΔS≠
(15)
式中:a、b和c均为常数;i=1~6;EO为FWO方程对应的表观活化能;EK、AK分别为Kissinger方程对应的表观活化能和指前因子;kB为Boltzmann常数,1.381×10-23J/K;h为Plank常数,6.626×10-34J·s。
由表1可知,计算所得Al/Cr2O3/NC的自加速分解温度、热分解峰温、热点火温度、热爆炸临界温度及活化熵均低于NC相应值,且Al/Cr2O3/NC的活化自由能(ΔG≠)高于NC的ΔG≠值,表明加入Al/Cr2O3后使Al/Cr2O3/NC热抵抗力降低,越易发生热分解反应。
2.5 TG/DTG-FTIR分析
采用TG/DTG-FTIR热红联用技术对比研究NC和Al/Cr2O3/NC的热分解过程。升温速率10℃/min时NC和Al/Cr2O3/NC的TG-DTG曲线如图7所示。

图7 NC和Al/Cr2O3/NC在加热速率10.0℃/min下的TG-DTG曲线Fig.7 TG-DTG curves of NC and Al/Cr2O3/NC at the heating rate of 10.0℃/min
由图7可知,NC、Al/Cr2O3/NC热分解过程仅呈现一个阶段质量损失,其总质量损失分别为67.8%和36.1%。对比TG-DTG实验数据,Al/Cr2O3/NC复合物的质量损失大于其他NC基复合物的质量损失。例如,Cr2O3/NC(33.31%)[18]、颗粒状Fe2O3/NC(34.77%)[26]、Al/Fe2O3/NC(31.12%)[36]、蟹爪兰状CuO/NC(35.73%)、满天星状CuO/NC(35.94%)[24]。这表明Al/Cr2O3纳米铝热剂比Cr2O3、颗粒状Fe2O3、Al/Fe2O3、蟹爪兰状CuO、满天星状CuO催化剂更有利于加深NC热分解程度。NC、Al/Cr2O3/NC热分解反应峰温度依次为209.5℃、209.4℃,Al/Cr2O3/NC热分解峰温较纯NC热分解峰温略有降低。Al/Cr2O3/NC的外推起始热失重温度较纯NC的外推起始热失重温度低4.0℃。
文献[37-38]报道,O—NO2键的断裂是NC热解的初始步骤,逸出的NO2气体可能与分子片段或凝聚相等进行反应,并产生其他气体产物,包括H2O、CO2、CO、NO、N2O、NO2、HCHO、HCN、HCOOH等。NC和Al/Cr2O3/NC的热分解过程中取热分解开始前某温度(Tx)、起始分解温度(Ti)、外推起始分解温度(Te)、峰温(Tp)、外推终止分解温度(Tc)和终止分解温度(Tf)对应的红外光谱如图8所示。由图8可知,纯NC和Al/Cr2O3/NC在开始发生热分解前(Tx分别为164.9℃和160.0℃)均可检测到环境中存在的H2O(3600~3740cm-1)和CO2(2360,670cm-1)。纯NC在Ti=178.8℃时,除H2O和CO2杂质峰外,在1593~1635cm-1处测得NO2的强特征吸收峰,由此确定NO2为NC分解的初始分解产物[39-40]。而Al/Cr2O3/NC热分解反应在160.0℃时即可检测到NO2气体的弱吸收峰,在175.7℃时NO2吸收峰加强,且检测到HCHO(1746cm-1)的微弱吸收峰,说明Al/Cr2O3可有效催化NC分解。随着热分解反应加剧,在Te=200.2℃时,NC分解产生H2O、CO2、NO2、CO(2194cm-1)和NO(1762~1965cm-1)[41]。与纯NC相比,Al/Cr2O3/NC分解速率加快,在196.2℃时测得H2O、CO2、NO2、CO、NO、HCHO(2814, 1746cm-1)和HCOOH(1080~1128cm-1)[42]的特征吸收峰。NC分解到达峰温209.5℃时,产生大量气体产物,包括H2O、CO2、NO2、CO、NO、N2O(2241cm-1)、HCHO和HCOOH,在221.8℃时同样检测到上述气体。其中,NO2、NO气体吸收峰减弱,HCHO和HCOOH吸收峰加强。Al/Cr2O3/NC在峰温209.4℃时分解产生的气体为H2O、CO2、CO、NO、NO2、N2O、HCHO和HCOOH。Al/Cr2O3颗粒尺寸小,表面吸附能力强,可将NC热分解产生的气体产物禁锢在NC骨架中,有利于NO2和HCHO反应,也可促进二次自催化反应。Cr2O3、Fe2O3、CuO、NiO[43]、Al/Fe2O3催化NC热分解时也存在如下反应过程[44]:

图8 NC和Al/Cr2O3/NC热解产物的FTIR谱图Fig.8 FTIR spectra of pyrolysis products of NC and Al/Cr2O3/NC

5H2O+HCOOH
(16)

(17)
随着Al/Cr2O3/NC热分解反应程度加深,在226.9℃时,上述气体产物吸收强度降低。NC热分解过程在247.5℃时结束,此时可检测到解析或环境中H2O和CO2的吸收峰,还检测到残留的HCHO和HCOOH的微弱吸收峰。Al/Cr2O3/NC热分解结束后,在247.5℃时检测到可能由Al/Cr2O3解析释放的H2O、CO2、NO2、HCHO和HCOOH气体。
3 结 论
(1)采用等转化率法、迭代法等研究了Al/Cr2O3对NC热分解过程的影响。与纯NC相比,Al/Cr2O3/NC复合物热分解Eα值降低33.6kJ/mol,热分解反应遵循的动力学机理函数为f(α)=7.25α0.73(1-α)2.12。
(2)Al/Cr2O3/NC的自加速分解温度、峰温、热点火温度、热爆炸临界温度及活化熵均低于NC相应值;活化自由能高于NC相应值,表明Al/Cr2O3纳米铝热剂可促进NC发生热分解反应,Al/Cr2O3/NC复合物的热抵抗力降低。
(3)基于TG/DTG-FTIR分析,Al/Cr2O3催化作用下,NC热分解过程首先断裂O—NO2键,生成NO2气体,随后进行自催化反应,生成H2O、CO2、CO、NO2、NO、N2O、HCHO和HCOOH气体产物。
