高效液相色谱检测发酵液中乙酰辅酶A
2023-12-10唐艳,高鹏,吴涛,2
唐 艳,高 鹏,吴 涛,2
(1.通辽梅花生物科技有限公司,内蒙古 通辽 028024;2.廊坊梅花生物技术开发有限公司,河北 廊坊 065001)
乙酰辅酶A(Acetyl coenzyme A,acetyl-CoA)作为人体内重要的化学物质,是生物体能源物质代谢过程中产生的一种重要的中间代谢产物[1-2]。乙酰辅酶A是脂肪酸的β-氧化及糖酵解产生的丙酮酸氧化脱羧的产物[3-4],在许多代谢过程中起着关键作用。糖、脂肪和蛋白质3种主要营养物质通过乙酰辅酶A汇聚成一条共同的代谢途径[5],在线粒体内进行三羧酸循环和氧化磷酸化,氧化生成CO2和H2O,释放ATP[6-7],乙酰辅酶A是重要的中心碳代谢分子,主要在细胞核组蛋白乙酰化、细胞质丙酮酸脱氢酶支路、线粒体三羧酸循环和过氧化物酶体乙醛酸循环中参与代谢过程[8-10]。乙酰辅酶A可作为酿酒酵母[11-13],也具有延缓衰老和抗癌的功效[14-16]。
目前,国内外关于发酵液中乙酰辅酶A残留检测的报道非常少。早期的检测方法也相当复杂,通常都是采用辅酶A和酰基辅酶A的化学或酶法衍生法测定[17],有报道用气质联用检测乙酰辅酶A的残留[18],然而该方法略显繁琐,要求乙酰辅酶A水解、衍生,影响了测定的准确性。目前,国内有利用高效液相色谱-串联质谱法(HPLC-MS/MS)对植物组织中的乙酰辅酶A定量的报道[19],然而利用HPLC测定发酵液中乙酰辅酶A在国内少有报道[20]。本研究的目的是建立一种快速、准确定量检测氨基酸中乙酰辅酶A的高效液相色谱法,为发酵液代谢副产物研究提供技术支持。在发酵代谢过程中,乙酰辅酶A起着重要作用,然而对其成分是否残留于发酵液中并无明确的判断,因此笔者建立了液相色谱方法,以定量检测发酵液中是否存在乙酰辅酶A。
1 材料与方法
1.1 材料与仪器
实验仪器:高效液相色谱仪1200,美国Agilent Technologies公司;电子天平(精度±0.000 01 g)、pH计,梅特勒托利多公司;Mili-Q超纯水机,默克密理博公司;离心机,默克Sigma-Aldrich公司;真空泵,上海津腾公司。
材料试剂:乙酰辅酶A的标准品,默克Sigma-Aldrich公司;乙腈,色谱纯,德国Meker公司;磷酸钠,分析纯,国药集团化学试剂有限公司;磷酸,分析纯,国药集团化学试剂有限公司。
1.2 实验方法
1.2.1 对照品溶液的制备
准确配制浓度为10 μmol/L的乙酰辅酶A标准溶液作为储备液,分别吸取0.1,0.2,0.4,0.6,0.8,1.0 mL的储备液,补加入0.9,0.8,0.6,0.4,0.2,0.0 mL的超纯水,充分混匀,配制成浓度为1.0,2.0,4.0,6.0,8.0,10.0 μmol/L的标准溶液用作对照品溶液。
1.2.2 供试品溶液的制备
将不同品种氨基酸发酵液离心,得到上清液。分别取脯氨酸、谷氨酰胺、异亮氨酸、亮氨酸、谷氨酸、色氨酸和缬氨酸发酵液,以12 000 r/min离心3 min,得到上清液,精密量取1 mL上清液于10 mL容量瓶中,定容,摇匀,得到供试品溶液,用0.22 μm滤膜过滤,备用。
1.2.3 色谱条件
色谱柱采用安捷伦Polaris 5 C18-A(250 mm×4.6 mm,5 μm);流动相A为40 mmol/L的磷酸钠水溶液,用磷酸调pH=5,流动相B为V(40 mmol/L的磷酸钠溶液)∶V(乙腈)=800∶200的混合溶液,流速为1 mL/min,紫外波长为254 nm,进样量为10 μL,温度25 ℃,梯度洗脱。按照该条件操作,对照品及供试品的分离效果较好,峰型良好。
2 结果与讨论
2.1 方法学讨论
2.1.1 流动相浓度的选择
分别选择浓度为20,40,100,200,400 mmol/L的磷酸钠缓冲盐作为流动相A开展实验。当流动相浓度为40,100,200,400 mmol/L时,峰型较好,浓度大时会降低色谱柱寿命,浪费成本;当流动相浓度为20 mmol/L时,峰型略差:流动相浓度为40 mmol/L时,既不影响检测结果,又能节省成本,故选择40 mmol/L的流动相进行色谱分离,色谱峰图如图1所示。
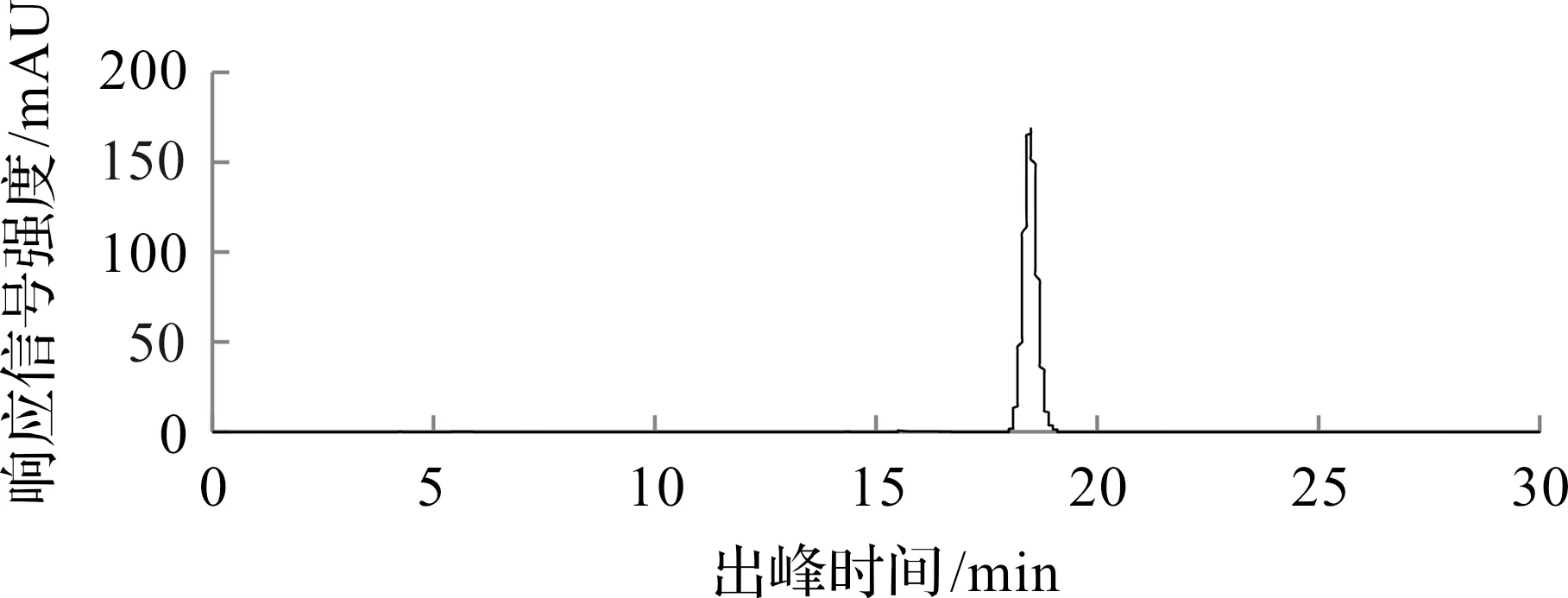
图1 对照品峰图Fig.1 Peak diagram of reference substance
2.1.2 流动相混合比例的选择
流动相B为磷酸钠缓冲盐与乙腈的混合液,分别选取V(磷酸钠溶液)∶V(乙腈)为900∶100,800∶200,700∶300,600∶400,500∶500的混合溶液进行色谱分离。由于流动相极性不同,出峰时间与峰型均不同,只有体积比为800∶200时,分离度较好,峰型也较好,因此选用V(磷酸钠溶液)∶V(乙腈)=800∶200作为流动相B。以色氨酸发酵液为例,色谱峰图如图2所示。

1—未知杂峰;2—色氨酸;3—乙酰辅酶A。
2.1.3 梯度洗脱的确定
笔者采用梯度洗脱的方法,在实验过程中考察了流动相A与流动相B的比例对乙酰辅酶A的分离度、灵敏度和色谱峰型的影响。经多次实验验证,得出结论:经流动相A与流动相B不同比例梯度洗脱30 min,均能将所有物质分离出来,且峰型较好,梯度洗脱程序如表1所示。
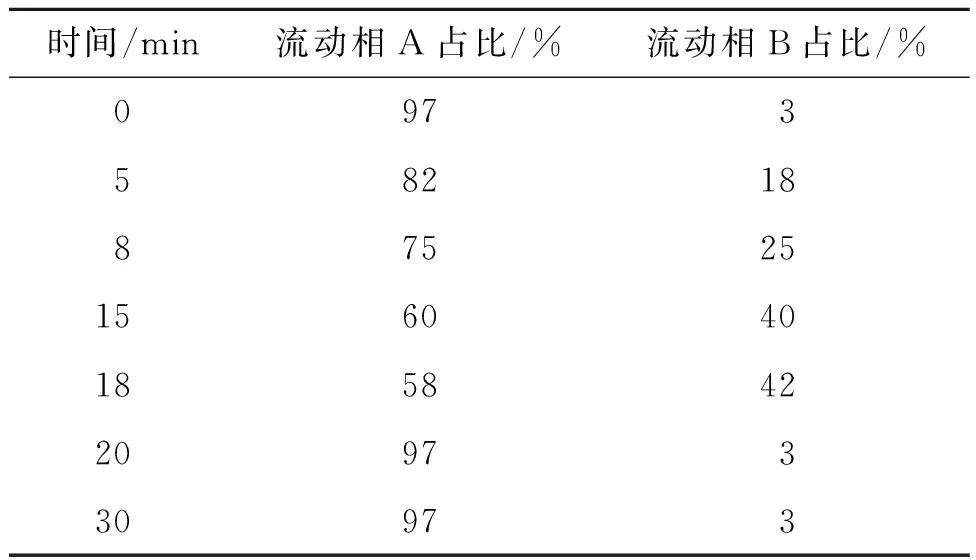
表1 梯度洗脱条件
2.1.4 检出限和定量限
根据流动相中样品组分在检测器上峰高与噪声峰高的比值S/N来确定检出限和定量限。先在空白样品中加入较低浓度的标准样品,然后将样品稀释成不同的浓度进行测定,以S/N为3,10时对应的标准溶液浓度来分别确定检出限和定量限。通过对一系列浓度试样的测试,最终获得符合要求的浓度,检出限和定量限分别为0.50,0.53 mg/L。
2.1.5 精密度、重复性和回收率
取色氨酸发酵液,用笔者方法对其进行6次重复测定,检测结果见表2。由表2可知:变异系数较小(<1%),表明笔者方法不仅精密度高,而且具有良好的重现性。
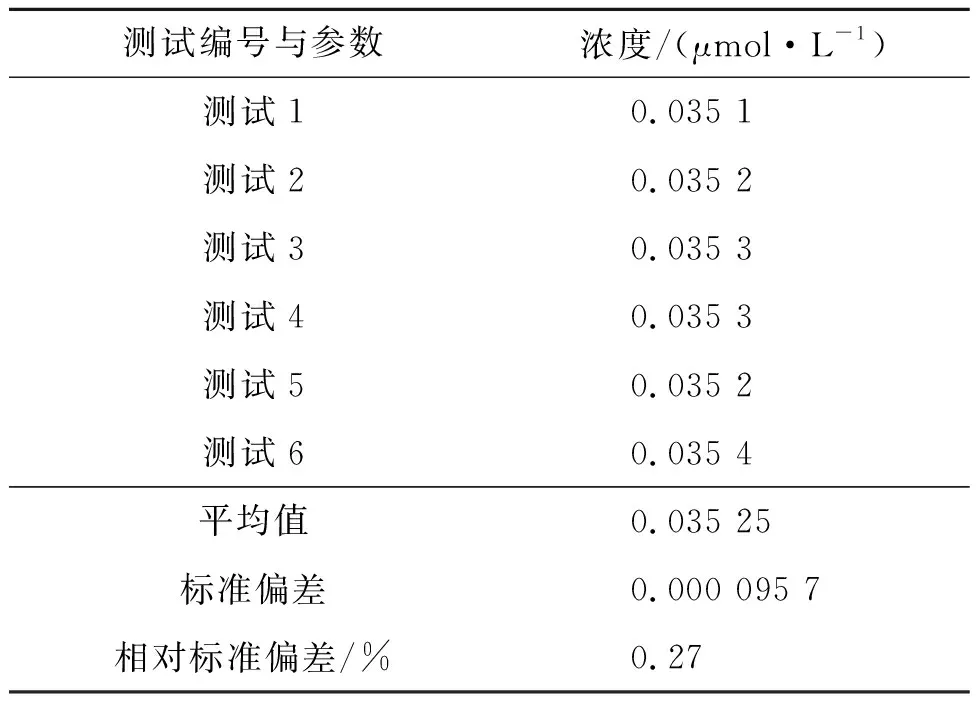
表2 重复性实验结果
对已知浓度的乙酰辅酶A,同一样品平行取样5次,分别以50%,100%,200%,300%,400%进行5个水平的加标回收实验,结果如表3所示,此方法测定乙酰辅酶A浓度的加标回收率为98.5%~102%。

表3 样品加标实验结果
2.1.6 线性关系考察
配制10 μmol/L乙酰辅酶A的标准溶液,再分别吸取0.1,0.2,0.4,0.6,0.8,1.0 mL溶液,加入0.9,0.8,0.6,0.4,0.2,0.0 mL的蒸馏水,配制成浓度分别为1,2,4,6,8,10 μmol/L的标准溶液。按照上述方法进行测定,以乙酰辅酶A浓度x为横坐标,峰面积y为纵坐标,绘制线性回归方程,结果表明其线性回归较好,其中R2=1.000 0,y=11.416 5x-26.284 2,标准曲线如图3所示。

图3 标准曲线图Fig.3 Standard curve
2.2 发酵液中乙酰辅酶A的测定
取不同品种的氨基酸发酵液Pro,Gln,Ile,Leu和Trp,以12 000 r/min离心3 min,得到上清液,量取1 mL上清液于10 mL容量瓶中,定容,摇匀,采用该方法测定发酵液中乙酰辅酶A浓度,结果如表4所示。乙酰辅酶A是代谢中间产物,一般情况下不会分泌到胞外,并且该产物不稳定,一般以钠盐的形式存在,发酵液中的乙酰辅酶A的浓度很低,为0.000 7~0.001 2 μmol/mL。
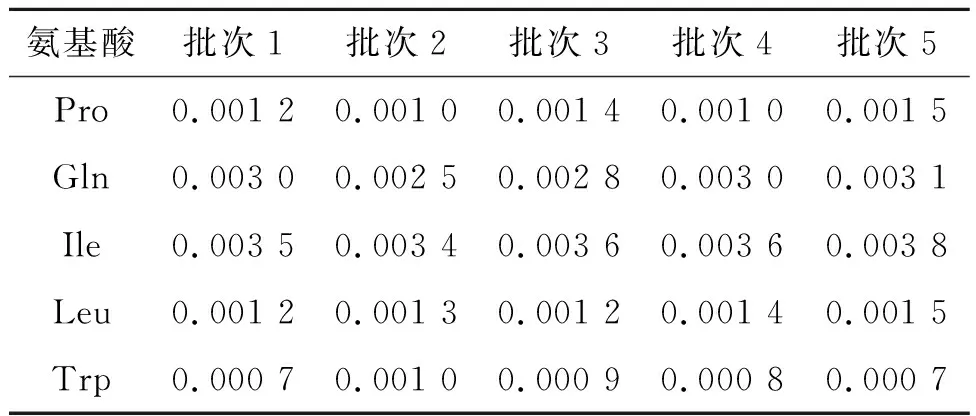
表4 发酵液中乙酰辅酶A检测结果
2.3 不同方法的对比
将笔者方法与常规检测方法乙酰辅酶A检测试剂盒分析方法进行对比,笔者方法的精密度比试剂盒法高,两种方法检测不同氨基酸发酵液结果偏差约为0.000 2 μmol/mL,具体结果如表5所示。
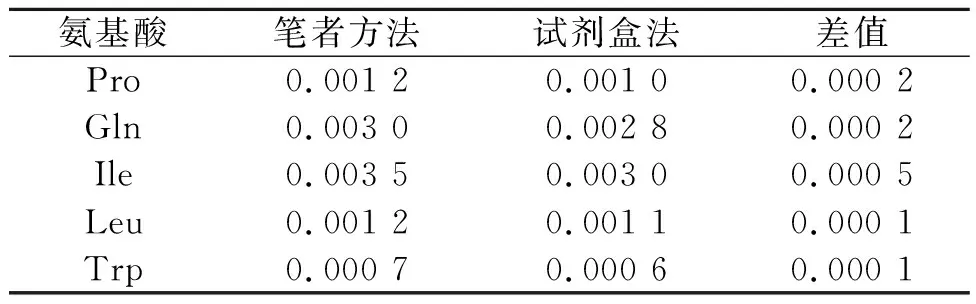
表5 不同方法检测乙酰辅酶A浓度结果对比
2.4 细胞内与细胞外乙酰辅酶A浓度的对比
取不同氨基酸发酵液进行细胞破碎,使胞内的乙酰辅酶A释放,以12 000 r/min离心3 min,去除杂质,得到清液。取不同氨基酸发酵液,直接以12 000 r/min离心3 min,得到上清液。将两种清液分别采用笔者方法检测乙酰辅酶A的浓度,结果如表6所示。由表6可知:乙酰辅酶A在细胞内存在,在胞外存在量较少。笔者方法能有效地检测出细胞内外乙酰辅酶A浓度。
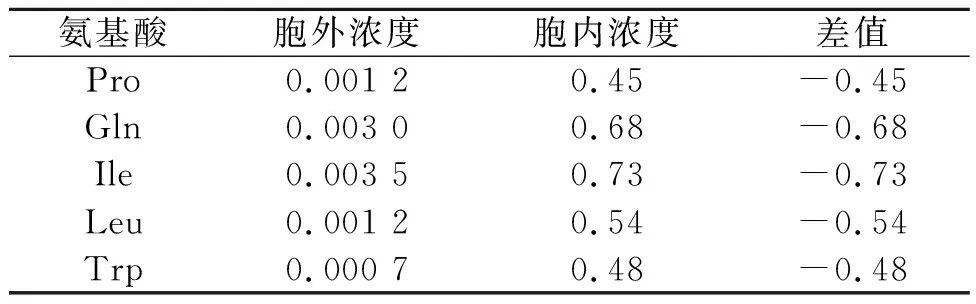
表6 不同发酵液细胞内外乙酰辅酶A检测结果对比
3 结 论
笔者建立的乙酰辅酶A的检测方法能有效地检测发酵液中乙酰辅酶A的浓度。液相色谱法以Polaris 5 C18-A为色谱柱,流动相A为40 mmol/L的磷酸钠水溶液,流动相B为V(40 mmol/L磷酸钠溶液)∶V(乙腈)=800∶200,梯度洗脱,流速为1.0 mL/min,检测波长为254 nm。实验结果表明:笔者方法的出峰时间为18 min,线性回归系数R2=1,加标回收率为99.5%,与常规检测方法乙酰辅酶A检测试剂盒分析方法相比,该方法偏差较小,约为0.000 2 μmol/mL。
