尖叶木樨榄天然林地不同土层土壤微生物群落差异研究
2023-12-09郭翠莲赵正雄
郭翠莲,付 洁,胡 青,赵正雄,赵 敏,陆 斌
(1.云南农业大学 资源与环境学院,云南 昆明 650201;2.云南省林业和草原科学院,云南 昆明 650201)
土壤是植物生产的根本,是农业的基本生产资料[1]。土壤微生物是土壤中最活跃的部分,在土壤物质转化、能量流动等过程中发挥重要作用[2-5]。土壤微生物在植物生长过程中起着形成土壤结构、分解有机质、分解矿物质、固氮、调节植物生长和防止土传病害等作用[6]。研究土壤微生物群落组成和多样性对促进土壤微生态环境的改善和土壤的可持续利用等方面具有重要意义[7]。尖叶木樨榄(Oleacuspidata)又称印度木樨榄,与油橄榄同属,是木犀科木犀榄属常绿灌木或小乔木,其枝密叶浓、树形美观且生长快、萌芽力强、耐修剪、适应性强,尖叶木樨榄也可用作嫁接油橄榄的砧木[8]。因此研究尖叶木樨榄土壤微生物群落组成和多样性对促进油橄榄产业发展具有重要意义。对于土壤微生物群落和多样性的研究,传统方法是微生物平板培养方法[9],这种方法受微生物在固体培养基的选择和实验室条件的局限,大部分土壤微生物无法培养和统计出来。脂肪酸甲酯谱图分析法(fatty acid methyl ester,FAME)、磷脂脂肪酸分析法(phospholipid fatty acid,PLFA)、聚合酶链式反应技术(polymerase Chain reaction,PCR)和Sanger等方法鉴别到的微生物种类有限,技术分析成本高、费时[10]。第二代高通量测序技术是基于PCR和基因芯片发展而来的DNA测序技术。二代测序具有获得更多不可培养微生物,具有高通量和读长短等优势,已成为土壤微生物群落研究的重要技术手段[11-12]。Zhang等[13]研究发现所有植物在其生存的土壤中均有特定生境的土壤微生物组。前人研究表明,枸杞[14]、冰糖橙[15]等植物的土壤微生物群落和多样性存在很大差异性。孔维宝等[16]运用高通量测序分析了不同树龄不同土质油橄榄土壤微生物群落和多样性,结果表明不同树龄和不同土壤质地知油橄榄土壤群落和结构差异显著。俞伟等[17]研究表明土层厚度显著影响土壤微生物群落功能和植物的生长率。目前,关于油橄榄的研究有很多,针对油橄榄砧木尖叶木樨榄天然林地土壤微生物群落及多样性的研究尚无报道。对尖叶木樨榄天然林地不同土层细菌16SrRNA基因的V3-V4区域和真菌ITS1区域进行PCR扩增及高通量测序,分析土壤中细菌和真菌的多样性,掌握油橄榄砧木尖叶木樨榄天然林地土壤细菌和真菌的群落结构、物种组成和差异特征,为尖叶木樨榄的栽培提供参考。
1 研究区域与研究方法
1.1 研究区概况
试验地位于云南省林业和草原科学院昆明树木园内油橄榄示范园,地理位置为102°44′E,25°9′N,海拔为1 950~2 045 m。示范园里尖叶木樨榄纯林,树龄25 a,林下植被为草本植物。表层土壤覆有5~6 cm厚凋落物,由尖叶木樨榄的枯枝落叶及草本植物干枯的茎叶组成,所占比例为8∶2。凋落物的结构分层明显,具有均超过1 cm的未分解层、半分解层和已分解层,3个层次的厚度逐渐减少。
1.2 样地设置与样品采集
2021年4月,在云南省林业和草原科学院昆明树木园尖叶木樨榄林地中依据“S”形取样法选取同一块坡向、大小一致的示范林样地。每个样方分别采集0~10、10~20、20~40、40~60 cm(A、B、C、D)4个土层的土壤样品,样品去除植物残体和石块等杂质后,按土层混合均匀自封袋带回实验室。土壤样品保存于-20 ℃冰箱用于测定土壤微生物。
1.3 测定方法
将采集的土样存放于干冰中,送至上海的派森诺生物科技有限公司,对土壤微生物进行Illumina Novaseq高通量测序。
1.3.1 微生物的DNA提取、PCR扩增及测序 提取的土壤微生物总DNA利用0.8%琼脂糖凝胶电泳进行分子大小判断,利用紫外分光光度计对DNA进行定量。PCR扩增选用真菌ITS1区特异性引物,序列为ITS1F:(5′-CTTGGTCATTTAGAGGAAGTAA-3′);ITS2R:(5′-GCTGCGTTCTTCATCGATGC-3′);细菌16S rDNA V3-V4区特异性引物,序列为338F(5′-ACTCCTACGGGAGGCAGCA-3′), 806R (5′-GGACTACHVGGGTWTCTAAT-3′)。PCR采用NEB Q5 DNA高保真聚合酶,将PCR反应所需的成分配置完后,在PCR仪上于98 ℃预变性30 s,使模板DNA充分变性,然后进入扩增循环。在每一个循环中,先于98 ℃保持15 s使模板变性,然后将温度降到50 ℃,保持30 s,使引物与模板充分退火;在72 ℃保持 30 s,使引物在模板上延伸,合成DNA,完成一个循环。重复这样的循环25~27次,使扩增的DNA片段大量累积。最后,在72 ℃保持5 min,使产物延伸完整,4 ℃保存。扩增结果进行2%琼脂糖凝胶电泳,切取目的片段然后用Axygen凝胶回收试剂盒回收目的片段。PCR扩增产物回收后利用Quant-iT PicoGreen dsDNA Assay Kit对PCR产物在Microplate reader (BioTek,FLx800)上进行定量,利用Illumina公司的TruSeq Nano DNA LT Library Prep Kit进行建库,对合格的文库,在MiSeq机器上利用MiSeq Reagent Kit V3(600cycles)进行2×250 bp的双端测序。
1.3.2 测序数据处理 测序原始数据以FASTQ格式保存,利用Vsearch (v2.13.4_linux_x86_64)和cutadapt (v2.3)软件进行去引物、拼接、质量过滤、去重、去嵌合体、聚类等流程,从而获得高质量序列;使用cluster_size模块,在97%相似度水平对高质量序列聚类,并分别输出代表序列和OTU表。最后,去除OTU表格中的singletons OTUs及其代表序列。对于每个ASVs的特征序列或每个OTU的代表序列,在QIIME2软件中使用默认参数,使用预先训练好的Naive Bayes分类器进行物种注释分析。
1.4 数据处理
利用Excel2010软件进行数据整理和计算;利用SPSS18软件进行差异显著性检验;利用QIIME2(2019.4)软件计算α多样性指数;利用QIIME2(2019.4)软件进行物种组成的堆叠柱状图绘制;利用R脚本、VennDiagram包制作韦恩图;利用R语言绘制聚类热图。
2 结果与分析
2.1 不同土层土壤微生物群落组成差异分析
不同土层中土壤微生物群落组成差异如图1所示。4个土层土壤真菌和细菌的OTU总数均以A土层土壤最多,B土层次之,D土层最少。不同土层土壤共有的真菌OTU为131个,共有的细菌OTU为251个。真菌和细菌特有OTU的数量均表现为A>B>C>D。由此可见,样地内土壤细菌OTU总数比真菌的多,共有的细菌OTU数约为真菌的1.9倍,且A、B、C、D土层土壤细菌特有OTU数分别是真菌特有OTU数的7.9、9.9、13.7倍和15.1倍。
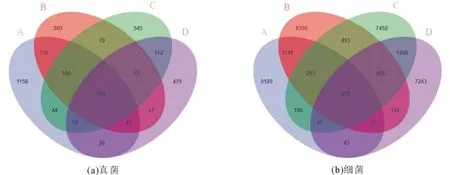
A.0~10 cm;B.10~20 cm;C.20~40 cm;D.40~60 cm。下同。
2.2 不同土层土壤微生物多样性分析
表1和表2分别为不同土层土壤真菌和细菌α多样性指数的统计分析结果。结果表明,不同土层土壤样本真菌、细菌OTU覆盖度(coverage)较高,分别在99%、94%以上。在土壤真菌群落多样性方面,4个土层土壤之间差异不显著,4个土层土壤真菌丰富度高低顺序表现为A>B>C>D。从土壤细菌群落多样性和丰富度来看,土壤细菌群落多样性呈现为A>B>C>D,各土层土壤之间差异显著。可见,尖叶木樨榄天然林地中,0~10 cm土层土壤真菌和细菌群落物种多样性和丰富度均最高,在40~60 cm土层土壤最低。
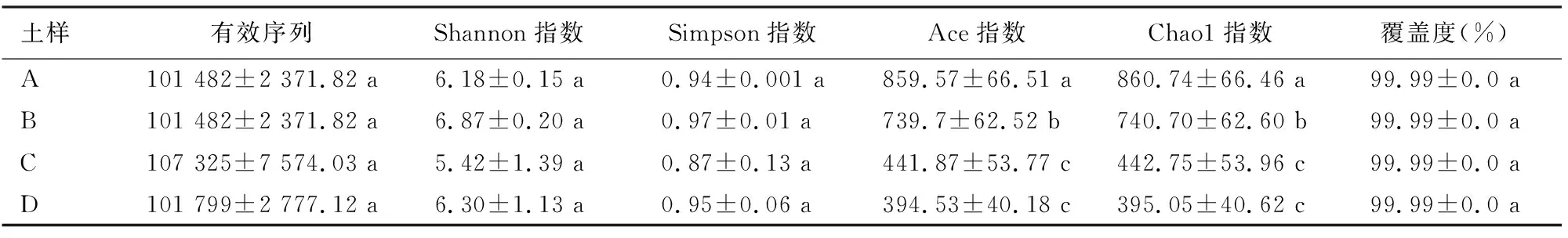
表1 不同土层土壤真菌多样性指数Table 1 Diversity index of soil fungi in different soil layers
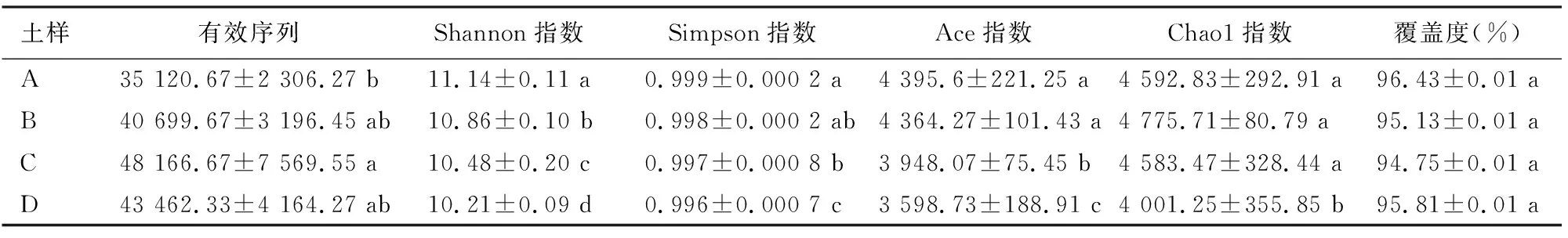
表2 不同土层土壤细菌多样性指数Table 2 Diversity index of soil bacteria in different soil layers
2.3 不同土层土壤微生物分类学组成分析
根据土壤基因组DNA序列分类学分析结果,本研究尖叶木樨榄天然林真菌OTU隶属于21门23纲34目18科69属152种。图2为不同土层土壤真菌群落在门分类水平上的分析结果,结果表明,不同土层土壤真菌组成包括子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、被孢霉门(Mortierellomycota)、油壶菌门(Olpidiomycota)、罗兹菌门(Rozellomycota)等11门(图2);其中,子囊菌门、担子菌门、被孢霉门、其他菌门4门相对丰度较大,其相对丰度之和占土壤真菌总量的99%以上,说明其为优势真菌群。对比尖叶木樨榄不同土层土壤发现,子囊菌门相对丰度为A>D>B>C;担子菌门为B>A>D>C;被孢霉门为D>C>B>A;其他菌门为B>D>A>C。土壤真菌群落相对丰度在不同土层间表现为子囊菌门越高,担子菌门、被孢霉门和其他菌门真菌群落就会越低。
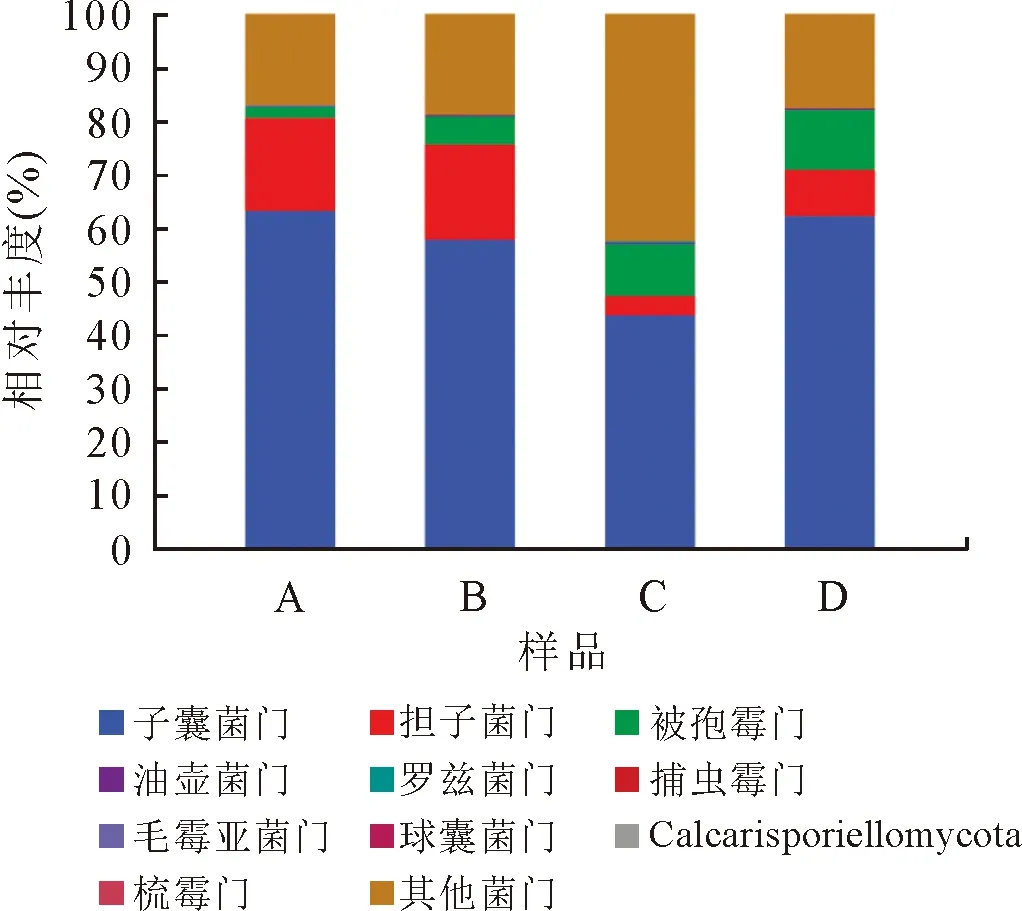
图2 不同土层土壤真菌门水平群落组成Fig.2 Horizontal community composition of soil fungi in different soil layers
本研究尖叶木樨榄天然林细菌OTU隶属于31门126纲198目890科2 624属83种。不同土层土壤细菌组成包括变形菌门(Proteobacteria)、放线菌门(Actinobacteriota)、芽单胞菌门(Gemmatimonadetes)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteriota)等10门(图3),其中变形菌门、放线菌门、芽单胞菌门、绿弯菌门、酸杆菌门5门相对丰度大,占总细菌总量的97%以上,说明其为优势细菌群。不同土层土壤之间优势细菌群落相对丰度大小表现为:变形菌门A>B>C>D;放线菌门A>B>C>D;芽单胞菌门C>D>B>A;绿弯菌门D>C>B>A;酸杆菌门A>B>D>C。

图3 不同土层土壤细菌门水平群落组成Fig.3 Composition of horizontal community of soil bacteria in different soil layers
表3、表4分别为不同土层土壤真菌和细菌在属分类水平上相对丰度排名前11的菌群统计结果。由表3可以看出,A、B2个土层土壤的优势真菌群落均为亚隔孢壳属(Didymella)、溶胶菌属(Solicoccozyma),相对丰度分别为23.51%和10.61%;C土层土壤的优势真菌群落为头束霉属(Cephalotrichum),相对丰度为15.29%;D土层土壤的优势真菌群落为被孢霉属(Mortierella),相对丰度为11.28%。4个土层土壤中仅A、B 2个土层土壤中存在相对丰度超过10%的溶胶菌属(Solicoccozyma)为共有优势真菌群落。由表4可以看出,4个土层土壤细菌群落相对丰度都低于10%。各土层土壤在属水平上的真菌和细菌群落相对丰度各不相同,但未分类的真菌和细菌占比都较高,未分类真菌占比均高于50%,未分类细菌占比均高于60%。
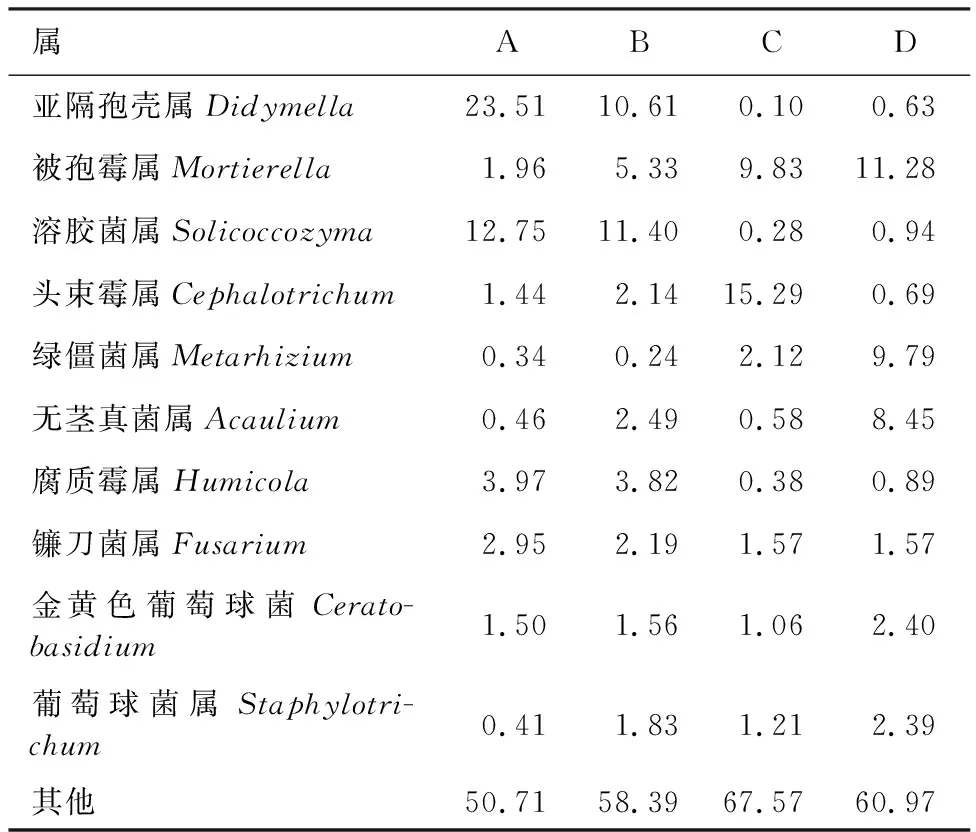
表3 不同土层土壤属水平上真菌群落相对丰度Table 3 Relative abundance of fungal community at soil genus level in different soil layers %
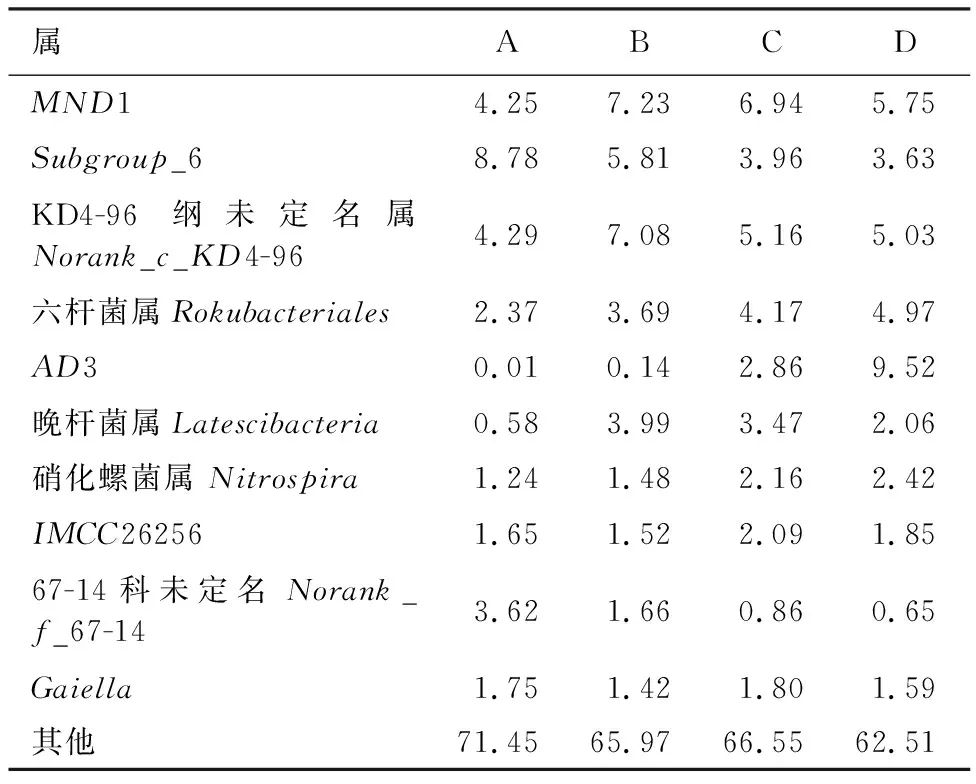
表4 不同土层土壤属水平上细菌群落相对丰度Table 4 Relative abundance of bacterial community at soil genus level in different soil layers %
2.4 不同土层土壤微生物群落结构比较
尖叶木樨榄天然林地不同土层土壤样品真菌群落组成聚类热图(图4a)表明,A、B土层土壤样品聚类在一起,说明A、B土层土壤之间真菌菌群的相似性高,C、D土层土壤样品分别聚为一簇,说明C、D土层土壤真菌菌群组成与A、B土层土壤差异较大。不同土层土壤样品细菌(图4b),C、D土层土壤样品聚类在一起,说明C、D土层土壤之间细菌菌群的相似性高,A、B土层土壤样品分别聚为一簇,说明A、B土层土壤细菌菌群组成与C、D土层土壤差异较大。
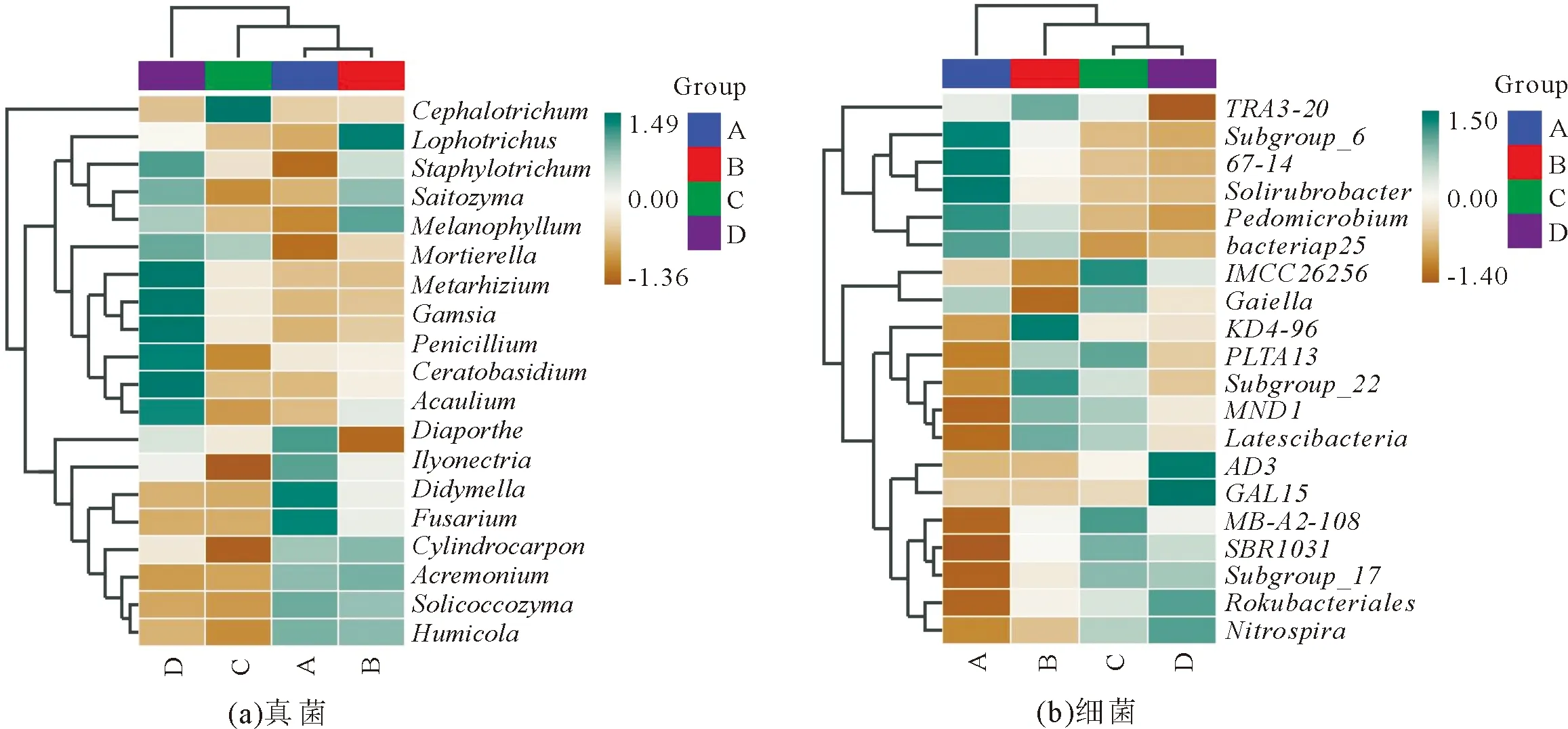
图4 不同土层土壤样品的聚类热图Fig.4 Complex heat map of soil samples in different soil layers
3 结论与讨论
3.1 结论
本研究通过高通量测序技术对尖叶木樨榄天然林地不同土层土壤真菌和细菌多样性及其群落组成差异进行探究,结果表明尖叶木樨榄天然林土层所获得的细菌OTU隶属于31门126纲198目890科2 624属83种;真菌OTU隶属于21门23纲34目18科69属152种。在门类水平上,尖叶木樨榄天然林土壤优势细菌群有变形菌门、放线菌门、芽单胞菌门、绿弯菌门和酸杆菌门5门,表现为无显著差异;土壤优势真菌群落为子囊菌门、担子菌门、被孢霉门和其他菌门4门,表现为不同土层土壤真菌优势菌群子囊菌门相对丰度越高,担子菌门、被孢霉门和其他菌门真菌群落就会越低。尖叶木樨榄天然林不同土层土壤真菌和细菌的OTU总数均以0~10 cm土层土壤最多,40~60 cm土层最少,即土层越深,土壤微生物群落越少。土壤真菌群落多样性在不同深度土层之间的差异不显著,但土壤细菌群落多样性在不同深度土层之间差异显著。在属分类水平上未分类的真菌和细菌占比都较高,分别为50%和60%。0~10、10~20 cm土壤两者真菌菌群相似性较高,与20~40、40~60 cm土壤真菌菌群组成差异较大;20~40、40~60 cm土壤两者细菌菌群相似性高,与0~10、10~20 cm土壤细菌菌群组成差异较大。
3.2 讨论
土壤微生物过程的多样性和土壤特性受土壤微生物群落多样性影响,而土壤特性对土壤健康和植物生产力至关重要[6]。由于土壤微生物群落数量庞大、种类繁杂,土壤微生物群落多样性分析结果对研究技术要求很高,与传统的生理学[9]、磷脂脂肪酸(PLFA)[18]、PCR[19]和梯度凝胶电泳(DGGE)[20]等方法相比,高通量测序技术因高通量、高灵敏度和低运行成本等突出优势[21],已成为测定土壤微生物群落结构和多样性的主要手段。目前高通量测序已在经济林[22]、草地[23]和耕地[24]等领域广泛应用。有关尖叶木樨榄天然林不同土层的土壤微生物群落组成及多样性研究还未见报道。本研究首次采用高通量测序,对尖叶木樨榄天然林0~10、10~20、20~40、40~60 cm 4个土层的土壤真菌和细菌进行了多样性分析,得到真菌和细菌不同门类水平和属类水平的优势菌群及其相对丰度。研究结果表明,本研究尖叶木樨榄天然林不同土层所获得的细菌OTU隶属于31门126纲198目890科2 624属83种;真菌OTU隶属于21门23纲34目18科69属152种。不同土层土壤的真菌和细菌在门类水平上的分类组成分析比较清晰,在属类水平上未分类的真菌和细菌占比都较高,这可能和高通量测序数据、测序方法中比对序列信息量大小和测序时间有关[25]。
本研究从尖叶木樨榄天然林不同土层的土壤微生物中发现,在门分类水平上不同土层土壤细菌OTU总数比真菌的多,与崔纪超等[10]对甘薯根际土壤微生物群落结构及多样性的研究结果相似,也与朱怡等[26]在细菌OTU数量比真菌OTU数量占优势的研究结果一致。在门类水平上,变形菌门、放线菌门、芽单胞菌门、绿弯菌门和酸杆菌门5个细菌门为土壤细菌优势菌群,这与孔维宝等[16]对尖叶木樨榄同属的油橄榄根际土壤细菌的研究结果相符。变形菌门和放线菌门能够参与到土壤有机质转化过程,同时有机质又促进土壤结构形成[27],从而改善土壤物理性质。土壤微生物群落中变形菌门占比较大的土壤就越肥沃[28-29]。芽单胞菌门具有一种强大的光合燃料能力可以氧化有机和无机化合物[30]。绿弯菌门促进土壤碳循环、氮循环和硫循环,同时绿弯菌门也可以分解和吸附土壤有毒物质[31-32]。酸杆菌门可以降解植物残体多聚物、参与单碳化合物代谢、参与铁循环和具有光合能力[33]。在属分类水平上,4个土层土壤细菌群落相对丰度都低于10%。各土层比例最高的前3项属水平细菌群落包括,MND1属于变形菌门,Subgroup_6属于酸杆菌门,KD4-96纲未定名属属于绿弯菌门。在真菌群落中,本研究中尖叶木樨榄天然林土层的土壤优势真菌群落为子囊菌门、担子菌门、被孢霉门和其他菌门,这与孔维宝等[16]的研究结果中油橄榄根际土壤优势真菌群落为子囊菌门、接合菌门、担子菌门和球囊菌门不同,不同研究结果存在真菌种类的分布和组成差异。一方面是因为本研究区域为高海拔区域,气候和土壤的差异,另一方面是因为尖叶木樨榄天然林生态系统有其独特的微生物环境[34-35]。
本研究中不同土层土壤微生物(真菌、细菌)的群落组成存在差异,4个土层土壤真菌和细菌的OTU总数均以0~10 cm土层土壤最多,10~20 cm土层次之,40~60 cm土层最少,即土壤微生物群落随着土壤深度的增加而减少,这与Gomoryova等[36]的研究结果一致。在门分类水平上,不同土层土壤真菌优势菌群相对丰度表现出子囊菌门越高,担子菌门、被孢霉门和其他菌门真菌群落就会越低的变化趋势,这一变化趋势在杨虎[37]的研究中也有提出。这变化是由于不同土层土壤真菌优势菌群中子囊菌门占绝对优势的缘故。在属分类水平上,4个土层0~10、10~20、20~40 cm土壤真菌属类均隶属于子囊菌门,40~60 cm土壤优势菌群被孢霉属隶属于接合菌门,其与植物形成共生关系,能够改善土壤的结构性质和促进植物生长[38]。0~10、10~20 cm土壤两者真菌菌群相似性较高,与20~40、40~60 cm土壤真菌菌群组成差异较大;20~40、40~60 cm土壤两者细菌菌群相似性高,与0~10、10~20 cm土壤细菌菌群组成差异较大。这可能与表层土壤环境变化有关,凋落物与表层土壤密切接触,最先影响表层,促使表层土壤养分状况发生变化。Keiblinger等[39]研究指出真菌对养分的需求比细菌低,而细菌比真菌更能适应养分的变化,面对土壤养分的变化能更快做出反应[40],因此,表层土壤细菌菌群组成差异较大。
