刈割强度对晋北盐渍化草地土壤细菌群落结构的影响
2023-12-09欧俊郝杰王犇任歆玥米佳董宽虎
欧俊,郝杰,王犇,任歆玥,米佳,4*,董宽虎,5
(1.山西大学 黄土高原研究所,黄土高原生态恢复山西省重点实验室,山西 太原 030006;2.江西省信丰中学,江西 信丰 341699;3.山西农业大学 草业学院,山西 太谷 030801;4.山西亚高山草地生态系统教育部野外科学观测研究站,山西 宁武 036700;5.山西右玉黄土高原草地生态系统定位观测研究站,山西 右玉 037200)
0 引言
我国盐碱化草地面积为99.1 万km2,约占我国国土总面积的10.3%[1]。山西省盐碱化土地面积约为27.4 万km2,其中晋北地区的盐碱化土地面积占山西省盐碱地总面积的71.6%[2]。晋北草地是我国北方生态屏障的重要组成,草地的盐碱化不仅影响草地的生产力,而且关系华北地区的生态安全问题[3]。晋北盐渍化草地属于北方农牧交错带,是典型的生态脆弱区,其地下水位较高且蒸发量较大,以苏打型盐碱地类型为主,土壤盐分会影响土壤微生物群落结构及其活性[4-5]。
刈割是常见的草地利用方式之一,适度刈割可以增加植物物种多样性、提高新鲜的土壤有机质输入[6]。土壤微生物是地下生态系统的重要组成部分,对于生态系统物质循环的调控具有重要意义[7]。土壤细菌作为微生物群落的主要成员之一,种类繁多,具有强大的酶系统和分解复杂有机物质的能力,能引起土壤中植物残体中纤维素、木质素和果胶等的分解[8],一些特定类群能够促进土壤中有机物质进行矿化,完成硝化和反硝化等生态过程[9]。土壤细菌群落结构的形成是由确定性和随机性过程共同作用的结果[10],其相对贡献随环境因子[11]和空间尺度[12]的变化而变化。土地利用类型的转化[13]和草地利用方式的不同能够改变细菌的群落结构。刈割不仅能够改变草地植物组成及现存量、凋落物质量、土壤碳氮等元素的输入和转化[14-15],长期刈割还可以增加土壤温度,降低土壤含水量,进而影响土壤微生物活性和多样性[16]。此外割草制度也会影响土壤微生物生物量碳和磷细菌数量以及微生物活性,刈割能够显著增加细菌繁殖体、磷细菌和氨化细菌等微生物群落数量[17]。刈割不仅能够降低施肥对微生物生物量的有害效应,且刈割频率越高,施肥的有害效应越小,并且与土壤无脊椎动物相比,土壤微生物对刈割的响应更为敏感[18]。土壤细菌对刈割的响应需要综合多种环境因子,刈割对土壤细菌群落结构的影响可能会由于受干旱、氮磷限制而小于真菌[19]。综合上述前人研究,刈割对土壤细菌的研究多体现在对其细菌活性、微生物生物量和细菌多样性等方面。
然而,关于刈割对盐渍化草地土壤细菌群落结构影响以及关键细菌类群对生态环境因子的响应过程还不十分清楚。因此,本研究以我国晋北地区农牧交错带盐渍化草地生态系统为研究对象,对不同刈割强度下的土壤细菌群落结构进行了研究,分析刈割强度对土壤细菌群落结构影响的多样性、数量和结构变化,有助于揭示刈割条件下晋北盐渍化草地土壤细菌的生态分布和细菌对刈割强度的响应,为晋北盐渍化草地利用的科学化管理提供理论依据。
1 材料和方法
1.1 研究地概况
本实验在山西右玉黄土高原草地生态系统定位观测研究站完成(北纬39.998°,东经112.336°,海拔1348 m),实验站位于山西省朔州市右玉县威远镇后所堡村,占地约20 hm2。右玉县属温带大陆性季风气候区,年平均气温为4.2 ℃,最冷月为1 月,均温-10.5 ℃(-19 ℃~-2 ℃),最热月为7 月,均温20 ℃(13 ℃~27 ℃),总积温2600 ℃~3600 ℃。初霜期为9 月上、中旬,无霜期100 d~120 d。年均降水量410 mm,主要集中在6—9 月。右玉县草地为中温带半干旱草地生态系统,属于低地草甸类;优势种为赖草(Leymus secalinus),主要伴生种有鹅绒委陵菜(Potentilla anserina)、海乳草(Glaux maritima)、车前(Plantago asiatica)等[20]。研究区草地为盐碱化土壤,0 cm~40 cm 土层的pH 值范围在8.7~10.1,Na+含量为0.04 g/kg~1.06 g/kg,土壤SO42-变化范围为0.94 g/kg~1.79 g/kg,HCO3-变化范围为0.33 g/kg~1.85 g/kg;土壤含盐量范围在1.44 g/kg~5.5 g/kg,全磷含量在0.1 g/kg~0.3 g/kg[21]。
1.2 实验方法
1.2.1 实验设计
实验样地从2017 年开始刈割处理。每年8月中旬进行刈割,采用手动割草机进行,并将割除的草屑移出样地外,采用随机区组设计,共设置四个刈割强度,即不刈割(No Mowing,NM)对照,轻度刈割(Light Mowing,LM,留茬高度10 cm),中度刈割(Moderate Mowing,MM,留茬高度5 cm)和重度刈割(Heavy Mowing,HM,留茬高度2 cm),每种处理重复4 次,共16 个小区,每个小区面积为2 m×12 m,小区间隔1 m。
1.2.2 土壤取样与指标测定
于2021 年8 月用直径为3 cm 的土钻垂直钻取两钻土壤表层(0 cm~10 cm)的土壤,混匀后装入标记好的自封袋中,带回实验室过2 mm筛,除去根系、砂石等杂物,封装好备用。将一部分土壤风干,用元素分析仪(vario EL/MACRO cube,Elementar,Hanau,Germany)测定土壤全氮(TN)和全碳(TC);另取部分新鲜土样经0.5 mol·L-1的K2SO4溶液浸提后,用流动分析仪(FIAstar 5000 Analyzer,Foss Tecator,Denmark)测定硝态氮含量;剩下土样放于-20 ℃冰箱冷冻保存,用于高通量测序测定土壤细菌群落结构。土壤水分使用TDR-200(Spectrum Technologies,Plainfield,USA)进行测量。
1.2.3 DNA提取、PCR扩增及高通量测序
使用DNeasy PowerSoil Pro Kit(QIAGEN,USA)试剂盒提取土壤细菌DNA,使用质量分数1%琼脂糖凝胶电泳对DNA 进行检测。然后对细菌16S rRNA 基因V3-V4 引物区域进行PCR 扩增,引物为338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)。将相同样本的PCR 产物混合均匀后进行产物鉴定、纯化和定量后将获得的DNA 样品用Illumina 公司的Miseq PE 300/NovaSeq PE 250 平台进行测序(上海美吉)。
1.3 数据处理
在美吉平台上利用Mothur 1.30.2 计算土壤细菌群落的α 多样性指数(Shannon-Wiener 指数、Chao 指数、Simpson 指数和Ace 指数),使用Qiime 1.9.1 计算β 多样性距离并使用UPGMA方法进行层级聚类分析,然后用R(ver.3.3.1)作树状图。使用Excel 2021 进行原始数据整理,使用SPSS 19.0 对土壤细菌多样性进行单因素分析,用Duncan 检验方法进行显著性比较,差异显著水平为P<0.05。使用R(ver.3.3.1)对土壤因子和细菌群落结构进行相关性分析并作图,其他图在R(ver.4.1.2)进行。
2 结果与分析
2.1 刈割强度对细菌多样性的影响
刈割处理下的细菌群落Ace 指数、Chao 指数、Shannon-Wiener 指数和Simpson 指数均高于不刈割处理(图1)。Ace 指数和Chao 指数均随着刈割强度的增加呈现出先增加后降低再增加的“N”形变化趋势,但刈割处理间差异不显著(P>0.05)。在MM 处理下,细菌的Shannon-Wiener 指数显著高于其他处理,达到最大值(6.505),在NM 处理下达到最小值(6.411)。与不刈割处理相比,刈割显著增加了细菌群落的Simpson 指数,并且在LM 下达到最高值(0.004 3)。
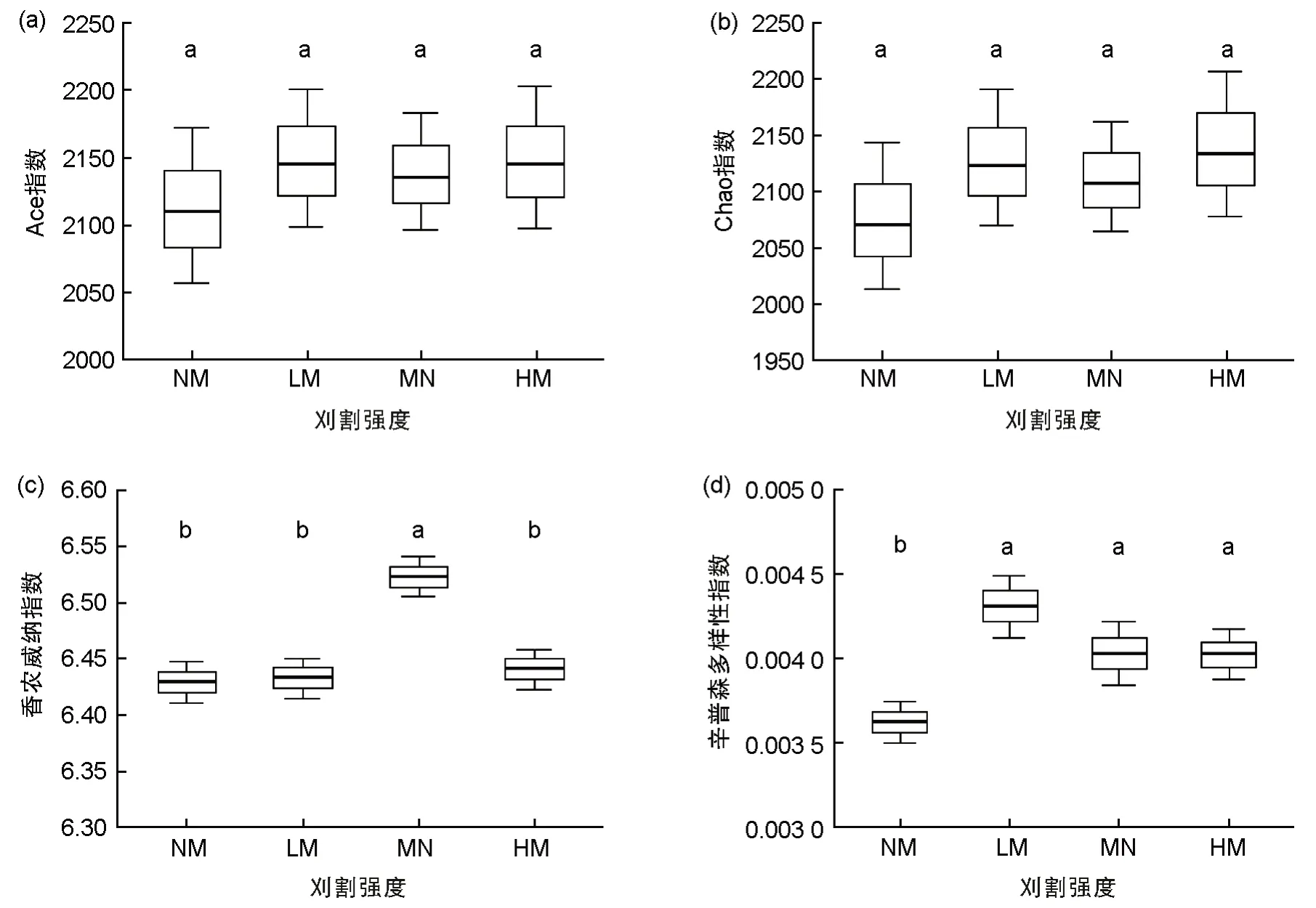
图1 不同刈割强度下细菌群落多样性指数Fig.1 Bacterial community diversity index under different mowing intensities
韦恩图可用于统计样本之间所共有和特有的物种(如操作分类单元(Operational Taxonomic Unit,OTU))数目,分析结果(图2)表明,四种刈割强度下土壤细菌群落拥有共同OTU 数为1296 个,占OTU 总数的56.77%。NM 特有的OTU 数为44 个,LM 为41 个,MM 为47 个,HM 为38 个,特有的OTU 数表现为MM>NM>LM>HM,说明在中度刈割下,土壤细菌特有的类群最多。LM 和MM 处理下共有OTU 数量占OTU 总数的70.87%,为所有刈割处理共有数量占OTU 总数百分比最高,而HM 和NM处理下共有OTU 数量占OTU 总数的67.89%,为所有刈割处理共有数量占OTU 总数百分比最低。表明LM 和MM 的细菌群落组成相似性大于HM 和NM 的细菌群落组成相似性。

图2 不同刈割强度下土壤细菌OTU数量韦恩图(a)表示四个刈割处理下所共有和特有的OTU数目;(b)表示四种刈割处理下每种刈割强度所拥有的OTU数目Fig.2 Venn diagram of OTU quantity of soil bacteria under different mowing intensities(a) The number of OTUs common and unique to the four mowing treatments; (b) the number of OTUs for each of the mowing treatments
2.2 不同刈割强度下土壤细菌群落的组成
经过质量筛选及最小样本序列数抽平后,共产生23 352 条有效细菌序列用于分析,按照97% OTU 序列相似性将其聚类为1 域1 界35门102 纲229 目345 科592 属1104 种2283 个OTU。在不同刈割处理下,门水平上相对丰度为前10 位的土壤细菌群落组成未发生显著变化(图3a),按照丰度排序分别为变形菌门、放线菌门、酸杆菌门、厚壁菌门、绿弯菌门(Chloroflexi)、拟杆菌门(Bacteroidota)、芽单胞菌门(Gemmatimonadota)、粘球菌门(Myxococcota)、甲基微菌门(Methylomirabilota)和硝化菌门(Nitrospirota)。变形菌门和放线菌门在不同刈割强度下均占绝对优势,二者的相对丰度之和达到细菌群落的47.04%~55.68%。在四种刈割处理下,变形菌门随着刈割强度先降低后增加,在中等刈割强度达到最低值,为21.09%。放线菌门的变化趋势则与之相反,随着刈割强度先增加后降低,在中等刈割强度达到最高值,为25.95%。厚壁菌门在刈割条件下均不同程度增加,在中等刈割强度下最高达到11.35%。
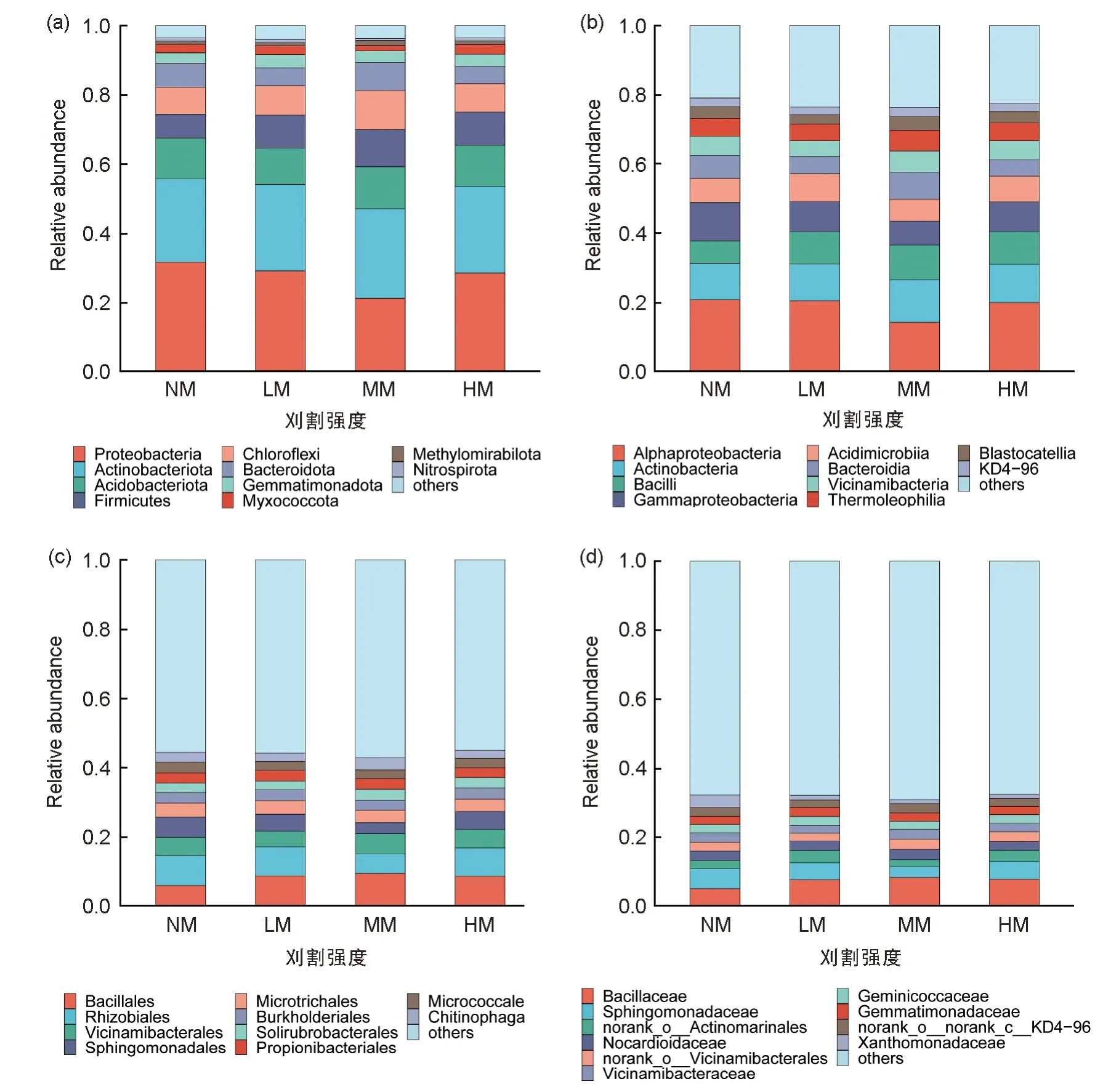
图3 门水平(a)、纲水平(b)、目水平(c)和科水平(d)下相对丰度前10位的土壤细菌群落组成Fig.3 Soil bacterial community composition at phylum (a), class (b), order (c) and family (d) levels with top 10 in relative abundance
在纲水平上(图3b),α-变形杆菌纲(Alphaprotebacteria)、放线菌纲(Actinobacteria)、芽孢杆菌纲(Bacilli)、丙型变形菌纲(Gammaproteoobacteria)和酸微菌纲(Acidimicrobiia)为细菌群落的优势纲,五个纲相对丰度之和在不同刈割处理下占全部细菌纲比为49.80%~57.06%,其中中度刈割最低,为49.80%,轻度刈割最高,为57.06%,其余两个刈割处理为NM(55.83%)、HM(56.40%)。不同刈割处理下优势菌丰度有所差异,说明刈割在纲水平上改变了细菌群落组成。
为了进一步探究不同刈割强度对盐渍化草地土壤细菌在目水平上的差异,选取不同刈割强度处理下丰度排名前十位的土壤细菌目进行分析(图3c),可以看出NM 的优势细菌目为根瘤菌目(Rhizobiales)、芽孢杆菌目(Bacillales)、鞘脂单胞菌目(Sphingomonadales)和Vicinamibacterales,LM 的优势细菌目为芽孢杆菌目、根瘤菌目、鞘脂单胞菌目和Vicinamibacterales,MM 的优势细菌目为芽孢杆菌目、Vicinamibacterales、根瘤菌目和鞘脂单胞菌目,HM 的优势细菌目为芽孢杆菌目、根瘤菌目、Vicinamibacterales 和鞘脂单胞菌目。不同刈割强度下的优势菌目均有所差异,说明刈割改变了目水平上细菌群落组成。
土壤细菌的优势菌科为芽孢杆菌科(Bacillaceae)、鞘脂单胞菌科(Sphingomonadaceae)、未分类的放线菌科(norank_o_Actinomarinales)、类诺卡氏菌科(Nocardioidaceae)和norank_o_Vicinamibacterales(图3d)。刈割改变了芽孢杆菌科的优势,在不刈割处理下,相对丰度最高的细菌科为鞘脂单胞菌科,其次为芽孢杆菌科,而在其他3 个刈割强度处理下,芽孢杆菌科的相对丰度超过了鞘脂单胞菌科,成为相对丰度最高的优势菌科。
选取门、纲、目和科水平下相对丰度为前10 位的细菌类群,在不同刈割处理下进行差异比较分析(图4),发现除Geminicoccaceae 在四个刈割处理下均不显著外,门水平、纲水平、目水平和科水平下细菌群落优势类群在不同刈割强度处理下变化均存在显著差异。进一步对细菌优势群落进行刈割处理间两两比较发现,Geminicoccaceae 在两两比较之间均不显著,刈割显著降低了变形菌门、丙型变形菌纲、鞘脂单胞菌目、鞘脂单胞菌科、黄单胞菌科(Xanthomonadaceae)的相对丰度,随刈割强度呈“V”字型变化,并且均在MM 处理下相对丰度最低;放线菌门、厚壁菌门、芽孢杆菌纲、芽孢杆菌目、芽孢杆菌科变化情况则与其相反,刈割显著增加了这些菌群的相对丰度,随刈割强度呈“单峰型”变化,并且均在MM 处理下相对丰度最高。放线菌纲、嗜热油菌纲(Thermoleophilia)在MM 处理下显著高于其他3 个刈割处理,且其他3 个刈割处理两两之间关系不显著;根瘤菌目则与之相反,在MM 处理下显著低于其他刈割处理,并且其他刈割处理之间关系不显著。

图4 不同刈割强度下在门水平(a)、纲水平(b)、目水平(c)和科水平(d)的优势细菌差异Fig.4 Differences of dominant bacteria at phylum (a), class (b), order (c) and family (d) levels under different mowing intensities
2.3 不同刈割强度下土壤细菌β多样性的差异
为研究不同刈割处理间细菌群落结构的相似性或差异关系,构建了样本层级聚类树(图5),可以将细菌群落分为三类,MM 为第一类,NM 为第二类,LM 和HM 为第三类。LM 和HM 距离最近并且归聚为一类,说明轻度刈割和重度刈割处理下细菌群落结构相似性最高;MM 与HM 距离最远,说明中度刈割和重度刈割处理下细菌群落结构差异性最大;而NM 位于层级聚类的第二层,与MM 和LM 距离相当,说明不刈割处理下的细菌群落结构与中度刈割和轻度刈割处理更相似。
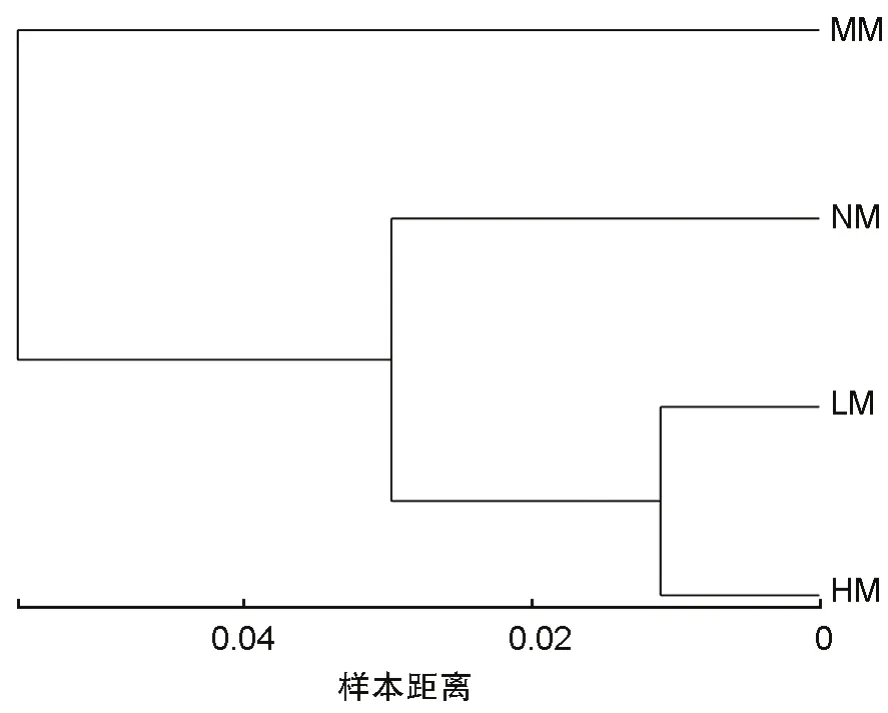
图5 非加权组平均法(UPGMA)样本层级聚类分析(树枝间的长度代表样本间β多样性的距离)Fig.5 UPGMA Sample level clustering analysis (the length between branches represents the distance of β diversity between samples)
2.4 优势真菌类群与环境因子关联分析
在对门水平、纲水平、目水平和科水平上的土壤环境因子、土壤微生物多样性与优势细菌群落进行相关性分析(图6),结果显示,土壤硝态氮(Nit)和细菌Shannon-Wiener 指数与变形菌门和硝化菌门、α-变形杆菌纲和丙型变形菌纲、根瘤菌目显著负相关,与放线菌门和厚壁菌门、放线菌纲和芽孢杆菌纲、芽孢杆菌科显著正相关。土壤TC 与粘球菌门、伯克氏菌目(Burkholderiales)显著正相关,与拟杆菌门、拟杆菌纲(Bacteroidia)显著负相关。土壤碳氮比C∶N 与芽单胞菌门显著负相关。土壤水分(SM)与酸杆菌门和甲基微菌门、嗜热油菌纲、Vicinamibacterales 和Solirubrobacterales、norank_o_Vicinamibacterales 显著正相关。土壤细菌Simpson 指数与芽单胞菌纲(Gemmatimonadetes)、芽单胞菌科(Gemmatimonadaceae)显著正相关,与微球菌目(Micrococcales)显著负相关。

图6 刈割处理下土壤环境因子、土壤微生物多样性与优势细菌类群间的相关性分析((a)门水平;(b)纲水平;(c)目水平;(d)科水平)Fig.6 Correlation analysis of soil environmental factors, soil microbial diversity and dominant bacterial community under mowing treatment, ((a) phylum level; (b) class level; (c) order level; (d) family level)
为进一步研究土壤因子对土壤细菌群落的影响,对土壤细菌Shannon-Wiener 指数与土壤硝态氮、TC、C∶N 和土壤水分进行多元回归分析(表1),多元回归结果发现土壤细菌Shannon-Wiener 指数与土壤硝态氮、C∶N 和水分回归不显著,但与土壤TC 回归显著。
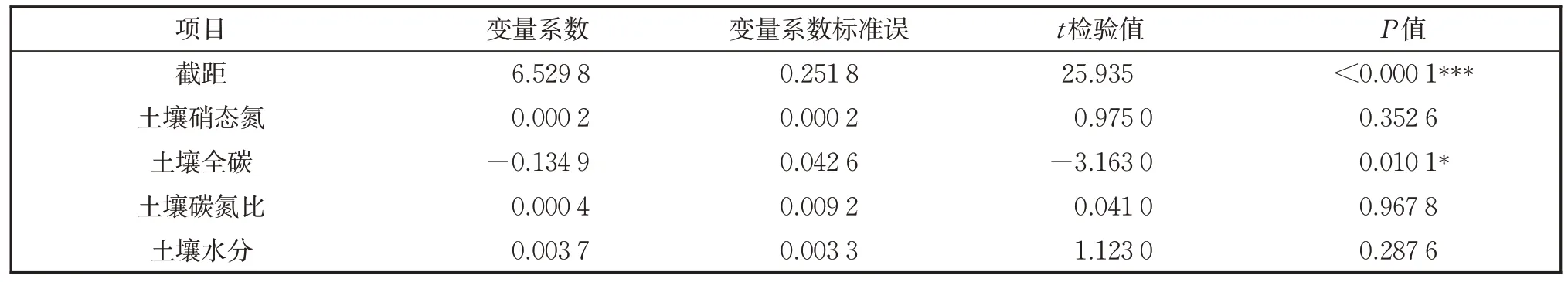
表1 土壤细菌群落Shannon-Wiener指数与土壤环境因子的多元回归分析Table 1 Multiple regression of soil bacteria Shannon-Wiener index and soil factors
3 讨论
3.1 不同刈割处理下草地土壤细菌多样性的状况
土壤微生物α 多样性被用于描述单一生境或处理的微生物群落组成[22],Shannon-Wiener指数和Simpson 指数都能反映群落物种组成的丰富度和均匀度,但前者主要反映了物种间个体分配的均匀程度,与丰富度关系密切,而后者则反映了随机取样的个体属于不同物种的概率,对富集种更敏感[23]。土壤微生物多样性受土壤水分的影响,在内蒙古从草原、荒漠草原到沙漠由湿润到干旱的梯度中,土壤微生物多样性显著降低[24]。在我们的研究中细菌多样性与土壤水分没有显著影响,但与土壤TC 具有显著影响(P<0.05)(表1)。不同的利用方式对土壤微生物多样性的影响不同,与放牧和围封相比,刈割的物种丰富度指数、均匀度指数和优势度指数更低[25]。在我们的研究中,刈割会改变土壤微生物的群落结构和组成,增加细菌群落多样性(图1)。在刈割处理下,土壤细菌Ace 和Chao 丰富度、Shannon-Wiener 多样性指数和Simpson 优势度指数均高于不刈割处理,但是细菌群落丰富度在4 个刈割处理间无显著性差异。本研究中的结果显示,在中度刈割强度下,土壤细菌的Shannon-Wiener 指数为最大,说明在该强度下细菌菌群之间的个体分配更均匀;在轻度刈割强度下,细菌的Simpson指数最大,说明轻度刈割强度下细菌群落优势种发生改变。在样本层级聚类分析中(图5)土壤细菌在中度刈割处理下与其他刈割处理下的样本距离最远,说明在轻度刈割和中度刈割下,细菌的物种多样性和优势度均达到了最大值,且土壤细菌群落出现了差异。
3.2 刈割对土壤细菌优势类群的影响
土壤细菌中的主要优势类群在生态系统中具有重要的功能,放线菌门、厚壁菌门、变形菌门和拟杆菌门均被认为是潜在的分解者[26]。变形菌能充分利用土壤碳,在土壤碳充足的情况下能够快速生长[27],并且可以利用有机物分解产生的营养物进行生长代谢[28];放线菌被证明可以降解有机物[22],从而促进凋落物、动植物残体等有机物质在土壤中快速分解;芽孢杆菌类菌群可能具有一定的耐盐碱能力,梁翔宇等[29]在宁夏银北地区盐碱地鉴定出了3 株耐盐碱菌株,3 株菌株分别为壁芽孢杆菌(Bacillus muralis)、短小芽孢杆菌(B.pumilus)、和萎缩芽孢杆菌(B.atrophaeus);变形菌和放线菌、芽孢杆菌等菌群均可以促进微生物磷酸盐矿化[30]。本研究结果(图3)表明,在晋北地区盐渍化草地土壤细菌群落中变形菌门相对丰度最高,其次为放线菌门、酸杆菌门、厚壁菌门和绿弯菌门。在苟燕妮[31]的研究中发现陇东典型草原土壤中细菌类群相对丰度较高的分别是变形菌、放线菌、酸杆菌;在松嫩平原盐碱地中,变形菌门、酸杆菌门、放线菌门、绿弯菌门为该草地土壤细菌群落的优势细菌门[32],这些结果与我们的结果一致,说明这几种细菌类群可能具有一定的耐盐碱能力。
微生物组成受到生物因素和非生物因素的高度影响,特别是土壤pH、养分和土壤水分,均能改变土壤微生物群落结构[33]。在本研究中,土壤硝态氮和细菌Shannon-Wiener 指数与放线菌门和厚壁菌门显著正相关,与变形菌门和硝化菌门显著负相关(图6),土壤TC与粘球菌门显著正相关,土壤C∶N 与芽单胞菌门显著负相关,土壤水分与酸杆菌门和甲基微菌门显著正相关;说明土壤硝态氮、TC、C∶N 和水分均与这些细菌门的功能相关,并能影响细菌门群落组成。有研究表明土壤微生物生物量与土壤碳含量高度相关[34],并且土壤pH 值和养分质量指标是决定土壤细菌群落结构的关键因素[35]。
不同的土壤环境因子引起了不同的土壤细菌类群变化,这可能是细菌群落结构的动态变化与不同的激发效应模式有关导致的[36],即土壤硝态氮、TC 和水分具有不同的生态功能,能够刺激相关关键细菌类群活性,并且改变硝态氮、TC 和水分在土壤中的含量,形成不同的激发效应模式。在多元回归分析中(表1),TC 与细菌群落多样性显著正相关,说明土壤TC 可能是导致土壤细菌优势群落发生转变的驱动因子。土壤硝态氮可以增加细菌多样性,并具有显著正相关关系[37],在我们的研究中,土壤硝态氮和细菌Shannon-Wiener 指数在门、纲、目、科水平上细菌类群的影响均具有相同的趋势(图6),但是两种指标之间回归关系并不显著(表1)。与不刈割相比,刈割显著降低了变形菌门的相对丰度,并且在中度刈割处理下最低(图4a),可能是刈割条件下土壤受碳的限制,因此不利于变形菌门的生长和代谢。而刈割增加了放线菌门和厚壁菌门的相对丰度,并且在中度刈割处理下相对丰度最高。说明中度刈割处理能够促进土壤有机物质的分解,促使土壤有机物质如碳、氮进行矿化成为无机物。此外中度刈割处理能够促使细菌优势群落发生转变,使放线菌门和绿弯菌门的相对丰度分别大于变形菌门和厚壁菌门。
4 结论
在晋北盐渍化草地,刈割增加了土壤细菌的多样性,中度刈割显著提高了土壤细菌的Shannon-Wiener 指数和Simpson 指数,并且在轻度刈割处理下最高。刈割改变了盐渍化草地土壤细菌优势群落,能够显著降低变形菌门的相对丰度,显著增加放线菌门和厚壁菌门的相对丰度,尤其在中度刈割强度下更为明显。土壤细菌群落组成受土壤硝态氮、TC、碳氮比和土壤水分等因子的调控。刈割可能通过影响土壤TC,改变土壤细菌中变形菌门、放线菌门、厚壁菌门和绿弯菌门的优势地位,进而影响土壤细菌多样性。