中枢性性早熟女童使用不同剂型亮丙瑞林治疗的临床疗效观察
2023-12-09杨明明汤涌泉周文娣1
杨明明,汤涌泉,高 钱,王 婕,蒋 雪,周文娣1,
(1.徐州医科大学淮安临床学院儿科,江苏 淮安 223300;2.滨海县人民医院儿科,江苏 盐城 224500;3.南京医科大学附属淮安第一医院儿科,江苏 淮安 223300)
中 枢 性 性 早 熟(central precocious puberty,CPP)是一种内分泌紊乱性疾病,女童多见。其病因主要由下丘脑-垂体-性腺轴(hypothalamic-pituitarygonadal axis,HPGA)功能过早启动,导致患儿体内性激素含量异常增高,第二性征过早呈现,骨骼生长发育异常加快而引起骨骺过早闭合,从而影响患儿成年终身高,影响心理健康。促性腺激素释放激素类似物(gonadotropin-releasing hormone agonist,GnRHa)为治疗该病的标准药物。这些药物通过GnRH 受体的脱敏和下调来抑制促性腺激素的分泌,导致性腺类固醇水平降低至青春期前水平,进而逆转或稳定青春期发育,并且促使生长正常化。目前国际上有1 月、3 月、6 月及12 月剂型,6 月及12月剂型在国外尚处于临床试验期,我国以1 月剂型(3.75 mg)的亮丙瑞林和曲普瑞林最为常用。3 月剂型(11.25 mg)醋酸亮丙瑞林(lepraline acetate,LA)在国外应用较多,其疗效值得肯定[1],而我国应用较少,且是豁免进入,尚未获得大规模临床数据[2]。2019 年发布的《GnRHa 在儿童中的应用:国际联盟更新》指出:长效制剂是趋势[3]。由于CPP 可能需要数年的治疗,因此越来越需要使用长效制剂来改善患儿的治疗依从性和生活质量。因此,本研究分别使用3 月和1 月长效缓释剂型LA 治疗CPP女童,观察并比较两种剂型LA 对我国CPP 女童的疗效。为LA 3 月长效剂型在我国本土使用提供进一步临床依据。
1 资料与方法
1.1 研究对象
本研究为前瞻性研究,共纳入72 例于2021 年2月~2022 年8 月在徐州医科大学淮安临床学院儿科诊治的CPP 女童作为研究对象。CPP 诊断参照《中枢性性早熟诊断与治疗共识》[2]。纳入标准:(1)符合CPP 诊断标准;(2)在诊断时年龄在10 岁以下,体重超过20 kg;(3)就诊前未接受过GnRHa 或其他影响疗效判断的药物治疗。排除标准:(1)不符合CPP 诊断标准;(2)由中枢神经系统疾病、生殖器肿瘤、先天性甲状腺功能减低等引起的继发性性早熟;(3)合并有其他慢性病,如慢性肾病、哮喘、癫痫、血液病等;(4)依从性差,或因其他原因无法遵医嘱完成治疗者。本研究按照《赫尔辛基宣言》和徐州医科大学淮安临床学院伦理委员会(伦理编号:KY-2023-017-01)制定的伦理标准进行。所有患儿及其家长对调查方案知情同意。
1.2 给药方法
研究对象依据给药剂型不同分为2 组:3 月剂型组和1 月剂型组。3 月剂型组予以皮下注射亮丙瑞林微球(抑那通,规格11.25 mg,日本武田制药有限公司生产),每12 周1 次,1 月剂型组予以皮下注射亮丙瑞林微球(抑那通,规格3.75 mg),每4 周1 次。两组干预时间均至少连续使用6 月,同时对患儿饮食、睡眠、运动进行指导。
1.3 观察指标和方法
所有入组患儿由专业医务人员收集一般资料,并在0、3、6 月时测量身高、体重并检查性征(阴毛、外生殖器及乳房),计算生长速率、体质量指数(body mass index,BMI);在治疗0 月、6 月时,行Gn-RHa 激发试验,即晨8 点空腹皮下注射达必佳(曲普瑞林注射液 2.5 μg/kg,最大不超过100 μg,规格0.1 mg 水针剂,辉凌德国制药公司生产),分别于注射后 0、30、60 和90 min 采血测定血清黄体生成素(luteinizing hormone,LH)和卵泡刺激素(follicle stimulating hormone,FSH)的水平,同时送检0 min 时血清雌二醇(estradiol,E2)、胰岛素样生长因子(insulin-like growth factor-1,IGF-1)、促甲状腺激素(Thyroid stimulating hormone,TSH)、游离三碘甲状腺原氨酸(Free triiodothyronine,FT3)、游离甲状腺素(Free thyroxine,FT4)、空腹血糖(fasting blood glucose,FBG)、总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG);行盆腔超声检查,记录子宫长径、子宫容积、双侧卵巢容积、≥4 mm 的卵泡数及最大卵泡直径;摄左腕骨龄(bone age,BA),Greulich-Pyle 法评估骨龄,计算骨龄指数=骨龄/实际年龄(chronological age, CA)即BA/CA,并依据Bay-ley-Pinneau 法计算预测成年身高(predicting adult height,PAH)[4]。血清 LH、FSH 和 E2 浓度通过电化学发光免疫测定法测量。治疗后血清LH 峰值<4 IU/L 被认为抑制了HPGA 轴[5]。
1.4 统计学处理
运用SPSS 26.0 统计软件进行数据分析。定量资料均符合正态分布,用均数±标准差(±s)表示,两组间比较采用t检验;定性资料用例数(%)表示,比较采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组患儿治疗前基线数据比较
两组患儿在治疗开始前的基线特征,包括年龄、骨龄、实际身高、体重、BMI、遗传身高、青春期阶段均无显著差异。见表1。
表1 LA 3 月剂型组和1 月剂型组患儿基线数据的比较(±s)Tab 1 Comparison of baseline data between the LA 3-month depot and 1-month depot groups (±s)
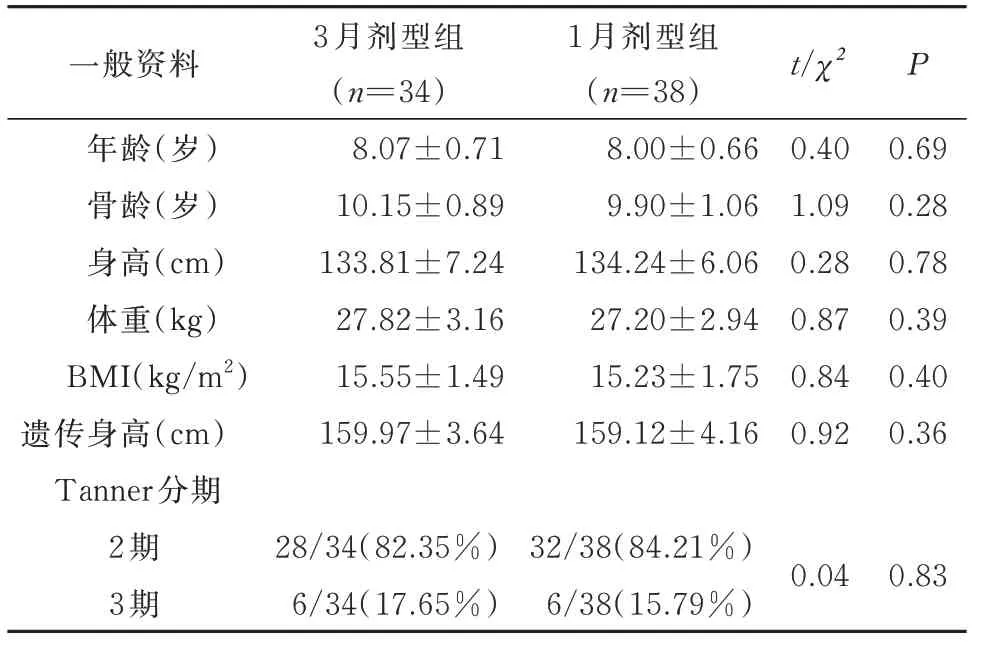
表1 LA 3 月剂型组和1 月剂型组患儿基线数据的比较(±s)Tab 1 Comparison of baseline data between the LA 3-month depot and 1-month depot groups (±s)
一般资料年龄(岁)骨龄(岁)身高(cm)体重(kg)BMI(kg/m2)遗传身高(cm)3 月剂型组(n=34)8.07±0.71 10.15±0.89 133.81±7.24 27.82±3.16 15.55±1.49 159.97±3.64 1 月剂型组(n=38)8.00±0.66 9.90±1.06 134.24±6.06 27.20±2.94 15.23±1.75 159.12±4.16 t/χ2 P 0.40 1.09 0.28 0.87 0.84 0.92 0.69 0.28 0.78 0.39 0.40 0.36 Tanner 分期2 期3 期28/34(82.35%)6/34(17.65%)32/38(84.21%)6/38(15.79%)0.04 0.83
2.2 两组患儿治疗前后生长指标的比较
两组患儿治疗前、治疗后的BA/CA、生长速率、PAH、BMI 比较均无显著差异。与治疗前相比,治疗6 月后两组患儿均出现BA/CA 减小、生长速率减慢、PAH 增加,差异有统计学意义(P<0.05)。治疗前后IGF-1 水平有下降趋势,但差异无统计学意义。治疗后BMI 无显著改变。提示两种剂型LA 对生长指标的影响相当。见表2。
表2 两组患儿治疗前后生长指标的比较(±s)Tab 2 Comparison of growth indexes between the two groups before and after treatment (±s)
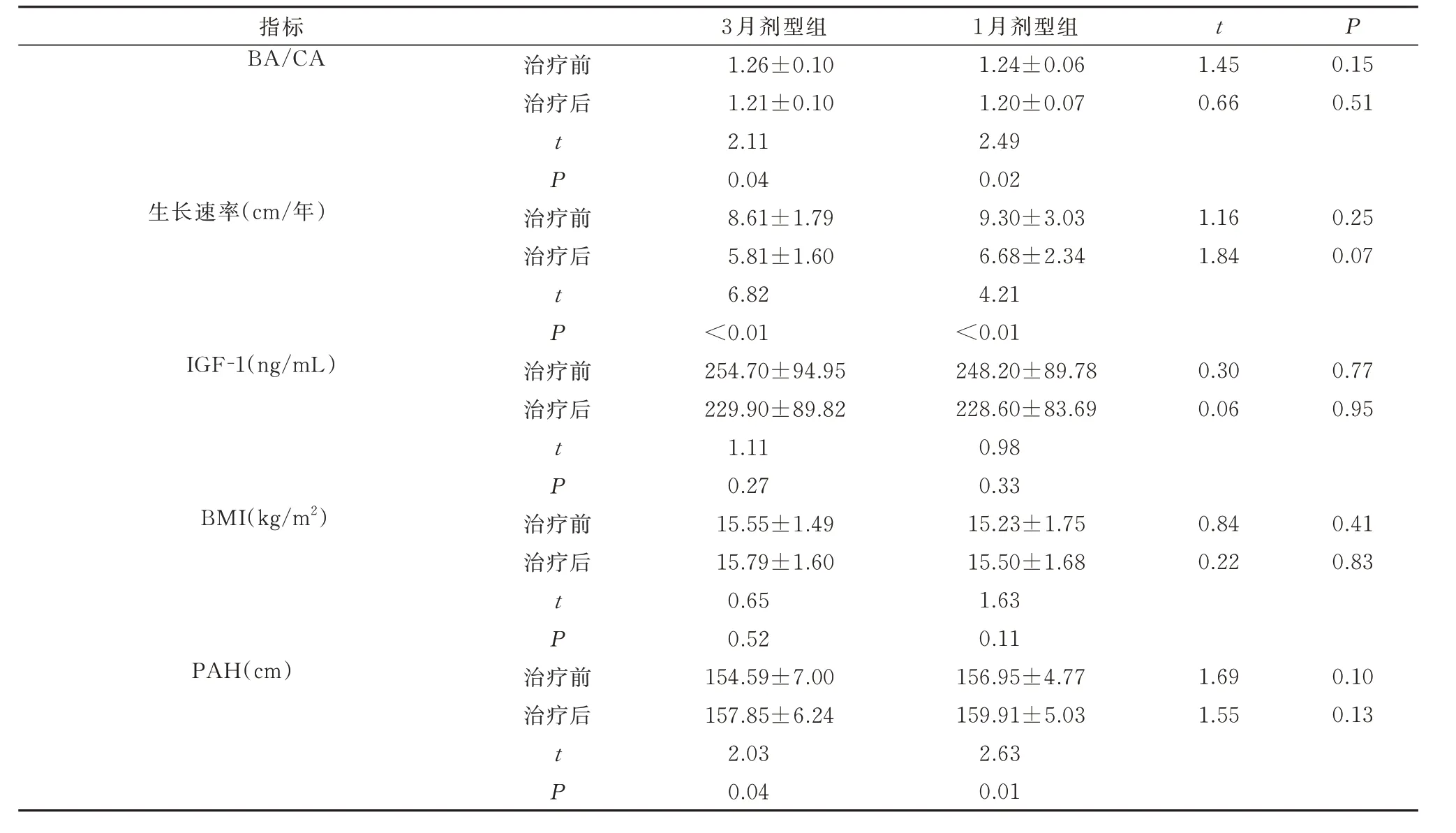
表2 两组患儿治疗前后生长指标的比较(±s)Tab 2 Comparison of growth indexes between the two groups before and after treatment (±s)
指标BA/CA t P治疗前治疗后1.45 0.66 0.15 0.51 t P生长速率(cm/年)治疗前治疗后1.16 1.84 0.25 0.07 t P IGF-1(ng/mL)治疗前治疗后0.30 0.06 0.77 0.95 t P BMI(kg/m2)治疗前治疗后0.84 0.22 0.41 0.83 t P PAH(cm)治疗前治疗后1.69 1.55 0.10 0.13 t P 3 月剂型组1.26±0.10 1.21±0.10 2.11 0.04 8.61±1.79 5.81±1.60 6.82<0.01 254.70±94.95 229.90±89.82 1.11 0.27 15.55±1.49 15.79±1.60 0.65 0.52 154.59±7.00 157.85±6.24 2.03 0.04 1 月剂型组1.24±0.06 1.20±0.07 2.49 0.02 9.30±3.03 6.68±2.34 4.21<0.01 248.20±89.78 228.60±83.69 0.98 0.33 15.23±1.75 15.50±1.68 1.63 0.11 156.95±4.77 159.91±5.03 2.63 0.01
2.3 两组患儿治疗前后激素水平和HPGA 轴抑制情况比较
两组患儿治疗前、治疗后的血清LH 峰值、FSH峰值、E2 水平均无显著差异。与治疗前相比,治疗6个月后两组患儿的LH 峰值、FSH 峰值、E2 水平均显著降低(P<0.05)。治疗6 月后,LA 3 月剂型组有32/34((94%)的患儿LH 反应得到充分抑制(LH峰值<4 IU/L),而1 月剂型组有35/38(92%)被抑制,两者间无显著差异(χ2=0.11,P=0.74),均提示HPGA 轴得到有效抑制。此外,两组患儿治疗开始前的Tanner 分期均为2 或3,并且分布均匀。治疗6月后,两组患儿的Tanner 分期均无进展。上述结果表明,两种剂型LA 抑制患儿HPGA 轴及性激素水平的效果相当。见表3。
表3 两组患儿治疗前后血清LH 峰值、FSH 峰值和E2 水平的比较(±s)Tab 3 Comparison of serum peak LH, peak FSH, and E2 levels between the two groups before and after treatment (±s)
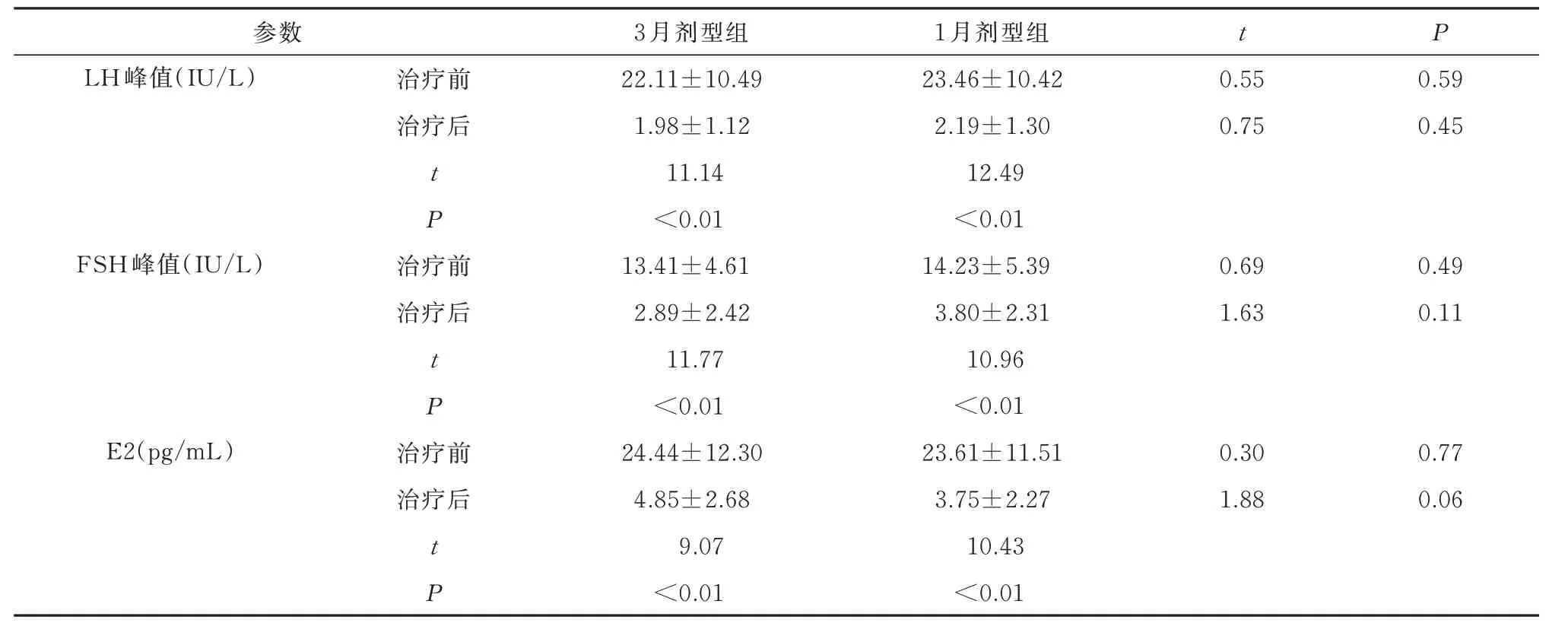
表3 两组患儿治疗前后血清LH 峰值、FSH 峰值和E2 水平的比较(±s)Tab 3 Comparison of serum peak LH, peak FSH, and E2 levels between the two groups before and after treatment (±s)
参数LH 峰值(IU/L)t P治疗前治疗后0.55 0.75 0.59 0.45 t P FSH 峰值(IU/L)治疗前治疗后0.69 1.63 0.49 0.11 t P E2(pg/mL)治疗前治疗后3 月剂型组22.11±10.49 1.98±1.12 11.14<0.01 13.41±4.61 2.89±2.42 11.77<0.01 24.44±12.30 4.85±2.68 0.30 1.88 0.77 0.06 t P 9.07<0.01 1 月剂型组23.46±10.42 2.19±1.30 12.49<0.01 14.23±5.39 3.80±2.31 10.96<0.01 23.61±11.51 3.75±2.27 10.43<0.01
2.4 两组患儿治疗前后盆腔超声各参数的比较
与治疗前相比,治疗6 个月后两组患儿的子宫长径、子宫容积、双侧卵巢容积、最大卵泡直径及≥4 mm 的卵泡数均显著降低(P<0.05)。而两组间比较均无显著差异,表明两种剂型LA 对性腺抑制效果相当。见表4。
表4 两组患儿治疗前后盆腔超声各参数的比较(±s)Tab 4 Comparison of parameters of pelvic ultrasound between the two groups before and after treatment(±s)
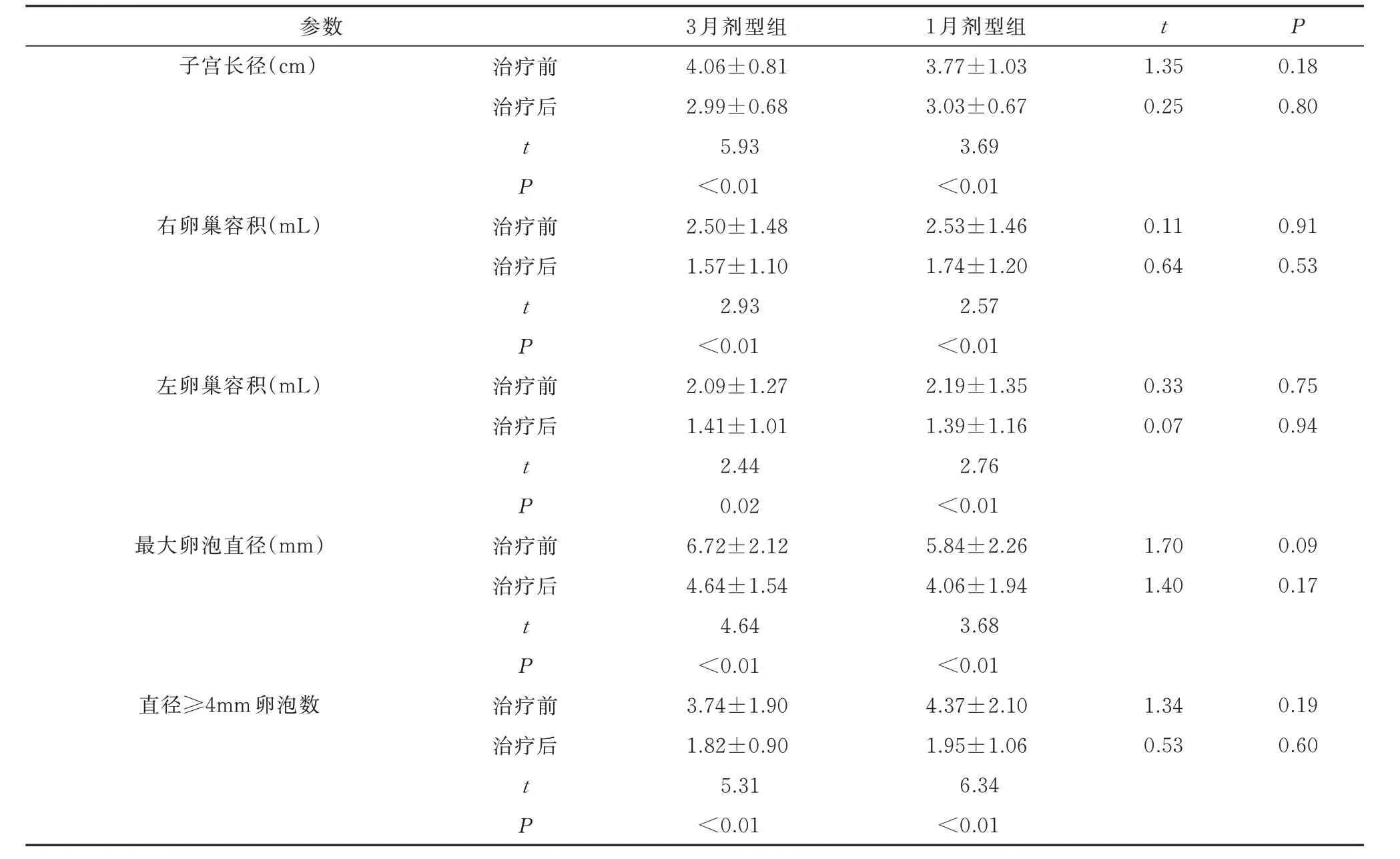
表4 两组患儿治疗前后盆腔超声各参数的比较(±s)Tab 4 Comparison of parameters of pelvic ultrasound between the two groups before and after treatment(±s)
参数子宫长径(cm)t P治疗前治疗后1.35 0.25 0.18 0.80 t P右卵巢容积(mL)治疗前治疗后0.11 0.64 0.91 0.53 t P左卵巢容积(mL)治疗前治疗后0.33 0.07 0.75 0.94 t P最大卵泡直径(mm)治疗前治疗后1.70 1.40 0.09 0.17 t P直径≥4mm 卵泡数治疗前治疗后1.34 0.53 0.19 0.60 t P 3 月剂型组4.06±0.81 2.99±0.68 5.93<0.01 2.50±1.48 1.57±1.10 2.93<0.01 2.09±1.27 1.41±1.01 2.44 0.02 6.72±2.12 4.64±1.54 4.64<0.01 3.74±1.90 1.82±0.90 5.31<0.01 1 月剂型组3.77±1.03 3.03±0.67 3.69<0.01 2.53±1.46 1.74±1.20 2.57<0.01 2.19±1.35 1.39±1.16 2.76<0.01 5.84±2.26 4.06±1.94 3.68<0.01 4.37±2.10 1.95±1.06 6.34<0.01
2.5 两组患儿治疗前后代谢指标的变化
治疗前、后两组患儿TSH、FT3、FT4、FBG、TG 等无显著差异。治疗后,3 月剂型组(P=0.04)和1 月剂型组(P=0.04)均出现血TC 显著升高,但两组间比较无明显差异。见表5。
表5 两组患儿治疗前后代谢指标的比较(±s)Tab.5 Comparison of metabolic indexes between the two groups before and after treatment(±s)
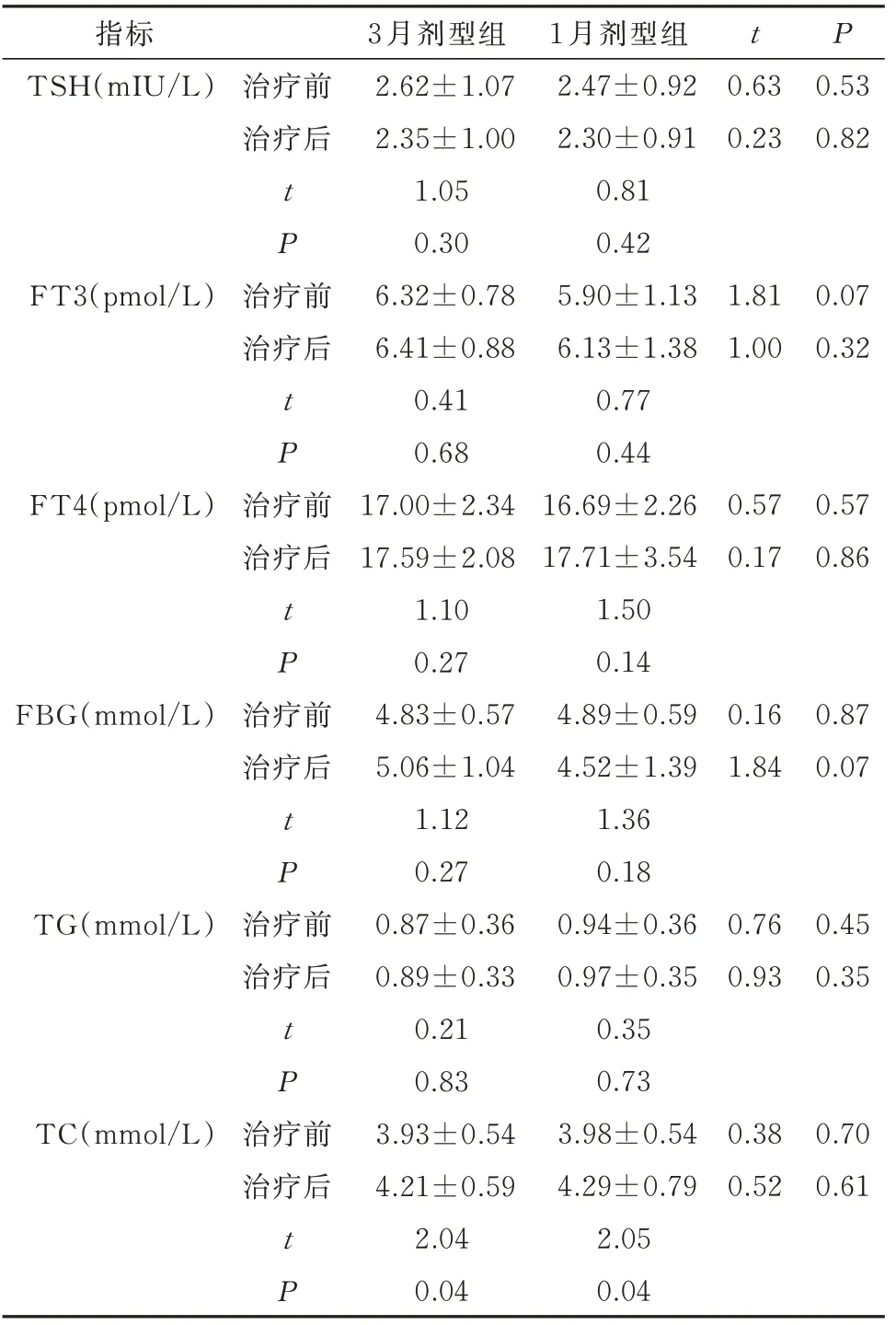
表5 两组患儿治疗前后代谢指标的比较(±s)Tab.5 Comparison of metabolic indexes between the two groups before and after treatment(±s)
指标TSH(mIU/L)t P治疗前治疗后0.63 0.23 0.53 0.82 t P FT3(pmol/L)治疗前治疗后1.81 1.00 0.07 0.32 t P FT4(pmol/L)治疗前治疗后0.57 0.17 0.57 0.86 t P FBG(mmol/L)治疗前治疗后0.16 1.84 0.87 0.07 t P TG(mmol/L)治疗前治疗后0.76 0.93 0.45 0.35 t P TC(mmol/L)治疗前治疗后0.38 0.52 0.70 0.61 t P 3 月剂型组2.62±1.07 2.35±1.00 1.05 0.30 6.32±0.78 6.41±0.88 0.41 0.68 17.00±2.34 17.59±2.08 1.10 0.27 4.83±0.57 5.06±1.04 1.12 0.27 0.87±0.36 0.89±0.33 0.21 0.83 3.93±0.54 4.21±0.59 2.04 0.04 1 月剂型组2.47±0.92 2.30±0.91 0.81 0.42 5.90±1.13 6.13±1.38 0.77 0.44 16.69±2.26 17.71±3.54 1.50 0.14 4.89±0.59 4.52±1.39 1.36 0.18 0.94±0.36 0.97±0.35 0.35 0.73 3.98±0.54 4.29±0.79 2.05 0.04
2.6 不良反应
在6 个月的治疗过程中,3 月剂型组有1 例患儿出现一过性血尿,未特殊处理,自行消失;1 月剂型组有1 例患儿出现头痛,后未用药自行缓解,均未影响LA 治疗过程。余患儿未见明显不良反应发生,不良反应总发生率为2.78%(2/72)。
2.7 治疗经济学和依从性比较
对比1 月剂型LA,使用3 月剂型的LA 可减少患者就诊次数,以治疗半年计算,由原来每月一次就诊减少为每三月一次,共减少4 次就诊,降低了患者的直接医疗成本,包括挂号费、注射费等,也减少了非医疗成本,包括往返交通费和陪诊家长的误工费等间接成本,降低了治疗费用。且三月剂量LA 能减少患儿注射次数和频率,提高了患儿治疗的依从性。
3 讨论
近年来随着经济的快速发展、物质条件的改善以及饮食习惯的改变,世界范围内的CPP 发病率均呈逐年升高趋势,并且得到全社会的广泛关注[6,7]。GnRHa 因其较高的安全性及有效性而被广泛用于CPP 的治疗,迄今为止,我国主流的治疗选择仍然是1 个 月 的GnRHa 制 剂[2]。然 而 考 虑 到CPP 患 儿治疗疗程一般需要持续至少2 年以上,使用3 个月的长效GnRHa 制剂有望提高患者的依从性。每3个月使用1 次的11.25 mg 的醋酸亮丙瑞林微球于2011 年已被美国食品药品管理局批准用于CPP 治疗,2020 年进入我国,是目前国内第一个获批可用于CPP 治疗的3 月剂型。其有效性及安全性已在国外得到广泛认可[8],但我国人种、饮食及生活方式等与国外儿童差异较大,其疗效有待进一步证实。目前,国内很少有研究报道对比3 月剂型(11.25 mg)和1 月剂型(3.75 mg)GnRHa 制剂在治疗CPP 方面的疗效。本研究观察了3 月剂型LA 与1 月剂型LA治疗中国CPP 女童的临床疗效。结果表明,LA 3月剂型与1 月剂型在抑制CPP 女童的HPGA 轴及骨骼成熟等方面的疗效相当,这与既往研究结果一致[9]。
本研究结果显示,经过6 个月的治疗,两组CPP患儿LH 峰值及FSH 峰值均显著下降,治疗后患儿血清E2 水平较基线时下降约5~6 倍。目前尚无统一标准来判定治疗后LH 被抑制(即注射GnRHa 后LH 峰值),我们的研究中以LH<4 IU/L 作为参考[5],治疗6 个月时LA 3 月剂型组和1 月剂型组分别有94%和92%的患儿得到充分抑制。提示LA的3 月剂型和1 月剂型一样,可以有效抑制CPP 患儿的性激素水平。两组患儿的子宫长径、子宫容积、卵巢容积、卵泡最大径和≥4 mm 的卵泡个数均较治疗前明显降低,进一步证实了两种剂型LA 对HPGA 轴的抑制效果相当。
本研究对患儿治疗前后的生长指标进行对比分析,结果显示与治疗前相比,两组患儿在治疗6 月后均出现BA/CA、生长速率下降,PAH 上升,逐渐向遗传靶身高靠拢。说明在LA 的3 月剂型和1 月剂型疗效相当,均能抑制BA 过快进展,促进患儿生长发育向正常发育过程回归。本研究中患儿的基线年龄为8 岁,虽经治疗后生长速率减慢,但由于性激素作用被抑制,因此而导致的身高损失被避免,故PAH 上升,仍然可有身高获益。但关于8 岁后性早熟儿童接受GnRHa 治疗后是否能够取得身高获益,目前研究结论尚不一致。有研究显示8.3 岁后接受GnRHa 治疗可能不会有终身高获益[10],另多项研究显示即使8 岁后治疗,亦可改善CPP 女童的最终身高[11,12]。
关于GnRHa 治疗与体重增加及肥胖之间的关联,一直存在争议。部分研究指出,GnRHa 治疗可引起BMI 上升[13-16]。另有部分研究显示,GnRHa 治疗 不 影 响 甚 至 降 低BMI[8,17]。本 研 究 显 示,LA 的3月剂型和1 月剂型治疗均未显著改变患儿BMI,但在治疗期间仍需注意加强体育锻炼、合理饮食。此外,笔者观察了LA 治疗前后患儿的甲状腺功能及糖脂代谢指标的变化,结果显示治疗后两组患儿FT3、FT4 有升高趋势,而TSH 有下降趋势,但差异均无统计学意义,说明两种剂型LA 治疗均不影响患儿甲状腺功能,与既往研究报道一致[18]。此外,FBG、TG 水平在治疗前后无明显差异。两组患儿血TC 水平较治疗前有显著升高,但尚在正常值范围,这可能与治疗后雌激素水平下降所导致肝脏脂代谢紊乱有关[19]。
GnRHa 治疗的常见副作用有:注射部位疼痛、肿胀、无菌性脓肿、首次应用出现阴道出血及多囊卵巢综合征等[2],多囊卵巢综合征可影响患者生殖功能,还增加了糖脂代谢异常、心血管疾病等发生的风险[20]。本研究在6 个月的治疗过程中,3 月剂型组有1 例患儿出现一过性血尿,1 月剂型组有1 例患儿出现头痛,两例患儿均未用药自行缓解、未影响治疗过程。余患儿未见明显不良反应发生。证实了LA 的3 月剂型和1 月剂型均具有较高的安全性。此外《中枢性性早熟诊断与治疗共识(2015)》指出,以改善身高为目的的GnRHa 治疗一般持续两年以上。相较于1 月剂型LA,3 月剂型LA 能有效减少患者就诊次数,降低治疗成本,提高患儿治疗的依从性。然而,本研究有几个局限性,首先观察时间较短,需进一步延长随访时间以观察其远期疗效;其次,未纳入男童进行研究,未来的研究中可收集更多关于男童的数据。
综上所述,亮丙瑞林3 月长效制剂与1 月长效制剂疗效相当,均能有效抑制CPP 女童的HPGA 轴及性激素水平,抑制青春期进展、减弱BA 进展、增加PAH。两种制剂治疗均未出现严重不良反应,其有效性及安全性与国内外研究报道一致。此外,3月长效剂型的使用可有效减少就诊次数,降低治疗成本,提高治疗依从性,具有经济学优势[21],适合在我国推广使用。
作者贡献度说明:
杨明明:课题设计及实施,数据收集,统计分析,撰写并修改论文;周文娣:课题设计,指导、审阅文章;汤涌泉、高钱、王婕:数据收集;蒋雪:数据收集及分析。
所有作者声明不存在利益冲突关系。
