大麻二酚对博来霉素诱导肺纤维化大鼠的药效学研究
2023-12-09孙梦迪张飞宇陈平平刘树民
孙梦迪,张飞宇,高 鑫,王 宇,陈平平,刘树民
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.黑龙江中医药大学中医药研究院,黑龙江 哈尔滨 150040)
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是一种进行性且不可逆的肺部疾病[1]。肺纤维化(pulmonary fibrosis,PF)病变是由多种信号通路和细胞因子相互作用而引起的。虽然目前对于肺纤维化的发病机制尚不清楚,但是研究表明氧化应激和过度炎症在其中起到了重要的作用。通过了解其病理生理过程的详细机制,可以为IPF 的临床治疗提供更加完善的方案。目前,已经探索了一些治疗肺纤维化的药物,如吡非尼酮和尼达尼布[2],但并没有显著提高患者的生存率。肺移植是目前治疗PF 的有效方法,但排斥反应、并发症和高治疗费用限制了其临床应用。因此,急需开发新的高效抗肺纤维化药物。
大麻二酚(cannabidiol, CBD)是大麻植物的非精神活性衍生物,因其抗焦虑、止吐、抗炎和抗癌特性而被重视[3]。CBD 作为一种强大的抗氧化剂,作用于各种受体部位,包括PPARγ[4],5-HT1[5],腺苷A2A[6]和瞬时电位(TRP)通道受体[7],直接或间接引起广泛的抗炎和免疫调节作用[8]。之前的研究表明,CBD 能够减少慢性哮喘动物模型中相关细胞因子的产生[9]。最近,已经明确了CBD 参与调控炎症反应,包括炎症性肺部疾病,并对急性和慢性炎症具有积极作用[10-12]。此外,CBD 耐受性良好,没有明显的副作用,它也可能是肺纤维化治疗的有效候选者。然而,关于CBD 治疗IPF 的药理活性和机制的研究很少。因此,本研究旨在探讨CBD 对博来霉素(BLM)诱导的肺纤维化的作用,并探讨其机制。
1 材料与方法
1.1 实验动物
取SPF 级SD 雄性 大 鼠60 只,体 质量(190±20) g,购自黑龙江中医药大学实验动物中心,批号:SCXK(黑)2018-003,适应性饲养7 d 后,活动、粪便均未见明显异常方可进入实验阶段。本实验所有相关操作均遵守SPF 级实验室规定及要求,并在黑龙江中医药大学实验动物伦理委员会批准下进行。
1.2 药物及主要试剂
CBD 购自西安绿如泉生物科技有限公司(批号:LRQ221103-1); TNF-α(ml002859)、IL-1β(ml037361)、IL-6(ml064292)的ELISA 检测试剂盒购自上海酶联生物科技有限公司;博来霉素(批号:Z8020)购自索莱宝生物科技有限公司,醋酸泼尼松片(批号:LA22255)购自浙江仙琚制药股份有限公司。
1.3 主要仪器
M200pro 型酶标仪(瑞 士Tecan 公司);Myi QTM Optics Module 单色Realtime PCR 检测系统(美国Bio-Rad 公司);Nikon Eclipse Ci-L 型正置白光拍照显微(日本);KQ250DE 型超声振荡器(昆山市超声仪器有限公司)。
1.4 动物模型的建立与分组
将60 只大鼠随机分为:正常对照组、模型组、泼尼松组(3.15 mg/kg)、CBD 低中高剂量组(12、36、108 mg/kg)[13],每周监测大鼠体质重和饮食量。采用气管内注射博来霉素构建肺纤维化大鼠模型。腹腔注射3%戊巴比妥钠(40 mg/kg)麻醉,剪开颈部皮肤,暴露气管,使用1 mL 注射器轻轻插入大鼠气管,并在注射器管外口放置棉絮检查其是否插入成功,快速注射博来霉素(5 mg/kg)并继续推注0.2 mL 空气,以确保药液均匀到达肺部,将大鼠皮肤缝合。造模后第2 天开始,每日1 次灌胃给药,共持续28 d。采集样本,取肺组织,称重后保存在4%的多聚甲醛溶液中或在液氮中快速冷冻,然后保存在-80 ℃。
1.5 肺脏器系数和肺组织湿/干质量(W/D)比值的测定
解剖大鼠,取出完整肺组织并吸干表面血液,称量肺质量,计算各组大鼠肺系数:脏器系数=脏器质量/体质量×100%。另称量大鼠右肺上叶的湿质量,并将其放入60 ℃烘箱中烘烤72 h 并称量其干质量,通过计算湿/干质量比值(wet/dry weight ratio)来评估肺的水分含量。
1.6 组织病理学观察
肺组织切片用苏木精和伊红(HE)、马松(Masson)染色,使用正置白光拍照显微获取组织学图像,并评估肺组织炎症和纤维化的组织学征象。
1.7 ELISA 法检测血清中TNF-α、IL-6、IL-1β 和肺组织中SOD、MDA、HYP 水平
用酶联免疫吸附法(ELISA)检测大鼠血清中TNF-α、IL-1β、IL-6 和大鼠肺组织中SOD、MDA、HYP 含量。
1.8 免疫组化法检测TGF-β1、α-SMA 的含量
将4 μm 厚肺组织切片脱蜡后,0.3%过氧化氢室温孵育10 min,然后在0.01 mol/L 的PBS 中洗涤5 min,再用5%BSA 于37 ℃封闭30 min 后,分别滴加一抗TGF-β1(1∶200)、α-SMA(1∶200)4 ℃过夜,最后用HRP 标记的山羊抗兔IgG 抗体(1∶500)孵育30 min,二氨基联苯胺显色后封片镜下观察。
1.9 qRT-PCR 荧光标记法检测TGF-β1、α-SMA、Nrf2 和NF-κB p65 mRNA 的表达
Trizol 法 提 取 总mRNA 后, 逆 转 录 成cDNA。对各大鼠肺组织内TGF-β1、α-SMA、Nrf2 和NF-κB p65 mRNA 进行PCR 扩增反应,记录Ct 值。引物由北京宝日生物技术有限公司合成提供,见表1。
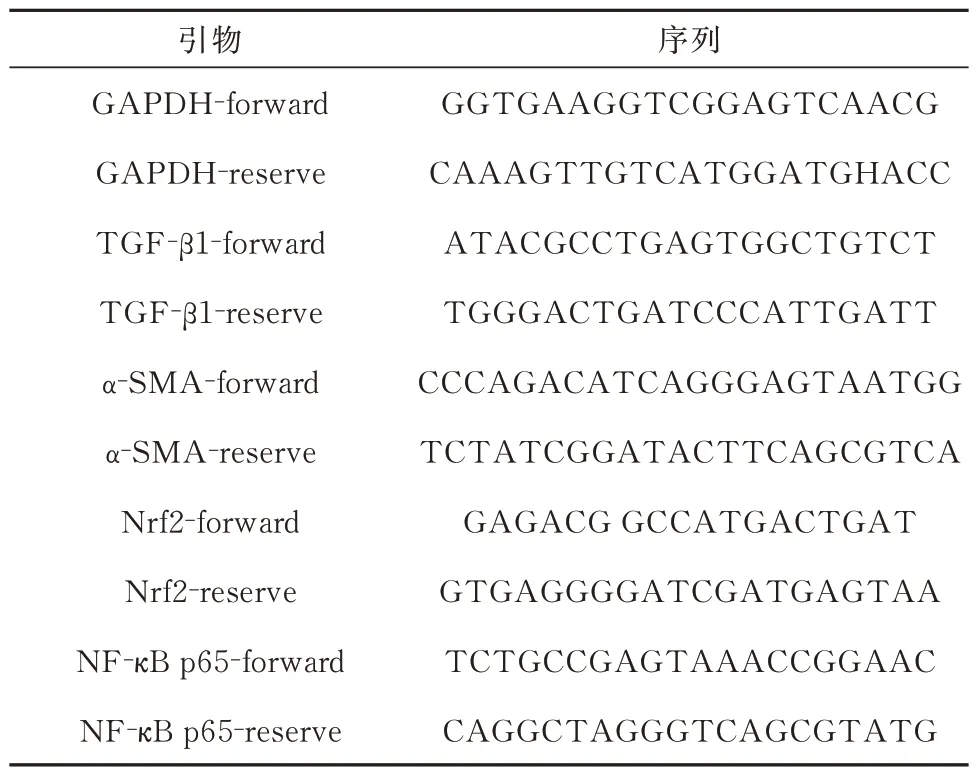
表1 引物名称及相关序列Tab 1 Primer name and related sequence
1.10 统计学处理
所有统计计算均使用GraphPahPadPrism8 进行。多组比较采用单因素方差分析。P<0.05 为差异具有统计学意义。
2 结果
2.1 一般状态观察
观察各组大鼠发现,正常对照组大鼠精神状态良好,活跃且毛色有光泽,饮水、进食及二便均正常,体质量持续正常增长。模型组大鼠精神萎靡,毛发无光泽,呼吸急促,摄食、饮水量、体重均呈下降趋势。经泼尼松和CBD 给药干预后,大鼠一般状况均有所改善,比较各组体质量发现,泼尼松组和CBD 低、中、高剂量组的大鼠体质量在7、14、21 和28 d 的结果中,均显著高于模型组(P<0.05)。结果见图1。
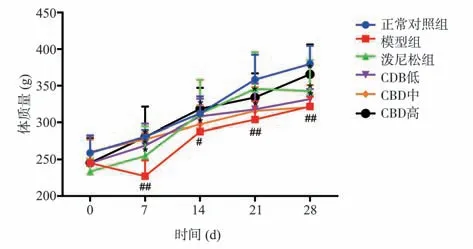
图1 CBD 对肺纤维化模型大鼠体质量的影响Fig 1 Effect of CBD on body weight of rats with pulmonary fibrosis
2.2 各组大鼠肺脏器系数及肺组织W/D 比较
模型组肺脏器系数和W/D 都显著高于正常对照组(P<0.01)。CBD 中、高剂量组肺脏器系数和W/D 值与模型组相比均明显降低(P<0.05),且呈剂量依赖性。见表2。
表2 大鼠脏器系数及W/D(n=6,±s)Tab 2 Rat organ coefficient and W/D(n=6,±s)
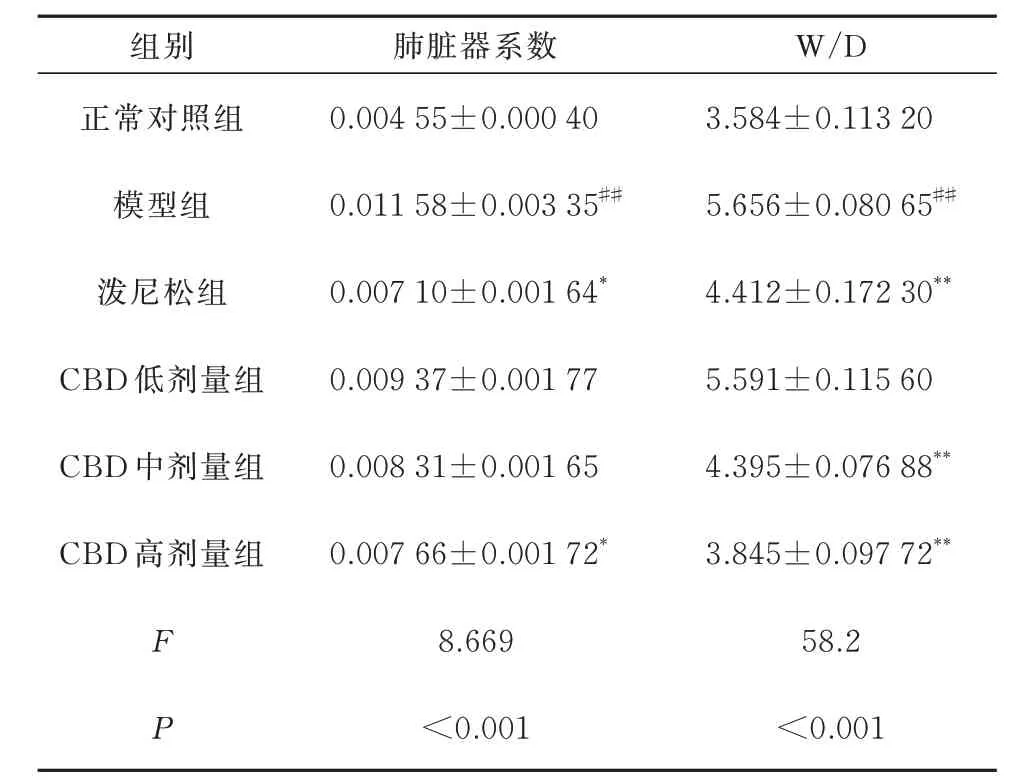
表2 大鼠脏器系数及W/D(n=6,±s)Tab 2 Rat organ coefficient and W/D(n=6,±s)
注:与正常对照组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01。
组别肺脏器系数W/D正常对照组模型组0.004 55±0.000 40 0.011 58±0.003 35##3.584±0.113 20 5.656±0.080 65##泼尼松组0.007 10±0.001 64*4.412±0.172 30**CBD 低剂量组0.009 37±0.001 77 CBD 中剂量组5.591±0.115 60 4.395±0.076 88**CBD 高剂量组0.008 31±0.001 65 0.007 66±0.001 72*3.845±0.097 72**F P 8.669 58.2<0.001<0.001
2.3 各组大鼠肺组织病理形态学比较
采用HE 染色和Masson 染色分析肺损伤和纤维化程度。与正常对照组相比, BLM 造模28 d 后,大鼠肺组织出现肺泡结构紊乱、肺泡壁异常增厚、基质大量沉积、蓝色胶原纤维数量和成纤维细胞增加。显然,CBD 和泼尼松治疗组在第28 天显著降低了BLM 诱导的肺损伤和纤维化,CBD 组与泼尼松组无显著性差异。此外,肺纤维和肺泡炎评分均显示CBD 治疗组的肺纤维化和肺泡炎症程度均较模型组显著降低(P<0.05),高剂量组好转度高于低、中剂量组,表明CBD 可改善肺纤维化大鼠的肺纤维化和肺泡炎症程度。结果见图2~4。
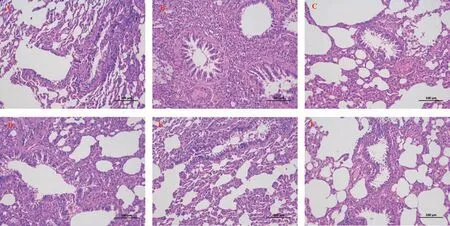
图2 大鼠肺组织病理形态学比较(HE,×200)Fig 2 Comparison of pathological morphology of rat lung tissue (HE,×200)

图3 大鼠肺组织病理形态学比较(masson,×200)Fig 3 Comparison of pathological morphology of rat lung tissue (masson,×200)
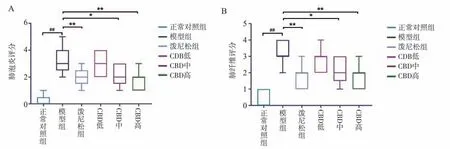
图4 大鼠肺组织纤维化及肺泡炎评分Fig 4 Rat lung tissue fibrosis and alveolitis score
2.4 各组大鼠血清中TNF-α、IL-6、IL-1β 及肺组织SOD、MDA、HYP 含量比较
与正常对照组相比,模型组大鼠血清中TNFα、IL-6 及IL-1β 含量显著升高,差异有统计学意义(P<0.01)。与模型组相比,各CBD 组大鼠血清中TNF-α、IL-6 及IL-1β 的含量均有所减少,差异有统计学意义(P<0.05),其中高剂量组大鼠血清中TNF-α 及IL-1β 减少量明显多于低、中剂量组,差异有统计学意义(P<0.01)。此外,与正常对照组相比,模型组肺组织中MDA 和HYP 含量显著升高,SOD 活性显著降低(P<0.01)。与模型组相比,CBD 给药组大鼠肺组织中MDA 和HYP 含量均有所降低(P<0.05),且CBD 高剂量组(108 mg/kg)和醋酸泼尼松组SOD、MDA 活性显著恢复(P<0.01)。各组大鼠TNF-α、IL-6、IL-1β 血清含量及肺组织SOD、MDA、HYP 含量详见表3。
表3 大鼠血清中TNF-α、IL-6、IL-1β 及肺组织SOD、MDA、HYP 含量(n=6,±s)Tab 3 TNF-α, IL-6, IL-1β in rat serum and SOD, MDA, HYP content in lung tissue(n=6,±s)

表3 大鼠血清中TNF-α、IL-6、IL-1β 及肺组织SOD、MDA、HYP 含量(n=6,±s)Tab 3 TNF-α, IL-6, IL-1β in rat serum and SOD, MDA, HYP content in lung tissue(n=6,±s)
注:与正常对照组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01。
组别HYP(mg/mL)TNF-α(pg/mL)IL-6(pg/mL)IL-1β(pg/mL)SOD(U/mg)MDA(nmol/mg)正常对照组模型组泼尼松组CBD 低剂量组CBD 中剂量组CBD 高剂量组0.023 28±0.003 953 0.074 98±0.007 945##0.051 08±0.005 191*0.059 97±0.005 372 0.044 31±0.006 288*0.043 09±0.004 024**8.81<0.001 F P 44.2±2.032 144.7±5.281##73.5±6.512**111.7±6.869*98.9±6.032**83.5±5.023**38.70<0.001 52.0±3.311 128.5±8.687##79.3±8.633**108.2±7.372 104.5±6.400*89.1± 5.559*14.47<0.001 11.08±1.481 38.19±3.481##22.42±1.853**27.19±2.975*20.99±1.567**23.11±2.060**14.08<0.001 81.5±2.553 36.5±2.930##65.3±2.033**50.2±2.220*61.5±2.762**63.5±2.018**38.57<0.001 2.266±0.115 09 4.473±0.255 07##3.149±0.195 02**4.486±0.116 01 3.616±0.228 05*3.221±0.166 01**20.83<0.001
2.5 CBD 对PF 大 鼠 肺 组 织TGF-β1 和α-SMA 表达的影响
与正常对照组相比,模型组大鼠肺组织中TGF-β1 和α-SMA 的表达明显增加,差异有统计学意义(P<0.01);与模型组相比,各CBD 组大鼠肺组织中TGF-β1 和a-SMA 的表达均减少,差异有统计学意义(P<0.05);其中CBD 高剂量组大鼠肺组织中TGF-β1 和a-SMA 减少量明显多于低、中剂量组,显示出与泼尼松组相似的效果,差异有统计学意义(P<0.01),见图5~7。
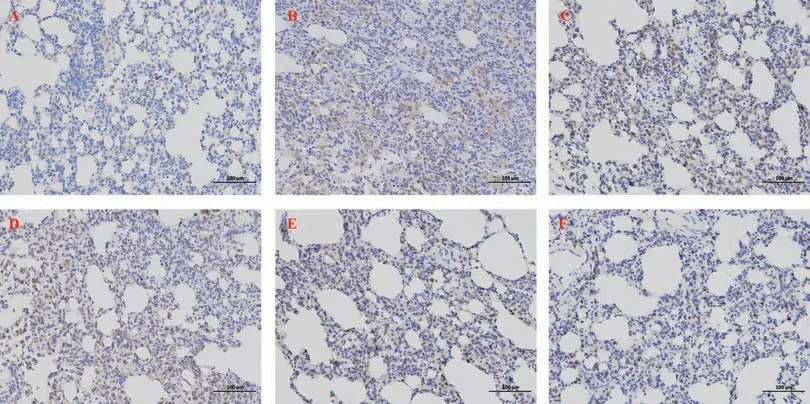
图5 肺组织TGF-β1 的表达Fig 5 Expression of TGF-β1 in lung tissue
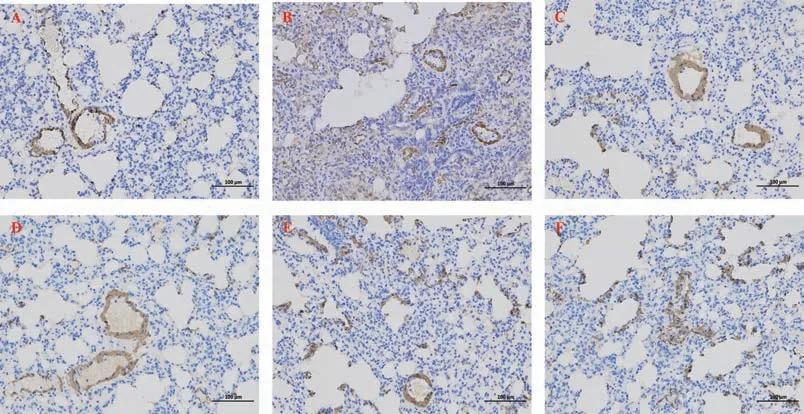
图6 肺组织α-SMA 的表达Fig 6 Expression of α-SMA in lung tissue
2.6 CBD 对PF 大鼠TGF-β1,α-SMA,Nrf2 和NFκB p65 m RNA 表达的影响
与正常对照组相比,模型组大鼠肺组织中TGF-β1,α-SMA 和NF-κB p65 mRNA 表 达 明 显 增 加,Nrf2 mRNA 表达明显降低,差异有统计学意义(P<0.01)。与模型组相比,CBD 各组大鼠肺组织中TGF-β1,α-SMA 和NF-κB p65 mRNA 的表达均有所降低,Nrf2 的表达增加,差异有统计学意义(P<0.05),其中CBD 高剂量组大鼠肺组织中TGF-β1,α-SMA mRNA 降低量明显多于低、中剂量组,差异有统计学意义(P<0.01),见图8。
3 讨论
IPF 是由遗传和环境因素或其他肺部疾病引起的进行性肺部疾病[14,15]。肺指数是反映IPF 程度的指标之一。在IPF 形成过程中,模型组大鼠的肺重由于炎症细胞浸润,细胞肿胀,毛细血管充血等多种因素而显著增加。同时,大鼠在建模后处于疾病状态,导致体重减轻。因此,模型组大鼠的肺指数显著升高。IPF 的主要特征是细胞外基质的沉积[16]。胶原纤维是细胞外基质的主要成分,羟脯氨酸(HYP)是胶原纤维的特有成分[17],所以HYP 的含量可以反映细胞外基质的含量。实验结果表明,单次气管内滴注BLM 导致大鼠肺指数和HYP 含量升高,CBD 干预后大鼠肺组织中的肺指数和HYP含量降低,表明CBD 可能对BLM 诱导的大鼠IPF具有保护作用。
肺组织的组织病理学变化是确定IPF 最直观和最重要的指标。光学显微镜下结果显示,模型组大鼠肺泡结构严重受损,肺泡隔增厚,肺泡隔内胶原纤维大量沉积,这表明我们成功地在大鼠中复制了IPF 模型。CBD 治疗后,大鼠肺泡炎症程度和IPF明显降低,提示CBD 对BLM 诱导的大鼠IPF 具有保护作用。
氧 化 应 激 是IPF 的 重 要 发 病 机 制 之 一[18,19]。Nrf2 是生物体中最重要的抗氧化因子[20]。它与抗氧化反应元素相互作用,可以上调体内各种抗氧化蛋白和Ⅱ.期解毒酶的表达,可以消除体内氧化应激产生的自由基[21]。在正常生理条件下,Nrf2 与细胞质中的Keap1 结合,无活性。当细胞受到亲电物质或活性氧攻击时,Nrf2 与Keap1 解离,Nrf2 在细胞核中被激活并与抗氧化反应元件结合,激活下游抗氧化酶蛋白的表达,起到抗氧化作用[22]。最近的研究表明,胡芦巴种子提取物糖苷[23],红景天苷[24],吡非尼酮[25]可以激活Nrf2 途径抑制氧化应激的发生,从而抑制BLM 诱导的IPF 的发展。本研究发现CBD可以通过激活Nrf2 途径增强IPF 大鼠的抗氧化能力,从而减少脂质过氧化引起的肺组织损伤。
NF-κB 是由p50 和p65 亚基组成的二聚体化合物,是一种具有广泛生物活性的多功能核转录因子,可被TNF-α、IL-6、IL-1β 等细胞因子激活,参与机体炎症、免疫反应[26]。当NF-κB 被激活时,它从细胞质转移到细胞核以诱导炎症介质的表达[27]。本实验结果表明,气管内给予BLM 后,模型组大鼠血清中的炎症细胞明显增多。CBD 可以显著降低炎症细胞数量和NF-κB p65 在肺组织中的m RNA表达,表明CBD 可以通过抑制NF-κB 途径来减少炎症因子的分泌。
肺成纤维细胞的活化是IPF 发生的关键步骤。致病因子的持续刺激导致成纤维细胞过度增殖和活化,活化的成纤维细胞变为肌成纤维细胞,从而分泌大量细胞外基质,导致细胞外基质沉积,加速IPF 的 发 展[28,29]。肌 成 纤 维 细胞在PF 的 发 生 中 起关键作用[30],α-SMA 是肌成纤维细胞的特征性标志物。TGF-β1 是引起IPF 的主要细胞因子,主要通过刺激成纤维细胞活化、诱导细胞外基质生成和抑制基质降解参与PF 的发展。结果表明,CBD 可以抑制模型组大鼠肺组织中TGF-β1 和α-SMA 的表达。
本课题组研究了CBD 对BLM 诱导的肺纤维化的影响,并阐明了其潜在机制。在本实验中可以观察到模型组大鼠肺组织中TGF-β1、α-SMA 蛋白及mRNA 表达均显著升高,且炎症通路NF-κB 的表达明显上调,Nrf2 表达明显下调,经CBD 干预后大鼠肺组织中TGF-β1、α-SMA 的mRNA 和蛋白的表达明显受到抑制,同时下调NF-κB 的表达,上调Nrf2表达,并且下游炎症细胞因子TNF-α、IL-6、IL-1β 的表达与NF-κB 通路一致,尤以高剂量CBD 改善效果最佳,证实CBD 可作用于不同途径以降低肺泡炎症和纤维化程度,为有效的治疗药物。
综 上 所 述,CBD 对BLM 诱 导 的IPF 大 鼠 具 有保护作用,其潜在机制可能与抑制炎症反应,增强抗氧化能力和抑制TGF-β1 和α-SMA 的蛋白表达有关,本研究可为CBD 在治疗肺纤维化中的作用机制提供一些新的见解。
所有作者声明不存在利益冲突关系。
