甲状腺内胸腺癌1 例病例报道*
2023-12-08胡斌涛孙荣昊张芳徐楠刘薇陈孝磊周雨秋蔡永聪
胡斌涛,孙荣昊,张芳,徐楠,刘薇,陈孝磊,周雨秋,蔡永聪
610500 成都,成都医学院 临床医学院(胡斌涛、刘薇);610041 成都,四川省肿瘤临床医学研究中心,四川省肿瘤医院·研究所,四川省癌症防治中心,电子科技大学附属肿瘤医院 甲状腺-口腔颌面外科(孙荣昊、周雨秋、蔡永聪),病理科(张芳);646000 四川 泸州,西南医科大学附属医院 耳鼻咽喉头颈外科(徐楠、陈孝磊)
甲状腺内胸腺癌(intrathyroid thymic carcinoma,ITTC), 最初于1985 年由Miyauchi 等[1]报道,将其描述为甲状腺内上皮性胸腺瘤。1991 年Chan等[2]将该肿瘤正式命名为显示胸腺样分化的癌,并指出其可能由异位的胸腺或鳃囊残余物引起,2004 年第3 版《内分泌器官肿瘤 WHO 分类》将其立为甲状腺独立的肿瘤分类,2017 年第 4 版WHO 将其更名为“甲状腺内胸腺癌”[3]。ITTC 临床罕见,诊断困难,尚缺乏标准的治疗手段。现报道1 例我院收治的ITTC,通过分析其临床病理特征及预后,增强临床医生及病理医生对该类疾病的诊治能力。
1 临床资料
患者,女,49 岁,因“体检发现甲状腺肿块10月”于 2021 年7 月5 日就诊于我院。患者10 个月前体检发现甲状腺肿块,未行特殊治疗,定期随访。于2021 年4 月9 日外院细胞学穿刺示:“甲状腺右侧叶下极多系乳头状癌”,后为求进一步手术治疗入我院头颈外科。体格检查:颈软,气管居中。颈右侧可触及约15 mm 大小肿块,质地中等,边界清楚,随吞咽上下移动;颈部未触及肿大淋巴结。彩超示:甲状腺右侧叶下极大小约12 mm×13 mm×13 mm 低回声结节,界不清,形态欠规则,呈“分叶状”,内可见点状强回声,TI-RADS分级:6 级(图1)。左侧颈部VI 区探及大小约4 mm×3 mm×3 mm 的淋巴结、右侧颈部VI 区探及大小约2 mm×2 mm×2 mm 的淋巴结,皮髓质分界欠清楚。PET-CT 示:甲状腺右侧叶下极见稍低密度结节,FDG 摄取增高,SUVmax 3.8,大小约1.1 cm×0.9 cm(图2)。颈部及锁骨上区未见肿大淋巴结,FDG 摄取未见异常。患者自诉无吞咽梗阻、呼吸困难、声音嘶哑、多饮多食、易激惹等症状。否认颈部放射史及家族史。2 月前曾因“左肺微浸润性腺癌”于我院行“肺段切除术”。完善相关术前检查,排除手术禁忌证后于2021 年7 月7 日在我院全麻下行手术治疗。术中见:甲状腺右叶质硬肿块,最大径约1.8 cm,界不清,侵犯带状肌。左叶探查未扪及确切肿块。甲状腺右叶切除行术中快速冰冻检查示:恶性肿瘤,倾向低分化癌。故行“甲状腺全切+双颈部中央区淋巴结清扫+右下旁腺移植术”。
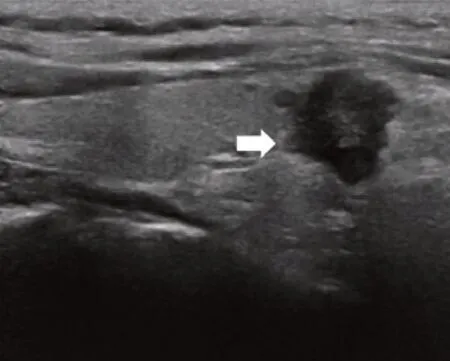
图1 患者术前甲状腺彩超图像Figure 1.Preoperative Thyroid Color Ultrasound Image
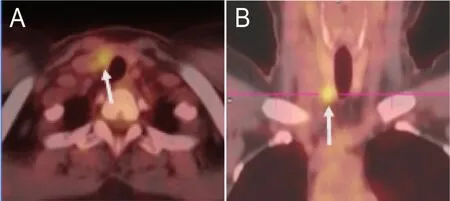
图2 患者术前PET-CT 图像Figure 2.Preoperative PET-CT Images
病理检查:(甲状腺右叶峡叶及肿块)灰红甲状腺组织1 个,大小4.5 cm×2.5 cm×1 cm,多切面切开,紧邻被膜,见一灰白结节,大小约1.8 cm×1.5 cm×1.2 cm,质中。镜下观察:送检甲状腺组织内异型细胞团巢状、合体样生长,细胞中等大小、胞浆红染,细胞核空泡状、核仁明显,部分细胞可见细胞内角化(图3A),瘤细胞合体样生长、胞界不清,背景间质中可见较多淋巴细胞浸润(图3B)。肿瘤累及甲状腺表面纤维脂肪组织及横纹肌组织。免疫组化示:瘤细 胞CK5/6(+),P63(+),P40(+)(图4A),CgA(-),Syn(+),CD56(-),降 钙 素(-),PAX-8(+),TG(-),CEA(局灶+),TTF-1(-)(图4B),CK7(灶+),CK19(+),HBME-1(灶+),Galectin-3(+),CD5(+)(图4C),CD117(+)(图4D),EBER(-),Ki67(+,约60%)。病理诊断:(甲状腺右叶峡叶)甲状腺内胸腺癌。清扫颈部淋巴结9枚未见癌转移。最终诊断为:甲状腺内胸腺癌。随访情况:术后放疗后22 个月,恢复良好,未见复发。

图3 组织病理学检查(HE 染色,×20)Figure 3.Histopathologic Results (HE Staining, ×20)
2 讨 论
ITTC 多位于甲状腺下极,超声表现为实性低回声结节,无钙化灶[4],是一种低度恶性的上皮性肿瘤,临床罕见,约占甲状腺恶性肿瘤的0.08%~0.15%[5-6]。本文病例亦发生在甲状腺下极,超声表现为实性低回声结节,但伴有钙化灶,与此前报道稍有不同[7]。
ITTC 依靠细胞学诊断较为困难,镜下组织学改变如瘤细胞核大、核仁明显、胞界不清、伴间质较多淋巴细胞浸润等特征与低分化癌极其相似,因此ITTC 术中冰冻病检时极易被误诊为低分化癌。此前赵玲等[8]报道5 例ITCC 术中均被诊断为低分化癌。本例情况相同,术中冰冻提示倾向低分化癌,待免疫组化后才诊断为ITTC。可见,术中冰冻快速病理检查呈现甲状腺低分化癌时,需警惕ITTC 的可能,必要时及时与手术主刀医生电话沟通,最终诊断待术后免疫组化进一步明确。
ITTC 免疫表型类似纵隔胸腺癌,一般呈现CK5/6、P63、P40 及CD5、CD117 弥漫阳性表达,而甲状腺上皮来源的标记物PAX-8、TTF-1、Tg 阴性表达,与EB 病毒感染无关[9],故EB 病毒原位杂交阴性表达。回顾文献发现,CD5、CD117 对于ITTC 的诊断有较高特异性[4],但需注意也有少数病例CD5 或CD117 呈现阴性[10-11]。本例免疫组化结果显示:肿瘤细胞CD5 和CD117 均呈阳性,而Tg、TTF-1 均阴性,EB 病毒原位杂交阴性,与前述报道基本相符,同时患者既往无胸腺癌病史,支持病变为ITTC,而非甲状腺上皮来源的恶性肿瘤。近年有研究显示[12],单克隆抗体PAX-8 在ITTC 不表达,而在其他甲状腺滤泡上皮起源的肿瘤(如乳头状癌、滤泡癌、鳞状细胞癌、低-未分化癌)中高表达。因此,单克隆PAX-8 十分有利于ITTC 的诊断和鉴别诊断。但此例患者PAX-8 阳性,系所用抗体为多克隆抗体缘故。另外Kojika 等[13]报道,葡萄糖转运蛋白1(glucose transporter 1,GLUT-1)在纵隔胸腺癌中有很高的敏感性和特异性,这也提示我们GLUT-1 有可能成为诊断ITTC 新的特异性免疫标志物。
ITTC 具有惰性生物学行为,患者一般预后较好。此前有报道[10]称5 年和10 年生存率分别为90%和82%。由于ITTC 发病率极低,现有的文献报道数据并不丰富。学术界对于是否术后放化疗尚存在争议。Roka 等[14]在回顾22 例病例后发现该肿瘤对放疗较为敏感,术后接受放疗的患者局部复发率极低,放疗对复发的肿瘤治疗上也有明显效果。Gao 等[11]回顾89 例病例后认为放疗可显著提高患者的生存率,特别是在无淋巴结转移的病例中更为明显,同时该研究提出腺体外侵犯和淋巴结转移是ITTC 复发的重要危险因素。但是,Ge 等[4]系统分析了82 例ITTC 术后接受放疗病例后,提出淋巴结转移与复发无关,术后放疗并没有减少复发概率。对于化疗的报道[15],资料有限,疗效暂不确定。本例患者术中见肿瘤组织向外侵犯带状肌,存在复发风险可能。再者考虑到患者为早期肺腺癌术后病人,经多学科团队(multidisciplinary team,MDT)会诊后予以放疗。未来仍需进一步研究证实术后放、化疗对ITTC 患者预后的影响。
综上,ITTC 是一种发病率极低且恶性程度低的甲状腺癌,其诊断有一定难度,通常需要借助免疫组化CD5、CD117 等染色来辅助诊断。目前手术治疗仍为ITTC 首要治疗方式,术后是否放化疗需结合病变范围以及淋巴结转移情况[11],同时也要考虑患者自身基础疾病情况。在面对双重癌以及罕见病例的诊治过程中,要利用好MDT 模式,经讨论之后一同制定方案。MDT 模式[16]可最大限度地发挥各学科专长、加强学科协作,对于肿瘤病人的规范化、个体化治疗具非常重要的意义。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
