红皮红肉火龙果组培快繁技术研究
2023-12-08陈华蕊何书强李洪立党志国冯振翠杨子琴陈业渊
陈华蕊,何书强,李洪立,党志国,朱 敏,冯振翠,杨子琴,陈业渊
(1 中国热带农业科学院热带作物品种资源研究所,海口,571101;2 中国热带农业科学院三亚研究院,海南三亚,572025)
火龙果是仙人掌科(Cactaceae)量天尺属(Hylocereusundatus)肉茎植物,是一种原产于哥伦比亚等中美洲的热带沙漠地区的热带水果,也是我国南方地区重要的特色精品水果之一,已被许多热带亚热带地区作为特色水果产业发展,同时取得显著的经济效益和社会效益[1-2]。我国海南、广西、广东、台湾等地近十年来也对火龙果进行了广泛商业化种植。火龙果果实营养丰富、功能独特,含有丰富的维生素和水溶性膳食纤维,特别是红皮红肉型火龙果富含花青素、甜菜苷等天然色素,以及丰富的B族维生素、水溶性膳食纤维和植物白蛋白,具有防癌、抗氧化、增强免疫力等多种功效[3]。因此该类型的火龙果深受国内外种植者和消费者的欢迎。
“金都一号”火龙果是2015年中国热带农业科学院热带作物品种资源研究所从台湾引进的红皮红肉型品种,该品种外观鲜艳、高糖低酸、品质优良,深受消费者的喜爱。目前该品种在海南、广东、广西、云南、贵州等地大面积种植,种苗需求量大。
红皮红肉火龙果在生产上主要采用种子、扦插和嫁接等繁殖方式育苗[4-6],种子育苗发展速度较慢,且容易变异[1]。扦插育苗繁殖速度慢并且会影响母株的长势,很难在短时间内满足种苗生产需求。采用离体快繁技术繁殖种苗,能够保证火龙果优良性状得到稳定遗传,缩短植株的繁殖周期且在短期内获取大量的种苗数量。本研究以红皮红肉火龙果带剌座的幼嫩茎段为外植体,探索火龙果组培快繁体系,为其高效栽培繁殖奠定基础。
1 材料与方法
1.1 试验材料
供试材料为金都一号红皮红肉火龙果,取自中国热带农业科学院热带作物品种资源研究所火龙果种质圃。
1.2 试验方法
1.2.1 外植体消毒 从生长健壮的火龙果的植株上切取幼嫩的茎段,用软毛刷刷洗刺座周围的细菌灰尘,用自来水冲洗干净,再用滤纸吸干水分。用手术刀片沿着茎段棱缘纵切,切成宽为3 cm左右的棱片,再横切成5~6 cm长的小段,每段保留2~3个刺座。在无菌操作台上选用的消毒剂为75%酒精、2%次氯酸钠和0.1%升汞。将3种消毒剂和消毒时间做如表1所示的组合。
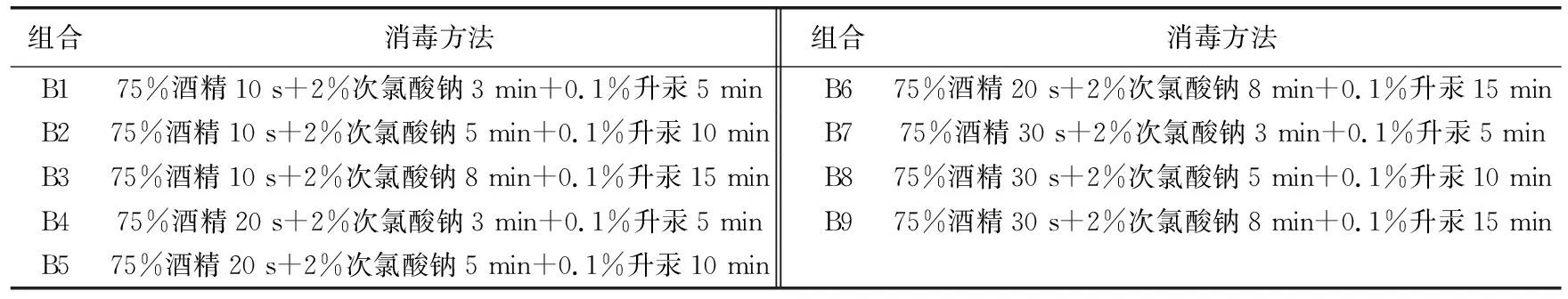
表1 对外植体表面灭菌的不同消毒方法组合
在消毒过程中充分搅拌外植体,使其充分接触消毒液,提高消毒效果。每种消毒剂灭菌后用无菌水冲洗3次,每次3 min,将灭菌后的茎段切成2~3 cm长的茎段,每个茎段携带1~2个刺座,接种在无生长调节剂添加的MS培养基上预培养,每个处理接种15瓶,每瓶2个外植体,重复3次。观察并统计茎段污染率和褐化率。培养条件:温度(25±2) ℃,光强2 000~2 500 LX,光照时间12 h/d。
1.2.2 不定芽的诱导 将预培养后的无污染的火龙果茎段平放(保持刺座向上)接种于以MS为基本培养基,添加6-BA(1.0、3.0、5.0、7.0 mg/L)和NAA(0.1、0.2和0.5 mg/L)的不定芽诱导培养基上。每个处理接种30瓶,每瓶接种1个茎段,3次重复,接种培养40 d,统计不定芽萌发数和不定芽生长状况,筛选出最适不定芽诱导的培养基。培养室温度为(25±2)℃,每天光照12 h,光照强度为1 500~2 000 LX。
1.2.3 不定芽的增殖与分化 待诱导的不定芽生长至2~3 cm时,从芽基部约3 mm处切下,切除多余的愈伤组织,转接于分化增殖培养基上,以MS为基本培养基,琼脂为8.5 g/L,蔗糖30 g/L,添加不同浓度的6-BA、NAA的增殖培养基上,pH值为5.8。6-BA浓度为2.0、4.0、6.0、8.0 mg/L共4个水平,NAA浓度为0.1、0.2、0.3 mg/L共3个水平,合计12个处理。每个处理接种15瓶,每瓶接种2株不定芽,每个处理设3个重复。接种20 d后统计不定芽增殖数,统计分析增殖系数。增殖系数=不定芽萌生数/接种不定芽数[2]。
1.2.4 生根培养基的筛选 当增殖芽长至3~4 cm左右时,转入生根培养基上进行生根培养,以MS为基本培养基,附加蔗糖30 g/L,琼脂8.5 g/L,IBA浓度为0.2、0.4、0.6 mg/L3个水平,NAA浓度为0.1、0.2、0.3 mg/L3个水平,每个处理接种10瓶,每瓶接种3株,3次重复。接种20天后开始定期观察记录生根情况,40 d后统计生根率(生根芽苗数/接种芽苗数×100%)、平均生根数,并观察生根苗长势。
1.2.5 组培苗的移栽 当生根苗高6~8 cm、根长至4~6条时,将其进行炼苗移栽。具体方法为:先将组培瓶的瓶盖打开,置于(25±2) ℃条件的温室大棚中进行炼苗,4 d后洗净苗根上残留的培养基,将其移植于经过多菌灵消毒的珍珠岩、蛭石、有机土、红土、河砂等混合基质中。设计5个处理组合:K1,珍珠岩∶有机土=1∶1;K2,河砂∶有机土=1∶1;K3,红土∶蛭石∶有机土=1∶1∶2;K4,河砂∶蛭石∶有机土=1∶1∶2;K5,珍珠岩∶蛭石∶有机土=1∶1∶2,每种处理组合种植20株苗,重复3次,置于自然环境条件下培养。移栽30 d后统计组培苗成活率及其生长状况。
1.2.6 数据统计分析 采用SPSS 18.0软件对试验数据进行统计分析。
2 结果与分析
2.1 不同组合消毒方法对外植体的影响
不同组合消毒方法对外植体的影响结果见表2,各处理的污染率为10%~62.22%,差异较大,差异达到极显著水平(p<0.01),其中组合B5、B6、B9污染率都在10%以下,显著低于其他组合,三者之间差异不显著,污染率较高的是组合B1、B4和B7,分别为62.20%、55.56%和50%,灭菌效果较差。褐死率方面,组合B3、B6和B9褐死率显著高于其他组合,褐死率达到36.67%、35.56%、38.89%,组合B2和B5成活率最高,分别为62.22%、73.33%,经方差分析成活率显著高于其他组合,组合B1的存活率最低,仅为27.78%。

表2 不同组合消毒方法对火龙果消毒效果的影响
本研究结果表明,0.1%升汞浸泡5 min均不能达到较理想的灭菌效果,但0.1%升汞消毒15 min茎段褐死增多,因此应选择3种消毒剂的合理搭配才能达到最佳的灭菌效果。
综合考虑污染率较低且成活率高的组合B5作为金都1号火龙果茎段消毒的最适宜的方法:75%酒精消毒20 s+2%次氯酸钠5 min+0.1%升汞10 min。
2.2 不同生长调节剂组合对不定芽诱导的影响
将初代培养后获得的无菌火龙果茎段接种于细胞分裂素和生长素组合的MS培养基中,接种15天后,外植体膨大,部分切口处会长出少量白色的愈伤组织,刺座周围芽生长点开始膨大芽萌动,这时如基部诱导出愈伤组织过多,应及时切除多余的愈伤组织并转瓶。培养40 d后不定芽发芽情况如表3所示。

表3 不同生长调节剂组合对火龙果不定芽诱导的影响
不同生长调节剂组合均能诱导不定芽的产生并存在显著差异(p<0.05),当6-BA浓度为1.0 mg/L与NAA组合时,外植体不定芽的诱导率较低,诱导率在30%以下;当6-BA浓度为3.0、5.0、7.0 mg/L与NAA组合时,外植体不定芽的诱导率较高,可达到51.11%~83.33%。在合适的浓度范围内,6-BA浓度相同,NAA浓度降低,或者当NAA浓度相同的情况下,随着6-BA浓度的增加,不定芽诱导率都呈增加的趋势。综上所述,不同浓度6-BA和NAA生长调节剂组合对不定芽诱导的影响不同,其中以MS+6-BA 3.0 mg/L+NAA 0.2 mg/L的培养基不定芽诱导效果最好,不定芽诱导率可达83.33%。
2.3 不同生长调节剂组合对不定芽的增殖与分化的影响
不同生长调节剂组合对不定芽的增殖与分化的影响见表4,接种20 d后,所有组合均能诱导不定芽增殖。芽的繁殖系数随6-BA质量浓度的增加而增加,当6-BA质量浓度为8 mg/L时,不定芽的繁殖系数达到6.5,显著高于其他组合(p<0.05),但不定芽长势弱、细小、黄绿色,有褐化苗出现。当6-BA质量浓度相同,NAA质量浓度提高时,不定芽繁殖系数则下降,气生根增多。当6-BA质量浓度为2 mg/L,NAA质量浓度为0.1~0.3 mg/L时,不定芽的增殖系数偏低,芽分枝少,芽壮,长势好。6-BA质量浓度为4~6 mol/L时苗分枝多,增殖系数显著大于其他组合。因此在继代培养中,可根据生产的需求在MS+6-BA 6.0 mg/L+NAA 0.1 mg/L中快速增殖,再转入MS+6-BA2.0 mg/L+NAA 0.1 mg/L进行壮苗,这样可以实现短时间内快速繁殖健壮芽苗又能减少褐化苗的目的。

表4 不同生长调节剂组合对火龙果芽增殖与生长的影响
2.4 不同生长调节剂组合对不定芽生根的影响
不同生长调节剂组合对不定芽生根的影响见表5,火龙果再生不定芽接种20天后有根系的生成,不同组合间生根率和平均生根数均存在极显著差异(p<0.01)。生根率和平均生根数随着IBA浓度的增加而增加,不定芽苗在以上培养基中均能诱导出根,随着IBA质量浓度的升高,苗生根率、平均生根数极显著地提高,从41.11%上升至100%,平均生根数从2.75条根增加为6.83条,不定芽和根的长势明显提高。生根率和平均生根数随着NAA质量浓度的升高而增加。综合生根率、生根苗长势等方面,IBA 0.6 mg/L+NAA 0.2 mg/L诱导火龙果生根的效果最好,是生根诱导的最佳生长调节剂组合。
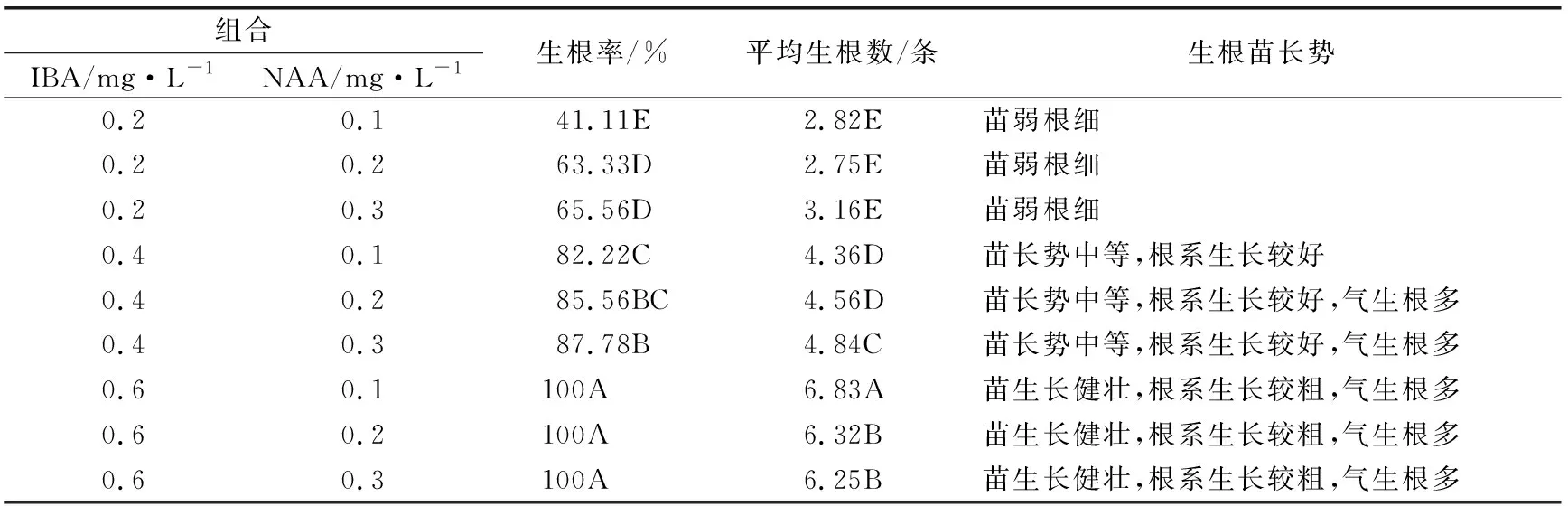
表5 不同生长调节剂组合对火龙果不定芽生根的影响
2.5 不同基质配比对组培苗移栽成活的影响
将生长良好的试管苗炼苗4天后,转移至温室大棚内种植,在不同组合的基质上定植,定期浇水,移栽40 d后试管苗成活率及其生长状况见表6。不同基质配比对试管苗成活率和根系生长差异较大(p<0.05),其中,K4处理和K5处理的成活率最高,达到100%,试管苗生长健壮,根系粗,须根多,而K2处理成活率较低,仅为80%。

表6 不同基质配比对火龙果组培苗移栽成活率及生长的影响
3 结果与讨论
外植体的消毒是组织培养能否成功的关键环节,组培污染、褐化严重均会影响到组培的成功率。火龙果的污染主要出现在刺座周围,由于刺座部位有小刺和绒毛的存在,容易滋生较多的细菌,虽然用毛刷刷洗,但很难彻底清洗干净,消毒剂也较难渗入,因此容易因消毒不彻底而造成污染[7-8]。本实验发现在利用75%酒精、2%次氯酸钠、0.1%升汞组合消毒过程中发现茎段的褐化率随着消毒时间的增加而增加,而污染率则随着消毒时间增加而显著下降。本实验的污染主要集中在刺座部位,刺座部位有丛生的叶刺和小绒毛的存在,不容易消毒,本实验曾尝试切掉刺座,减少污染率,但是发现去除刺座虽然能降低污染率,但是容易使裸露的芽点受到消毒液的伤害,导致茎段不能快速直接诱导成芽,因此认为保留茎段上的刺座更有利于火龙果不定芽的诱导,提高组织培养的效率。这与前人的研究结果相一致[17]。本实验中采用的消毒方式为:75%酒精消毒20 s+无菌水冲洗3次+再用2%次氯酸钠消毒5 min+无菌水冲洗3次,最后0.1%升汞消毒10 min,无菌水冲洗3次,污染率为11%,成活率为73%,消毒效果比较好。
在火龙果组培快繁的过程中,不定芽的诱导增殖分化及生根培养中,植物生长调节剂的种类和浓度是关键因素。不合理的植物生长调节剂的种类及配比浓度都得不到预期的繁殖系数,甚至会导致组培苗畸形、褐化等,甚至还会起到抑制作用[2,9]。本研究开展的火龙果不定芽诱导和增殖培养过程中,发现不同浓度的细胞分裂素和生长素的配比对芽的诱导和增殖的效果差异显著。6-BA 1~7 mg/L和NAA 0.1~0.5 mg/L合理的配比均能诱导出不定芽,这与国内许多学者的研究观点相一致[10-11]。但也有研究认为利用其他类型的植物生长调节剂对不同品种或者同一品种不同类型的外植体的不定芽的诱导,也能达到较好的诱导效果。如彭绿春等[12]选用TDZ、NAA的组合配比诱导不定芽,诱导率达到80%;彭思维[13]等利用MS+2,4-D 1.0 mg/L+TDZ 0.4 mg/L+NAA 0.5 mg/L能诱导火龙果分化出不定芽。刘洪章等[14]认为在MS培养基中添加6-BA、IAA能成功诱导出不定芽,也有研究认为ZT和IBA的合理组合对不定芽的诱导有显著的效果[15]。杨红超[16]等研究发现添加2,4-D诱导火龙果丛生芽效果最好。因此,不同的品种、外植体的类型、取材时间等都需要通过具体的实验来筛选最合适的植物生长调节剂种类和配比。研究还发现在继代培养中,不同的6-BA和NAA的浓度配比对芽苗萌发和壮苗有显著的效果,可根据生产的需求合理添加6-BA和NAA的浓度配比,这样可以实现短时间内快速繁殖健壮芽苗又能减少褐化苗。
本试验获得的组培苗生根效果较好,生根率达到100%,但要注意组培苗移栽后必须保持土质疏松透气,排水良好,过多的水分容易造成烂根。采用珍珠岩∶蛭石∶有机土体积比1∶1∶2的配比作为组培苗的移栽基质,移栽成活率达到100%。
火龙果是我国新型的水果品种,对其开展组织快繁技术研究具有非常重要的意义。组培快繁的技术关键是培养基配方,在本试验中通过对火龙果的不定芽的诱导、增殖分化及生根培养基的筛选,获得了适于其组培快繁的培养基配方。本试验结果显示,火龙果快繁最佳诱导培养基分别为:MS+6-BA3.0 mg/L+NAA 0.2 mg/L;增殖分化培养基为MS+6-BA 6.0 mg/L+NAA 0.1 mg/L;壮苗培养基为:MS+6-BA 2.0 mg/L+NAA 0.1 mg/L,生根培养基MS+IBA 0.6 mg/L+NAA 0.2 mg/L。
