十味板蓝根颗粒质量标准研究探讨
2023-12-07贾奕扬李燕思
鲁 毅 刘 梅 段 靖 贾 琳 贾奕扬 李燕思
中国人民解放军东部战区空军医院药剂科,南京 210002
十味板蓝根颗粒为东部战区空军医院自制制剂,2003年经南京军区联勤部卫生部批准为非标准制剂,2017年再次取得军队医疗机构制剂批准文号:总制字(2017)F516007。该制剂由板蓝根、大青叶、金银花、连翘等十味中药材组成,其功能主治为疏风、发汗解表、清热解毒利咽[1];用于感冒引起的发热、恶寒、头痛、流涕、咽痛等症[2],其制剂可能与其抗病毒活性紧密相关[3]。为了提高该制剂的质量标准,本文采用薄层色谱法对(R,S)-告依春、大青叶、黄芩、防风进行定性鉴别,按颗粒制剂通则进行检查,采用高效液相色谱法测定对(R,S)-告依春进行含量测定,完善了十味板蓝根颗粒的质量标准,对保证其质量具有重要意义。
1 仪器与试药
1.1 仪器 Agilent 1260 高效液相色谱仪(安捷伦公司)、UV-1700紫外分光光度计(日本岛津公司)、CPA225D型电子分析天平(德国赛多利斯公司)、超声波清洗器、硅胶G薄层板(青岛海洋化工厂分厂)
1.2 试药 十味板蓝根颗粒(规格:15 g/袋,东部战区空军医院,批号190331、190401、190402),(R,S)-告依春对照品(批号111753-201204)、靛玉红对照品(批号110117-200204)、黄芩苷对照品(批号110715-201318)、防风对照品(批号120947-201409)、除阴性对照品由东部战区空军医院自制外,其余对照品均购自中国生物制品研究所。甲醇为色谱纯,其它试剂为分析纯。
2 方法与结果
2.1 薄层色谱鉴别
2.1.1 十味板蓝根颗粒(R,S)-告伊春鉴别 取十味板蓝根颗粒1 g,研细,加80%甲醇20 mL,超声处理30 min,滤过,滤液蒸干,残渣加甲醇1 mL使溶解,制备供试品溶液[4];同法制备去板蓝根的阴性对照品溶液;另取(R,S)-告伊春对照品,加甲醇制成每1 mL含0.5 mg的溶液,制备对照品溶液。参照《中国药典》2020版薄层色谱法(第四部通则0502)[4]59试验,吸取供试品溶液10 μL、对照品溶液各5 μL,分别点于同一硅胶G薄层板上,以石油醚(60~90 ℃)-乙酸乙酯(1∶1)作为展开剂,展开,取出,晾干,置紫外灯(254 nm)下检视。供试品谱图与对照药品谱图在相应位置上显相同颜色的斑点。如图1所示。
2.1.2 十味板蓝根颗粒黄芩苷鉴别 取十味板蓝根颗粒20 g,加乙酸乙酯-甲醇(3∶1)的混合溶液50 mL,加热回流30min,放冷,滤过,滤液蒸干,残渣加甲醇15 mL使溶解,取上清液作为供试品溶液;同法制备黄芩对照药材溶液和去黄芩苷的阴性对照品溶液;另取黄芩苷对照品,加甲醇制成每1 mL含1 mg的溶液,制备黄芩苷对照品溶液,参照《中国药典》2020版薄层色谱法(第四部通则0502)[4]59,吸取上述供试品溶液,对照药材溶液各4 μL及上述对照品溶液2,分别点于同一硅胶G薄层板上,以乙酸乙酯-丙酮-甲酸-水(5∶3∶1∶1)为展开剂,预饱和30 min,展开,取出,晾干,喷以5%三氯化铁乙醇溶液显色。供试品谱图与对照药材谱图在相应的位置上,显相同颜色的斑点;在与对照品谱图相应的位置上,显3个相同的暗色斑点。如图2所示。

1:黄芩苷对照品;2:黄芩对照药材;3:供试品(190401);4:阴性对照
2.1.3 十味板蓝根颗粒防风鉴别 取十味板蓝根颗粒20 g,研细后加丙酮50 mL,超声处理20 min,滤过,滤液蒸干,残渣加乙醇1 mL使溶解,制备供试品溶液;同法制备去防风的阴性对照品溶液;另取防风对照药材1 g,加丙酮20 mL,同法制成防风对照药材溶液;参照《中国药典》2020版薄层色谱法(第四部通则0502)[4]59试验,吸取供试品溶液20 μL、对照药材10 μL,分别点于同一硅胶GF254薄层板上,以三氯甲烷-甲醇(4∶1)为展开剂,展开两次,取出,晾干,置紫外光灯(254 nm)下检视。供试品谱图与对照药材谱图相应的位置上,显相同颜色的斑点。如图3所示。
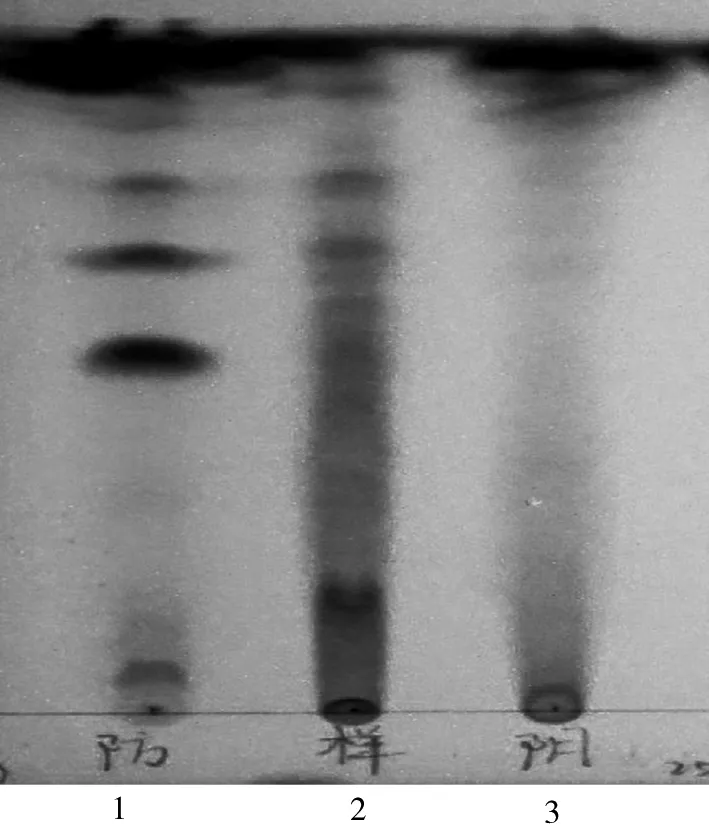
1.防风对照药材;2.供试品(190401);3.阴性对照
2.2 检查
2.2.1 粒度的测定 除另有规定外,照粒度测定法,双筛分法[4]146测定,3批次十味板兰根颗粒检查不能通过一号筛与可以通过五号筛的总和不超过15%,均符合规定。
2.2.2 水分的测定 照水分测定法,照《中国药典》2020版四部通则0832(烘干法)[4]114-115测定:3批次十味板兰根颗粒水分检查结果均不超过8%,符合规定。
2.2.3 溶化性的测定 取供试品10 g,加热水200 mL,搅拌5 min,立即观察,3批次十味板兰根颗粒全部溶化,有轻微浑浊,符合规定。
2.2.4 装量差异的测定 照《中国药典》2020版四部通则0104颗粒剂项下“装量差异”检查法[4]6-7测定。取每批次十味板蓝根供试品10袋,共30袋。分别称定每袋内容物的重量,与标示装量相比较,装量差异限度在标示装量的±5%以内,超出装量差异限度的不得多于2袋,并不得有1袋超出限度1倍[4],3批次十味板兰根颗粒检查结果均符合规定。
2.3 含量测定
2.3.1 色谱条件 色谱柱:InertSustain C18柱(5 μm,4.6 mm×250 mm);流动相:甲醇-0.02%磷酸溶液(5∶95,V/V);检测波长:245 nm;流速:1.0 mL·min-1;柱温:30 ℃;进样量:10 μL;在该条件下,理论塔板数按(R,S)-告依春峰计算应不低于5000。
2.3.2 溶液的配制 对照品溶液的制备:取(R,S)-告依春对照品适量,精密称定,加甲醇制成每1 mL含40 μg的溶液。供试品溶液的制备:取十味板蓝根颗粒约15 g,精密称定,置圆底瓶中,精密加入甲醇溶液100 mL,称定质量,回流提取1 h,放冷,称重,用甲醇溶液补足减失的质量,摇匀,滤过,取续滤液。阴性对照溶液的制备:依据十味板蓝根颗粒配方比例,制备缺板蓝根药材的阴性对照样品,按“供试品溶液制备”项下操作,制成阴性对照溶液[6]。
2.3.3 专属性试验 按以上色谱条件分别取(R,S)-告依春对照品溶液、十味板蓝根颗粒供试品溶液、缺板蓝根阴性对照溶液10 μL进样,阴性对照色谱中,在(R,S)-告依春相应的出峰时间处无干扰峰出现。如图4所示。

A
2.3.4 线性关系考察 精密吸取已配制好的(R,S)-告依春对照品溶液1 mL、2 mL、4 mL、8 mL、10 mL,置10 mL容量瓶中,加甲醇稀释至刻度。精密称取上述溶液各10 μL,注入液相色谱仪,按2.3.1项下规定色谱条件测定(R,S)-告依春峰面积,以对照品进样量(X,μg)为横坐标,对应的峰面积(Y)为纵坐标,绘制标准曲线,计算得回归方程为:Y=3590X-15.03(r=0.999,n=5)。结果表明,(R,S)-告依春质量在0.040~0.400 μg范围内与其峰面积呈良好的线性关系。
2.3.5 精密度试验 分别精密吸取5份(R,S)-告依春对照品溶液各10 μL,按2.3.1项下色谱条件测量峰面积,结果RSD为0.20%(n=5),表明仪器精密度良好。
2.3.6 稳定性试验 取十味板蓝根颗粒(批号:190401)适量制备供试品溶液,在室温条件下静置,于0 h、2 h、4 h、6 h、8 h、12 h时,分别测定(R,S)-告依春含量。结果,(R,S)-告依春峰面积的RSD为1.20%,表明供试品溶液在12 h内稳定性良好。
2.3.7 重复性试验 精密称取取十味板蓝根颗粒(批号:190401)6份,按2.3.2项方法制备供试品溶液,2.3.1项色谱条件进样测定(R,S)-告伊春峰面积。结果,峰面积平均值为296.43027,RSD为0.60%(n=6),表明以上方法重复性良好。
2.3.8 加样回收率试验 精密称取6份已知(R,S)-告依春含量的十味板蓝根颗粒供试品(批号:190401;含量:0.791 mg),每份均加入精密量取的(R,S)-告依春对照品0.979 mg,按2.3.2项下方法制备供试品溶液,按2.3.1项下方法检测峰面积,计算回收率。结果见表1。
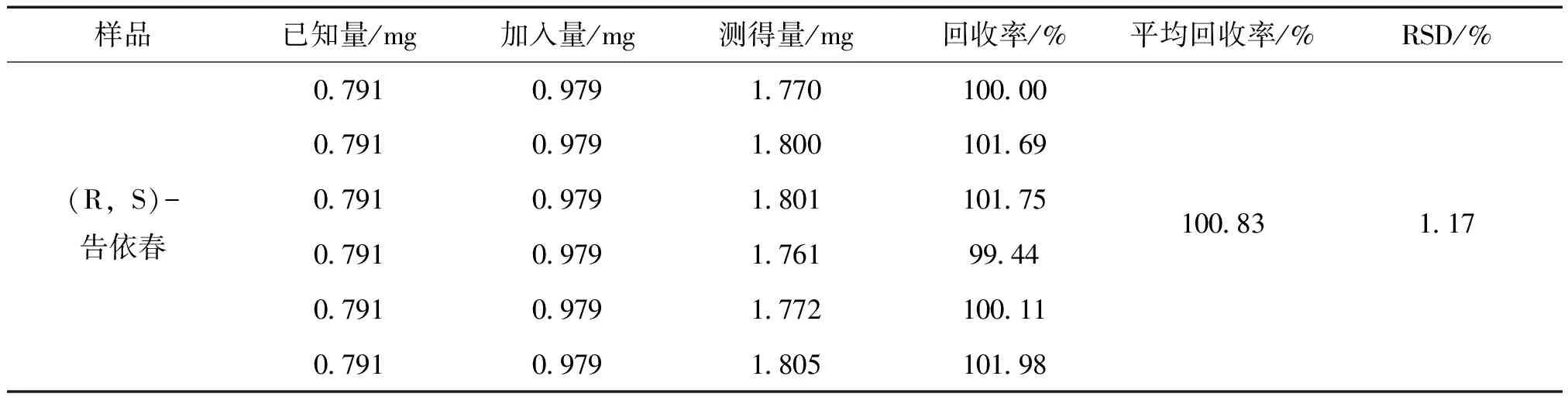
表1 加样回收率试验结果 (n=6)
2.3.9 供试品含量测定 按2.3.2项下方法制备十味板蓝根颗粒供试品溶液,按2.3.1 项下色谱条件,分别测定3批十味板蓝根颗粒供试品(批号190331、190401、190402)的(R,S)-告依春平均含量,测得平均值为0.78 mg。见表2。

表2 供试品含量测定结果 (mg/袋)
3 讨论
十味板蓝根颗粒由十味中药组成,成分复杂,其中板蓝根味苦、寒,归心、胃经;功效为清热解毒,凉血利咽,为方中君药[3];近年来越来越多的研究[7-10]表明板蓝根具有抗内毒素、免疫调节、抗菌消炎、耐缺氧及抗疲劳等药理作用。(R,S)-告依春(C5H7NOS)作为板蓝根中的主要抗病毒成分,2020年版《中国药典》中采用HPLC法测定板蓝根中(R,S)-告依春的含量对其进行质量控制[4],国内外一些文献[11-15]中也收载了类似的定性定量分析方法,故笔者选择(R,S)-告伊春作为十味板蓝根颗粒的质量控制含量测定指标。
本实验建立了十味板蓝根颗粒中(R,S)-告依春、黄芩、防风的薄层色谱鉴定方法,以及(R,S)-告依春的高效液相色谱定量测定方法。方法稳定、可靠、简便、重复性好,对科学、有效评价十味板蓝根颗粒的质量具有重要意义。
十味板蓝根颗粒在剂型的质量控制上应符合药典关于颗粒制剂的要求。本研究按照2020年版《中国药典》(四部)附录颗粒剂制剂通则的要求制订检查,项目包括粒度、水分、溶化性、装量差异等。实验结果表明,3批次十味板蓝根颗粒的检查结果均符合规定。
根据2020年版《中国药典》(一部)分析方法验证指导原则的要求[4]480-483,(R,S)-告伊春含量限(幅)度的制订,根据3批次十味板蓝根颗粒样品的实际测定结果,按其平均值的±20%限度。本研究测定的(R,S)-告伊春含量平均值为0.78 mg/袋,下调20%为0.62 mg,而本次实验3批次样品的(R,S)-告伊春含量均高于该量,因此初步确定十味板蓝根颗粒告伊春含量限度为0.62 mg/袋。
本实验选用甲醇、70%甲醇、水作为提取溶剂进行比较,提取方法及含量测定方法相同,甲醇作为提取溶剂含量较高,杂质峰较少,因此选择甲醇作为溶剂。提取方法采用超声提取30 min,加热回流30 min、60 min、90 min。研究中发现,加热回流60 min、90 min时,提取较完全,因此本研究选用甲醇作为提取溶剂、加热回流提取60 min。参考文献[16]选用甲醇-水(7∶93)、流速 1 mL/min 作为流动相,分离效果较差,本研究降低甲醇比例,选择甲醇-水(5∶95)作为流动相,(R,S)-告依春与其他组分可完全分离,达到较佳的结果。该法简便快捷,测定结果稳定可靠,且重现性好,为十味板蓝根颗粒质量控制提供了实验依据。
本研究初步建立了十味板蓝根颗粒的质量标准,检查项目均符合相关要求,色谱特征明显,含量测定方法操作方便,专属性强,含量限度设定合理,可用于十味板蓝根颗粒的质量控制。
