链霉菌HUZ0001产morindolestatin摇瓶发酵条件优化
2023-12-06解梦晴赵应苟王春萍田小丽张绍勇王继栋王瑞俊
解梦晴,伍 晴,赵应苟,王春萍,田小丽, 张绍勇,2,王继栋,2,王瑞俊,2
(1.湖州师范学院 生命科学学院,浙江 湖州 313000; 2.浙江省媒介生物学与病原控制重点实验室, 浙江 湖州 313000; 3.丽水市莲都区农业农村局,浙江 丽水 323000)
0 引 言

图1 Morindolestatin的结构
咔唑类生物碱是一类具有等电子结构的二苯胺分子杂环化合物,作为医药、农药化学产品的中间体被广泛应用于相关领域[1-2].天然的咔唑类生物碱主要从芸香科植物中分离得到,具有抗微生物、抗肿瘤、抗病毒等多种生物活性[3-6].除植物外,链霉菌代谢产物也是天然咔唑类生物碱的重要来源之一.自1977年具有咔唑并吲哚结构的星形孢菌素(staurosporine)被发现后[7],从链霉菌中又陆续分离得到许多天然的咔唑类生物碱[8-9].Carquinostatin A是一种从链霉菌Streptomycesexfoliatus2419-SVT2中分离出来的独特的咔唑类生物碱,它不仅具有有效的神经元细胞保护物质,还显示出自由基清除活性[10].Streptocarbazoles A是一种从海洋链霉菌中分离得到的新的吲哚咔唑类生物碱,其对人的白血病细胞株HL-60有较好的抑制作用[11].王可等经过活性追踪,从硝孢链霉菌发酵液中分离得到吲哚咔唑生物碱,其对多种害虫同时具有很强的触杀和胃毒活性[12-13].Cheng等从海绵来源的链霉菌StreptomycesdiacarniLHW51701 中分离得到 4 种新的咔唑生物碱,其化合物CCB-C对包括耐甲氧西林金黄色葡萄球菌(MRSA)在内的多种病原微生物具有抑制活性[14].因此,将链霉菌来源的咔唑生物碱作为咔唑的重要衍生物,具有极其重要的研究价值.
本课题组在前期筛选具有抗菌活性的放线菌中,发现链霉菌新种HUZ0001有较好的抗菌活性,其发酵液对金黄色葡萄球菌和白色念珠菌的生长有明显的抑制作用,并从该菌株的发酵液中分离得到一种新型的咔唑类生物碱morindolestatin(图1),经活性测试,发现该化合物对自由基诱导的脂质过氧化和自由基清除活性有一定的抑制作用[15].为进一步提高morindolestatin的发酵效价,本文以产morindolestatin的菌株Streptomycessp.HUZ0001为研究对象,对其发酵培养基和发酵条件进行优化,从而为提高morindolestatin发酵效价提供数据参考.
1 材料与方法
1.1 主要仪器与试剂
洁净工作台(力康生物医疗科技控股有限公司)、INC821C微生物培养箱(日本YAMATO公司)、ZWY-2102C型摇床(上海智诚分析仪器制造有限公司)、Aglient 1260II高效液相色谱仪(安捷伦科技有限公司)、RE-52A旋转蒸发器(上海亚荣生化仪器厂)、立式灭菌器(山东新华医疗器械股份有限公司)、电热鼓风干燥箱(上海一恒科学仪器有限公司).
Morindolestatin(95.8%,由浙江省媒介生物学与病原控制重点实验室提供)、酵母抽提物(美国BD公司)、麦芽抽提物(美国BD公司)、黄豆粉(上海源叶生物科技有限公司)、棉籽饼粉(北京鸿润宝顺科技有限公司)、色谱甲醇(色谱纯,美国天地TEDIA化学试剂公司)、水为去离子水,其余试剂(分析级)均购于国药集团化学试剂有限公司.
1.2 供试菌株
链霉菌菌株HUZ0001(菌种保藏编号为 CGMCC No.15461),保存于浙江省媒介生物学与病原控制重点实验室菌种库.
1.3 培养基
种子培养基:麦芽抽提1%、酵母抽提物0.4%、葡萄糖0.4%、CaCO30.4%、调节pH 7.2~7.4.参考相关文献报道的链霉菌发酵条件[16-18],采用的发酵培养基A~H见表1.

表1 发酵培养基配方
1.4 菌株HUZ0001发酵液的制备与处理
种子液培养:将菌株HUZ0001置于ISP2固体培养基平板上划线接种,28 ℃培养7 d;将培养好的菌株接种于种子培养基中,其装液量为50 mL/250 mL,28 ℃、180 r/min 振荡培养3 d.
发酵培养:以5%的接种量,在8种发酵培养基中接入种子液,其装液量为200 mL/1 000 mL,28 ℃、180 r/min 振荡培养7 d,得到发酵液,每种处理重复5次.
发酵液处理:在菌株的发酵液中加入2倍体积的乙醇,并用超声提取2次(30 min/次),重复3次,之后过滤收集乙醇提取液,并将乙醇提取液减压蒸至20 mL左右,再用乙酸乙酯萃取3次(20 mL/次),合并萃取液,旋蒸蒸干后溶于3 mL的甲醇中,经0.22μm微孔滤膜过滤,4 ℃ 保存备用.
1.5 发酵培养条件优化与验证
在优化发酵培养基的基础上,采用单因素试验和正交设计实验,优化摇瓶发酵参数配比[19-21].选择发酵时间、接种量、装液量、温度、转速等参数,初步确定在不同发酵参数下发酵液中morindolestatin的含量,以确定发酵条件范围.
接种量试验:设置接种量参数为2%、4%、6%、8%、10%,在28 ℃、180 r/min发酵条件下培养8 d.
转速试验:在接种量的基础上,将发酵转速分别设置为160、180、200、220、240 r/min,在28 ℃下振荡培养.
装液量试验:在接种量和转速的基础上,在1 000 mL锥形瓶中分别装入100、200、300、400、500 mL液体培养基进行发酵培养.
培养时间试验:在接种量、转速和装液量的基础上,发酵时间设置为2、4、6、8、10 d,在28 ℃下振荡培养.
发酵温度试验:在接种量、转速、装液量和发酵时间的基础上,设置温度25、28、31、34、37 ℃进行发酵培养.
根据上述单因素结果,采用正交试验,选择不同因素和水平进行发酵培养条件优化,并以优化后的培养条件进行发酵验证.
1.6 morindolestatin含量的检测
为分析在不同发酵条件下发酵培养液中morindolestatin的含量,通过高效液相色谱法,以morindolestatin标准品作为对照,配制0.05、0.1、0.2、0.4、0.8 mg/mL浓度的溶液进行液相分析,并建立标准曲线,根据样品峰面积/标准液峰面积×标准液浓度×稀释倍数计算效价(titer),其发酵含量取3次平均值.
液相色谱分析条件:固定相为Aglient XDB C18色谱柱(4.6 mm × 250 mm,5 μm);流动相为超纯水(A)和甲醇(B)的混合液,梯度洗脱(0~10 min时为90% A~70% A;10~20 min时为70% A~40% A;20~30 min时为40% A~0% A;31~40 min时为90% A),流速为1 mL/min,柱温为25 ℃,检测波长为220/254 nm,进样量为20 μL.
1.7 统计学分析
采用SPSS21.0软件进行数据统计分析,数据以平均数±标准差表示,组间比较采用t检验.
2 结果与讨论
2.1 最适发酵培养基的确定
通过高效液相色谱分析8种发酵培养基发酵后,其发酵液中morindolestatin的含量,结果表明:发酵培养基D在发酵后,其morindolestatin含量最高(图2),为1.112 2±0.007 9 mg/L,显著高于其他7种发酵培养基;G发酵培养基不产生morindolestatin.由此可以确定,D发酵培养基为链霉菌新种菌株HUZ0001产morindolestatin的最适发酵培养基.

图2 不同发酵培养基发酵液中morindolestatin的含量
2.2 单因素摇瓶发酵参数对菌株HUZ0001产morindolestatin的影响
以培养基D为发酵培养基,分别在不同接种量、转速、装液量、发酵时间、发酵温度下进行发酵,以考察其对发酵液中morindolestatin产量的影响.结果表明,不同接种量、转速、装液量、发酵时间对morindolestatin产量的影响差异较大,而发酵温度对其影响差异较小(图3).其具体表现为:在探究接种量影响的实验中,5种接种量发酵液的morindolestatin含量分别为0.204 5±0.010 4、0.795 9±0.016、0.123 2±0.007 9、0139 8±0.021 3、0.103 8±0.005 6 mg/L,其中2%~6%的接种量范围较好;在转速为180~220 r/min的发酵条件下,morindolestatin的含量在0.372 4±0.016 6~0.811 8±0.013 0 mg/L之间,在转速为220 r/min的发酵条件下,morindolestatin的含量更高;在不同装液量的发酵条件下,morindolestatin的含量随着装液量的增加先增加后减小,其中在100 mL/1 000 mL和200 mL/1 000 mL装液量的条件下,morindolestatin的含量相对较高,分别为0.816 3±0.012 5 mg/L和1.357 4±0.018 mg/L;在发酵2、4、6、8、10、12、14 d条件下,morindolestatin的含量分别为0.085 8±0.016 3、0.296 0±0.009 6、1.579 5±0.011 5、1.305 7±0.007 4、0.954 7±0.003 8、1.034 9±0.001 3、0.207 3±0.007 0 mg/L,其中培养6~8 d后,含量明显高于其他处理,而培养时间过长,目标化合物产量会减少;在不同温度下培养6 d后,morindolestatin的含量呈先增加后减少的趋势,含量分别为1.367 1±0.014 2、2.179 9±0.033 3、1.433 3±0.005 7、1.158 3±0.012 9、0.775 2±0.007 0 mg/L.在25~30 ℃发酵条件下,morindolestatin产量相对稳定,而在28 ℃发酵条件下,其产量最高.
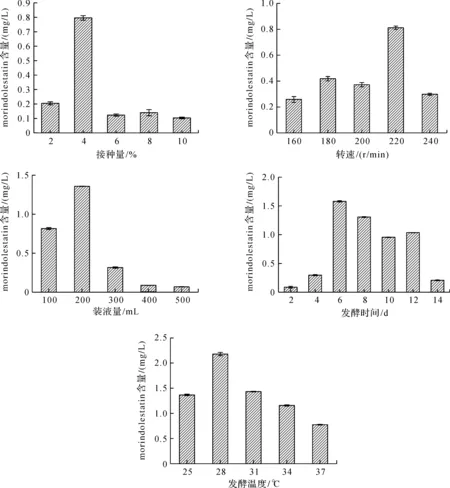
图3 不同发酵条件对化合物morindolestatin含量的影响
2.3 正交试验设计不同摇瓶发酵参数对菌株HUZ0001产morindolestatin的影响
鉴于各发酵条件间可能对菌株产morindolestatin的含量存在交互影响,因此在单因素发酵参数发酵效果的基础上,以培养基D为发酵培养基,在发酵温度28 ℃的条件下,采用4因素3水平正交表进行正交实验设计,见表2.

表2 正交设计因素水平表
根据正交设计助手软件分析和4因素3水平正交试验结果,按极差R值大小确定4因素对菌株HUZ0001产morindolestatin含量影响的主次顺序:接种量、转速、装液量、发酵时间.各因素取morindolestatin含量最高水平,从而筛选出摇瓶优化发酵条件配方为A2B2C2D1,即在培养基D为发酵培养基、发酵温度为28 ℃的条件下,最优化的发酵条件为:接种量为4%、转速为220 r/min、装液量为200 mL/1000 mL、发酵时间为6 d,具体见表3.
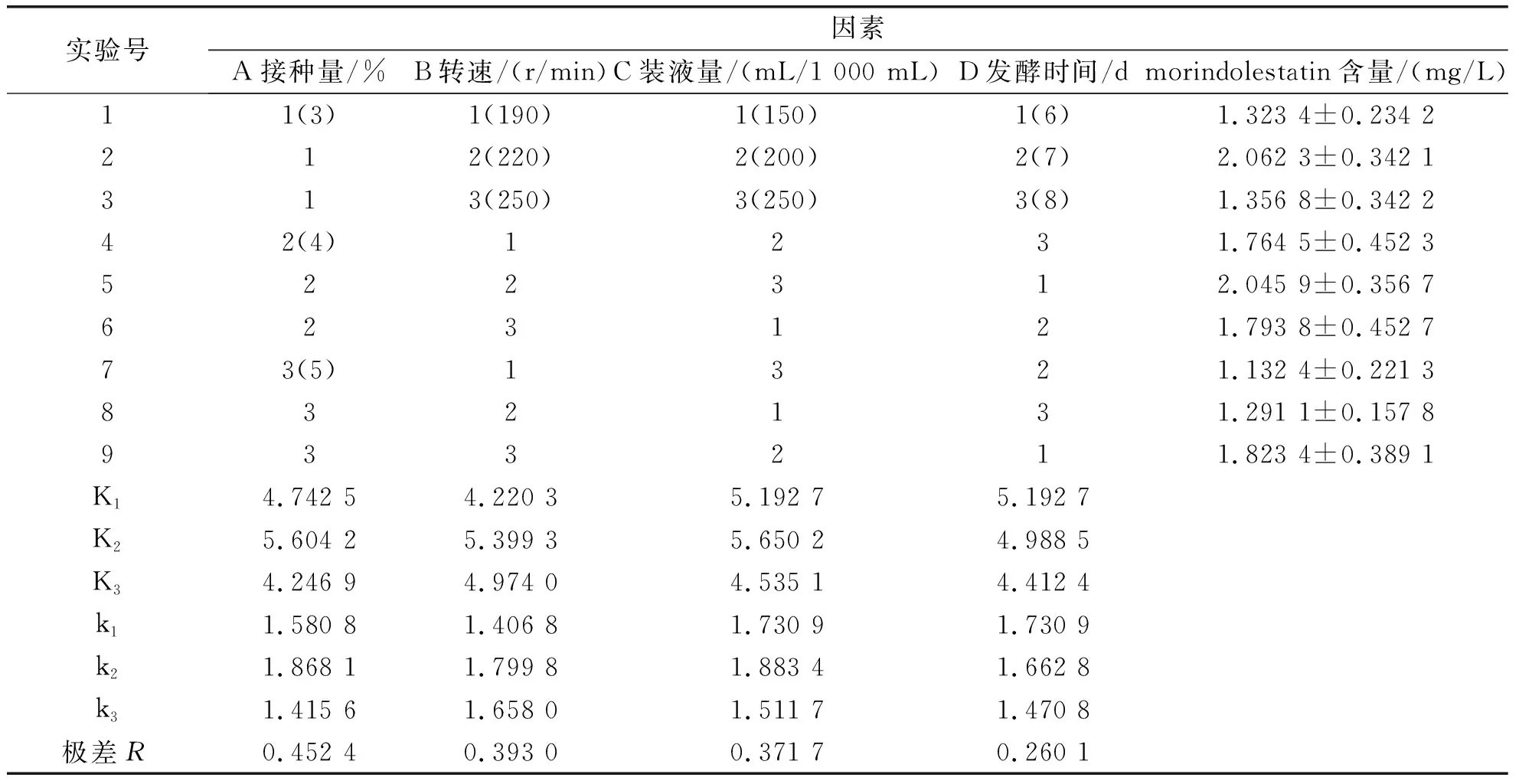
表3 4因素3水平正交试验结果表 L9(34)
2.4 优化发酵条件的验证
分别在菌株HUZ0001优化前后进行10批次摇瓶发酵.以发酵液中morindolestatin含量为检测指标,优化组发酵液的平均发酵水平为2.179 9±0.033 3 mg/L,对照组发酵液的平均发酵水平为1.112 2±0.007 9 mg/L,优化组较对照组提高196%.这表明在优化发酵条件后,菌株HUZ0001中产morindolestatin的含量显著提高,优化效果显著,见表4.
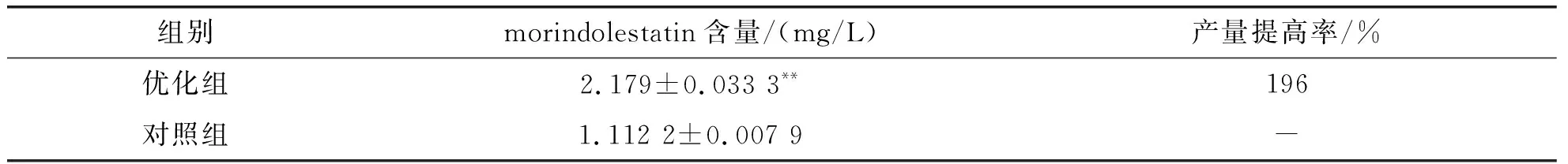
表4 验证试验结果(n=10)
3 结论与讨论
采用单因素实验和正交设计实验,对链霉菌HUZ0001产morindolestatin的关键影响因素和发酵培养基,以及关键参数的摇瓶发酵优化进行研究,确定最适发酵培养基,其成分为:2%可溶性淀粉、1%棉籽饼粉、0.5%酵母抽提物、0.5%麦芽提取物、0.2% MgSO4·7H2O、0.2% NaCl、0.2% CaCO3,pH 7.2~7.4.最适发酵条件为:接种量为4%、装液量为200 mL/1 000 mL、发酵时间为6 d、发酵温度为28 ℃、转速为220 r/min、发酵周期为24 h.通过发酵条件的优化和验证,最终检测链霉菌HUZ0001产morindolestatin含量为2.179 9±0.033 3 mg/L,较优化前发酵液中morindolestatin含量(1.112 2±0.007 9 mg/L)提高196%.
咔唑类生物碱是一类结构多样的天然产物,该类化合物结构独特,在 C-4 具有氮取代基,并显示出比维生素E更优异的抗氧化作用,已引起化学家和生物学家的注意[4,22-23].到目前为止,现存于自然界的antiostatin咔唑类似物,仅8种在蓝链霉菌 2007-SV112中被发现[24].本研究从链霉菌HUZ0001发酵液中得到的morindolestatin,是第一个天然产生的吲哚并咔唑antiostatin类生物碱,其对自由基诱导的脂质过氧化和清除自由基活性均有较强的抑制作用.本实验结果可为morindolestatin发酵产量的提高提供参考依据.
