槲皮素与牛血红蛋白的相互作用与抗氧化研究
2023-12-06葛海霞
郑 青,葛海霞
(湖州师范学院 生命科学学院,浙江 湖州 313000)
0 引 言
槲皮素(Quercetin,QUE)是一种天然黄酮醇类化合物,广泛存在于多种天然植物的叶、茎、芽、种子和果实中[1].多项研究表明,槲皮素具有广泛的药理作用,如抗氧化、抗菌、抗炎、抗肿瘤、抗病毒和免疫抑制等[2-3].槲皮素化学名为3,3’,4’,5,7-五羟基黄酮,又名栎精,分子式为C15H10O7,其分子结构见图1.
图1 槲皮素的分子结构
血红蛋白(hemoglobin,Hb)是红细胞中最主要的蛋白质成分,是血液中的氧载体,能直接或间接地帮助二氧化碳的运输,并调节血液的pH值[4].Hb的相对分子质量约为64 500,分子中含有4个亚基、2个α亚基和2个β亚基,每个亚基连接一个血红素基团[5].除白蛋白外,血红蛋白作为一种细胞内蛋白,可以与药物结合.当QUE进入人体时,它们可能会穿透红细胞并与Hb相互作用而影响QUE的生物利用度,以及Hb的空间构象和生物功能.牛血红蛋白(bovine hemoglobin,BHb)与Hb具有高达85%的氨基酸序列同源性,且比Hb更便宜、更容易获得,常被用于模拟血红蛋白与小分子化合物结合的研究[6].
本试验通过紫外光谱、荧光光谱、同步荧光光谱,以及对DPPH自由基清除能力的测定,研究在模拟人体生理条件下QUE与BHb的相互作用和抗氧化性,从而为了解QUE在体内的转运和代谢及其对BHb空间构象的影响等提供参考.
1 材料与方法
1.1 仪器与试剂
RF-6000PC型荧光分光光度计(日本岛津公司)、Evolution 201/220 紫外可见分光光度计(赛默飞世尔科技(中国)有限公司)、BS224S型电子天平(赛多利斯科学仪器(北京)有限公司)、DK-S24型恒温水浴锅(上海森信实验仪器有限公司)、pHS-3C型pH酸度计(上海精密科学仪器有限公司)等.
槲皮素(QUE,纯度≥99%,上海阿拉丁生化科技股份有限公司)、牛血红蛋白(BHb,生物试剂,上海源叶生物科技有限公司)、1,1-二苯基-2-苦基肼自由基(DPPH,分析纯,合肥巴斯夫生物科技有限公司).QUE储备液(1.0×10-4mol·L-1)用无水乙醇溶解配制,避光保存;BHb储备液(1.0×10-5mol·L-1)用pH=7.40的Tris-HCl缓冲溶液配制,于4 ℃ 冰箱保存;DPPH储备液(1.0×10-3mol·L-1)用无水乙醇配制,避光保存.其他所用试剂均为分析纯.
1.2 实验方法
1.2.1 紫外-可见吸收光谱的测定
在5个10 mL容量瓶中分别加入适量的BHb和QUE储备液,用pH=7.40的Tris-HCl缓冲溶液定容,固定BHb浓度为1.0×10-6mol·L-1,QUE浓度为(0、6.0、12.0、18.0、24.0)×10-6mol·L-1,置于298 K下恒温0.5 h,在200~500 nm范围内测定紫外-可见吸收光谱.
1.2.2 荧光光谱和同步荧光光谱的测定
在7个10 mL容量瓶中分别加入适量的BHb和QUE储备液,用pH=7.40的Tris-HCl缓冲溶液定容,固定BHb浓度为1.0×10-6mol·L-1,QUE浓度为(0、2.0、4.0、6.0、8.0、10.0、12.0)×10-6mol·L-1,置于一定温度(294、302、310 K)的水浴中恒温0.5 h.设定激发波长λex为280 nm,激发和发射狭缝宽度均为5 nm,在300~400 nm 范围内测定荧光光谱.同步荧光光谱设置激发波长λex与发射波长λem的差Δλ分别为15 nm 和60 nm,其他条件同荧光光谱.
1.2.3 抗氧化性的测定
抗氧剂的抗氧化活性大小可用DPPH自由基清除率代替表示.准确量取1 mL 10-4mol·L-1槲皮素溶液于10 mL容量瓶中,分别加入1×10-5mol·L-1BHb溶液 0、1、2、4、8 mL,再加入1 mL 10-3mol·L-1DPPH乙醇溶液,定容,避光反应 30 min 后,测定517 nm 波长处的吸光度值.
2 结果与讨论
2.1 QUE与BHb相互作用的荧光光谱
2.1.1 荧光猝灭光谱
BHb的固有荧光主要来自色氨酸(Trp)残基和酪氨酸(Tyr)残基.BHb中含有6个Trp残基和10个Tyr残基,其中β-37 Trp是主要的荧光团,对四级结构变化敏感[7-9].图2为在294、302、310 K温度下,不同浓度的QUE与BHb相互作用的荧光猝灭图.从图2可以看出,当λex为280 nm时,BHb在 330 nm 附近有很强的荧光发射峰,且随着QUE浓度的增大,BHb在330 nm附近的荧光产生有规律的猝灭,但最大发射峰没有发生移动.这说明QUE与BHb相互之间产生了作用,但QUE并没有引起BHb分子构象的改变[10].
2.1.2 荧光猝灭类型、结合常数和结合位点数
为推测QUE与BHb的猝灭机理,将所测数据用Stern-Volmer方程[11]做以下处理:

(1)
其中,F0和F分别代表不加QUE和加入QUE时BHb的荧光强度,[Q]为QUE的浓度,Kq为双分子猝灭过程速率常数,KSV为动态猝灭常数,τ0为不含QUE时的荧光分子寿命,生物大分子的荧光平均寿命约为10-8s.以F0/F为纵坐标、[Q]为横坐标作图,见图3(a).由此可求出直线斜率KSV,进而得出Kq,见表1.
假设小分子在蛋白质上有n个相同且独立的结合位点,按式(2)[12]进行处理:
lg[(F0-F)/F]=lgKa+nlg[Q],
(2)
其中,Ka为QUE与BHb的结合常数,n为结合位点数.以lg[(F0-F)/F]为纵坐标、lg[Q]为横坐标作图,见图3(b).由此可求出n和Ka,见表1.

注:c(BHb)=1.0×10-6 mol·L-1;c(QUE) 1→7:(0、2.0、4.0、6.0、8.0、10.0、12.0)×10-6 mol·L-1;pH 7.40.图2 不同温度下QUE对BHb的荧光猝灭光谱

图3 QUE猝灭BHb的Stern-Volmer图和双倒数曲线图

表1 不同温度下QUE-BHb的猝灭常数、结合常数和结合位点数
从表1可以看出,在3个不同温度下,Stern-Volmer方程拟合曲线的相关系数r均大于0.99,线性拟合关系良好.这说明Stern-Volmer模型可用于研究QUE与BHb之间的相互作用,也意味着在槲皮素与BHb的相互作用过程中,有一种猝灭类型占主导地位[13].猝灭常数Ksv随着温度的升高而减小,3个温度下的Kq值均远大于最大动态扩散猝灭常数2.0×1010L·mol-1·s-1.由此判断,QUE对BHb的猝灭为QUE与BHb形成基态复合物的静态猝灭[14].
经计算得出,n和Ka均随温度的升高而降低,说明温度升高能够降低QUE-BHb复合物的稳定性,符合静态猝灭.Ka的数量级为103L·mol-1,表明理论上QUE与BHb的结合作用较强,可被蛋白质输送或储存.3个温度下的平均结合位点数n分别为0.82、0.80和0.75,说明大约每个QUE分子与一个BHb结合形成复合物.由于β-37 Trp是BHb内源荧光的主要来源,所以QUE与BHb的作用位点更接近β-37 Trp.
2.1.3 热力学分析和作用力类型
化合物小分子与蛋白质大分子的结合是依靠非共价健作用力实现的,主要包括疏水作用、范德华力、氢键和静电引力等相互作用力类型[15].通过Van’t Hoff 方程计算QUE-BHb体系的热力学参数ΔH、ΔS和ΔG,可判断QUE和BHb之间的主要作用力.
ΔG=-RTlnKa=ΔH-TΔS,
(3)
其中,Ka、T和R分别为特定温度下的结合常数、温度和气体常数8.314 J·mol-1·K-1.
计算得到的热力学参数ΔH、ΔS和ΔG见表2.由表2可知,QUE和BHb在294、302、310 K温度下反应的ΔG<0,说明QUE与BHb的结合是一个自发的过程;ΔH<0、ΔS<0,说明QUE与BHb结合的作用力主要为氢键和范德华力[16].

表2 QUE-BHb体系的热力学参数
2.1.4 结合距离
QUE与BHb的结合距离,可根据Förster偶极-偶极非辐射能量转移理论及关系式(4)(5)(6)[17]计算得到:
(4)
(5)
(6)
式(4)中,E为能量转移效率,R0为能量转移效率为50%时的临界距离,r为QUE与BHb之间的距离.式(5)中,K2为偶极空间取向因子,n为介质的折射指数,φ为荧光残基的荧光量子产率,J为BHb的发射光谱与QUE的吸收光谱重叠积分.式(6)中,F(λ)为BHb在波长为λ处的荧光强度,ε为QUE在λ处的摩尔消光系数.
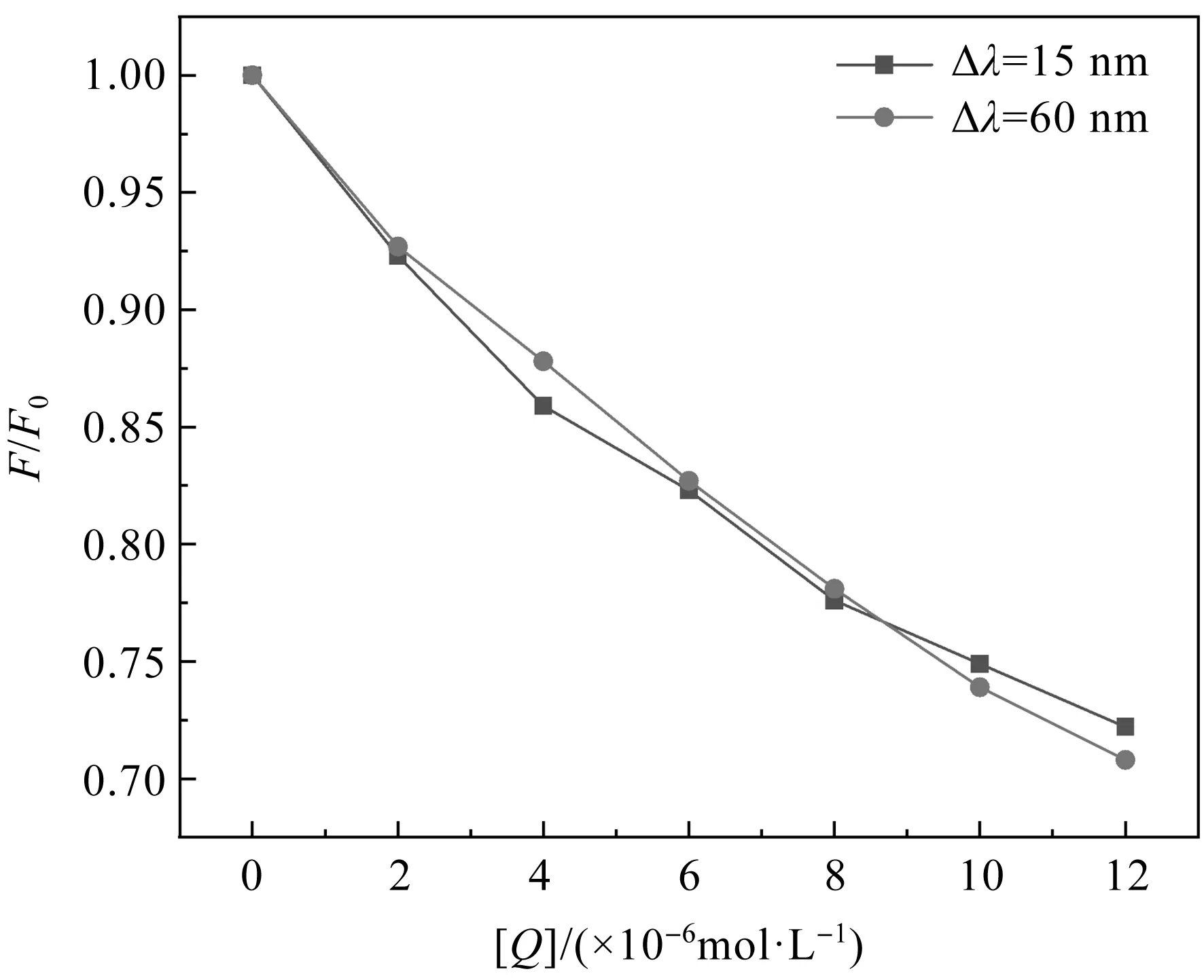
图4为QUE的紫外吸收光谱与BHb的荧光发射光谱的重叠光谱.将发射光谱重叠区域按式(6)计算,得到J=1.33×10-14cm3·L·mol-1.K2取2/3,n取有机物平均值1.36,Trp量子产率φ=0.15[18],计算得到临界距离R0=2.65 nm,r=2.09 nm.QUE与BHb的β-37 Trp残基之间的结合距离r小于 7 nm,符合0.50R0 注:c(BHb)=1.0×10-5 mol·L-1,c(QUE)=1.0×10-5 mol·L-1.图4 QUE吸收光谱和BHb荧光光谱的重叠图谱 2.2.1 紫外-可见吸收光谱 紫外-可见吸收光谱可用于研究蛋白质的结构变化和蛋白质-配体复合物的形成.BHb有3个吸收峰,在约208、278、405 nm处的吸收峰分别反映BHb的肽键、芳香族氨基酸残基(Trp和Tyr)和血红素卟啉-Soret带的构象[19].图5为当温度为298 K、pH为7.4时QUE与BHb相互作用的紫外-可见吸收光谱图.随着QUE浓度的增大,BHb在约278 nm处的吸收峰强度逐渐减小且出现了红移.这表明QUE与BHb的芳香残基存在相互作用,从而使包埋在BHb分子内部的Trp和Tyr残基部分裸露于水相,同时疏水基团之间的疏水作用增强,引起Trp和Tyr的π-π*跃迁所需能量减少[20].而当QUE浓度增大时,在约405 nm处的吸收峰降低,但吸收峰几乎未发生位移,表明QUE对BHb的血红素辅基几乎不产生影响[21]. 注:c(BHb)=1.0×10-6 mol·L-1,c(QUE) 1→7:(0、6.0、12.0、18.0、24.0)×10-6 mol·L-1;pH=7.40.图5 QUE-BHb体系的紫外-可见吸收光谱 2.2.2 同步荧光光谱 同步荧光光谱被广泛用于检测蛋白质构象变化的信息.当激发波长与发射波长的差值Δλ为15 nm或60 nm时,BHb的同步荧光光谱可分别提供BHb的Tyr和Trp残基的特征信息,并检测Tyr和Trp残基所处微环境是否发生变化[22]. QUE-BHb体系的同步荧光发射光谱见图6.由图6可知,当Δλ=15 nm时,随着QUE浓度的递增,Tyr残基的荧光强度逐渐降低,且最大发射波长的峰没有明显的蓝移或红移,说明QUE对BHb的Tyr残基周围微环境的极性和疏水性影响较小;当Δλ=60 nm时,随着QUE浓度的递增,Trp残基的荧光强度逐渐降低,且最大发射波长的峰发生轻微红移,说明QUE可使BHb中Trp残基周围的微环境极性增加,疏水性降低,这也是槲皮素与BHb发生静态猝灭生成复合物的体现[23]. BHb每个二聚体中含有3个Trp残基和5个Tyr残基.Trp残基和Tyr残基是以BHb腔为对称中心对称的[7].QUE对BHb的同步荧光猝灭见图7.由图7可知,Δλ为15 nm时的图像斜率与Δλ为60 nm时的图像斜率相似,说明QUE接近Trp残基和Tyr残基的机会相等.由此得出,QUE与血红蛋白中心腔结合能形成QUE-BHb复合物[24]. 注:c(BHb)=1.0×10-6 mol·L-1;c(QUE) 1→7:(0、2、4、6、8、10、12)×10-6 mol·L-1;pH=7.40.图6 QUE-BHb体系的同步荧光光谱 注:c(BHb)=1.0×10-6 mol·L-1.图7 QUE对BHb的同步荧光猝灭 DPPH自由基清除率可根据式(7)[25]计算得到: (7) 其中,A0为Tris缓冲溶液与DPPH溶液混合反应后的吸光度,Ai为QUE和BHb混合溶液与DPPH溶液混合反应后的吸光度,Aj为QUE和BHb的混合溶液与Tris缓冲溶液混合反应后的吸光度. QUE-BHb对DPPH自由基的清除率见图8.由图8可知,保持QUE浓度不变,加入梯度浓度的BHb,QUE对DPPH自由基的清除率在加入BHb后显著提高,表明BHb可以促进QUE对DPPH自由基的清除.QUE对DPPH自由基的清除率在0~1×10-6mol·L-1范围内上升,而在1×10-6mol·L-1~ 8×10-6mol·L-1范围内反而下降,表明QUE对DPPH自由基的清除率,对BHb浓度没有依赖性,过高浓度的BHb反而不利于QUE对DPPH自由基的清除,降低其抗氧化性. 图8 QUE-BHb对DPPH自由基的清除率 Stern-Volmer猝灭常数KSV随着温度的升高而减小,QUE对BHb荧光的猝灭是一个静态猝灭过程.热力学参数ΔH<0、ΔS<0,说明QUE与BHb结合的作用力主要为氢键和范德华力.根据荧光共振转移理论,QUE与BHb中Trp残基之间的平均结合距离为2.09 nm.QUE可使BHb构象和微环境发生变化,QUE与BHb中心腔结合可形成QUE-BHb复合物.QUE与BHb结合可使QUE对DPPH自由基的清除率显著提升,且对BHb没有浓度依赖性.该研究有助于从分子水平了解QUE在体内的转运、代谢,以及对BHb空间构象和生物学功能的影响,可为设计、修饰和筛选黄酮类药物分子提供依据.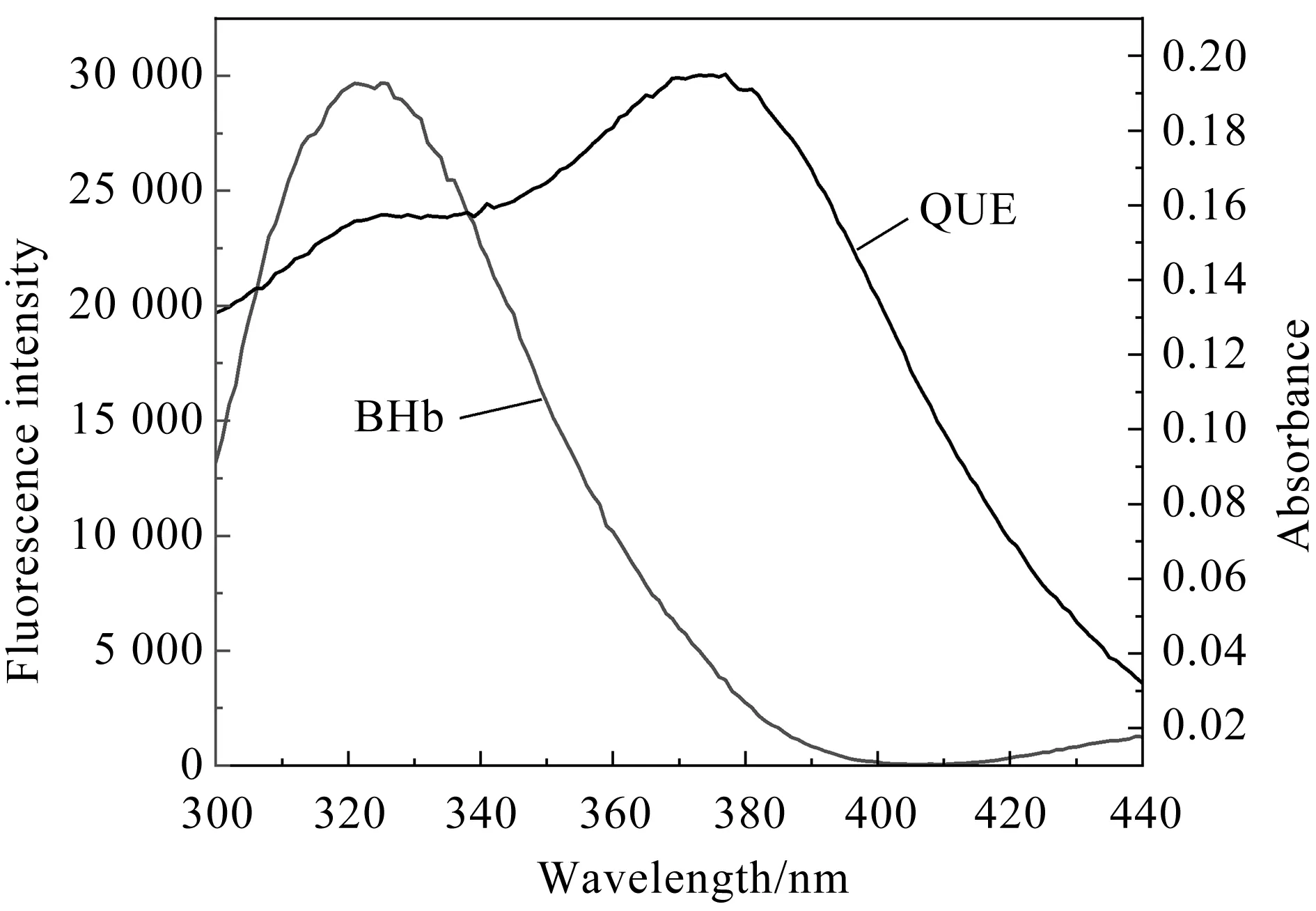
2.2 QUE对BHb二级结构的影响


2.3 QUE对DPPH自由基的抗氧化性
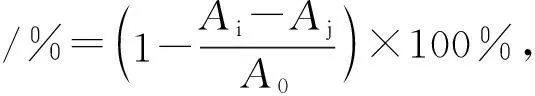

3 结 论
