负载甲维盐介孔二氧化硅纳米球的制备及其对松材线虫的毒力性能
2023-12-05王钊贵徐鹏曹蓉郝德君
王钊贵,徐鹏,曹蓉,郝德君*
(1. 南京林业大学林草学院,南方现代林业协同创新中心,南京 210037; 2. 南京林业大学化学工程学院,南京 210037; 3. 南京市六合区农业技术推广中心森林植物检疫站,南京 211500)
松材线虫病又称松树萎蔫病是由松材线虫(Bursaphelenchusxylophilus)引起的一种系统侵染性病害[1],对我国的森林资源和生态环境构成了巨大的威胁[2]。目前,注干施药被认为是防治松材线虫的有效方法[3],但研究发现,注干施用过程中药物用量过大会对树干注干口造成不可逆的伤害[4-6],因此,研究出对松材线虫具有高毒力的注干药剂对松材线虫防治具有重要意义。
纳米载药系统被认为是一种提高农药毒力的有效方法[7]。在农业领域利用纳米载体结合化学农药噻虫嗪,对桃蚜的触杀和胃毒作用均显著提升20%左右[8];纳米化苄氯菊酯对埃及伊蚊的致死中质量浓度从0.019 9 mg/L降低至0.006 3 mg/L[9]。在林业领域,以HKUST-1为载体,浸渍法负载除虫菊素,对松墨天牛的平均毒性增加了1.62倍[10]。介孔二氧化硅因比表面积大、孔道均匀等优点被认为是一种良好的农药载体材料。有研究表明,利用二氧化硅负载咪鲜胺明显提高了对小麦赤霉病病菌菌丝生长的抑制效果[11]。本课题组前期研究中也发现,利用介孔二氧化硅纳米球负载戊唑醇可以显著增加戊唑醇对禾谷镰刀菌的抑制效果。然而,目前利用纳米技术提高靶标害虫毒力的研究主要集中在农业领域[12-13],而应用于林业病虫害防治的报道较少。
针对上述问题,本研究在通过一锅溶胶-凝胶法制备出负载甲维盐介孔二氧化硅纳米球(EB@MSN),在对载药介孔纳米球形貌和结构进行表征的基础上,通过模拟释放实验研究EB@MSN的载药量和释药性能。此外,通过浸虫法探究EB@MSN对松材线虫的毒力性能,并利用荧光探针技术进一步探究EB@MSN对松材线虫的作用机理。
1 材料与方法
1.1 试验材料
1.1.1 供试药剂
十六烷基三甲基氯化铵(CTAC),质量分数97%,上海麦克林生化科技有限公司;甲氨基阿维菌素苯甲酸盐(EB),质量分数75%,江苏艾津作物科技集团有限公司;异硫氰酸荧光素(FITC),质量分数90%,阿拉丁试剂有限公司;3-氨丙基三甲氧基硅烷(APTES),质量分数98%,阿拉丁试剂有限公司;甲醇、三乙胺、乙腈,色谱级,阿拉丁试剂有限公司;溴化钾、乙醇、氨水、甲醇、正硅酸乙酯(TEOS),分析纯,国药集团化学试剂有限公司。
1.1.2 实验仪器
JSM-1400型透射电子显微镜,日本电子株式会社;360型傅里叶变换红外光谱仪,美国Nicolet公司;KQ5200型超声波清洗器,昆山市超声仪器有限公司;UV-2450紫外分光光度计,岛津企业管理(中国)有限公司;ASAP-2020比表面积测试仪,美国Micrometrics公司;Leica DM2500&DM2500 LED荧光显微镜,德国Leica公司。
1.2 试验方法
1.2.1 负载甲维盐介孔二氧化硅纳米球的制备
将1.0 g甲维盐溶于6.0 mL甲醇与4.0 mL TEOS得混合液A,将1.5 g CTAC溶于100.0 mL去离子水形成水相B,将混合液A逐滴加入水相B中,机械搅拌30 min后,加入0.1 mL氨水,继续搅拌4 h并静置老化12 h后,离心悬浮液,下层沉淀物用去离子水洗涤3次,冷冻干燥,即可获得负载甲维盐介孔二氧化硅纳米球(EB@MSN)。以相同条件,将甲维盐的添加量更改为0.3和0.6 g,获得的纳米球分别为EB@MSN-0.3和EB@MSN-0.6,探究甲维盐添加量对MSN中药物装载量的影响。
1.2.2 负载甲维盐荧光介孔二氧化硅纳米球的制备
将10.0 mg异硫氰酸荧光素(FITC)溶于10.0 mL乙醇,然后加入1.0 mL 3-氨丙基三甲氧基硅烷(APTES),避光搅拌24 h后制得FITC-APTES。制备EB@MSN过程中,在加入氨水后滴加2.0 mL FITC-APTES,即可获得负载甲维盐荧光介孔二氧化硅纳米球(EB@FITC@MSN)。
1.2.3 EB@MSN的理化性能表征
利用JSM-1400型透射电子显微镜对制备样品的尺寸和形貌进行表征;利用360型傅里叶变换红外光谱仪对样品进行定性分析,测试范围500~4 000 cm-1;干燥脱水后的样品用ASAP-2020比表面积测试仪测试样品N2吸附-脱附等温线,根据BET方法和BJH方法计算比表面积;在25~600 ℃,以10 ℃/min的加热速率对样品进行热重分析。
1.2.4 EB@MSN的释放动力学
将10.0 mg EB@MSN用透析袋密封后置于100.0 mL的释放介质(V甲醇∶V水=7∶3,pH=5)中,利用高效液相色谱检测在15,25和35 ℃下的介质溶液中药物变化情况。HPLC检测条件:C18色谱柱(250 mm×4.6 mm),检测波长选245 nm,柱温为25 ℃,进样量为10.0 μL,流速为1.0 mL/min,流动相为V乙腈∶V甲醇∶V水(0.1%三乙胺)=50∶42∶8的混合液。同时将EB@MSN-0.3、EB@MSN-0.6和EB@MSN在以上条件下进行药物释放实验,探究药物装载量与释放行为的关系。
1.2.5 EB@MSN对松材线虫的毒力测试
供试虫源:松材线虫来自南京林业大学森林保护实验室,已鉴定为AmA3,强毒虫株。
试验方法:松材线虫以灰葡萄孢扩繁,以贝尔曼漏斗法收集并配制3 000条/mL备用。分别称取少量EB@MSN和EB在水中分散均匀后定容至不同浓度,将试剂与线虫液按体积比1∶1混合,并于24 h后统计20.0 μL中线虫的总数以及死亡数,以无菌水为对照,计算校正死亡率。每个浓度设置3个重复。
校正死亡率=(处理死亡率-空白对照死亡率)/(100-空白对照死亡率)×100%
1.2.6 EB@FITC@MSN处理松材线虫后的荧光成像
将EB@FITC@MSN分散于无菌水中,以LC50的浓度处理松材线虫12 h,然后进行制片,并在荧光显微镜下观察。
1.2.7 EB@MSN对松材线虫繁殖取食影响
分别将EB@MSN和EB均匀分散在水中,以LC50的浓度对松材线虫处理6 h,以无菌水洗涤松材线虫,后接入灰葡萄孢,观察取食情况,7 d后利用贝尔曼漏斗法统计各皿线虫数量,分别以无菌水处理松材线虫和不接松材线虫为对照组。
2 结果与分析
2.1 透射电子显微镜(TEM) 分析
EB@MSN透射电镜和粒径分布统计图见图1。由图1可以看出,EB@MSN具有良好的分散性且粒径较为均一,球体内可见规则的孔道结构。Nano Measurer统计结果显示,EB@MSN粒径主要分布在40~65 nm,平均粒径为55 nm。

图1 MSN透射电镜图与粒径分布Fig. 1 TEM images and particles size distribution of MSN
2.2 比表面积和孔容测试
MSN与EB@MSN的N2吸附-脱附等温线见图2。从图2可以看出,MSN和EB@MSN的N2吸附-脱附等温线均属于IV等温线,即在脱附时得到的等温线不重合,脱附等温线在吸附等温线的上方,产生吸附滞后,呈现滞后环,是典型的多孔物质发生多分子层吸附特有的等温线,表明MSN和EB@MSN内部均存在毛细凝结现象和中孔隙,均为介孔结构材料[14]。根据BET公式及BJH方程计算MSN和EB@MSN的比表面积分别为206.665和99.567 m2/g,总孔容分别为0.668 5和0.399 9 cm3/g。由此可见,吸附负载EB后,引起了MSN比表面积和总孔容的减小。

图2 MSN和EB@MSN的氮气吸附-脱附等温线Fig. 2 Nitrogen adsorption-desorption isotherm of MSN and EB@MSN
2.3 傅里叶变换红外吸收光谱
MSN、EB和EB@MSN的傅里叶变换红外吸收光谱见图3。从图3可以看出,EB在1 384和1 457 cm-1处的特征吸收峰对应于EB分子甲基的不对称伸缩振动,在3 440 cm-1处的特征吸收峰对应于羟基的伸缩振动[15];MSN在1 085和800 cm-1处的特征吸收峰则对应于其结构中Si—O—Si的对称伸缩振动和不对称拉伸振动[16-17]。EB@MSN的光谱图中既包含了EB的特征吸收峰又包含了Si—O—Si的特征吸收峰,验证了EB@MSN的组成成分。

图3 MSN和EB@MSN的傅里叶红外光谱Fig. 3 Fourier transform infrared spectrogram of MSN and EB@MSN
2.4 热重分析
MSN、EB@MSN、EB@MSN-0.3和EB@MSN-0.6的热重曲线图(TGA)见图4a。由图4a可见,MSN的质量损失主要为3段:在150 ℃前出现质量损失的原因是水分的蒸发;150~350 ℃出现质量损失的原因为MSN内的外层模板剂CTAC的高温降解;350~500 ℃出现质量损失的原因为MSN内部孔道中CTAC的高温分解;而EB@MSN除了在150 ℃前出现质量下降的原因是水分的蒸发,在150~350 ℃的质量损失则归因于外层CTAC和负载的甲维盐的高温降解,350~500 ℃出现质量损失的原因为MSN内部孔道中CTAC和负载的甲维盐的高温分解。图4b为MSN、EB@MSN、EB@MSN-0.3 和EB@MSN-0.6的微商热重曲线图(DTG),由图4b可见,EB@MSN、EB@MSN-0.3和EB@MSN-0.6 在150~350 ℃和350~500 ℃之间有明显的坡度变化,与TGA曲线相对应,且随着EB的添加质量增大其质量损失增加,在150~500 ℃,MSN的质量损失率为15.93%,EB@MSN-0.3的质量损失率为34.89%,EB@MSN-0.6的质量损失率为42.34%,EB@MSN的质量损失率为60.09%。因此,可以得出EB@MSN-0.3、EB@MSN-0.6和EB@MSN的载药率分别为18.96%,26.41%和44.16%。
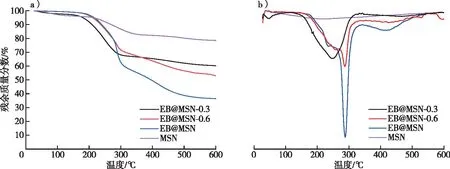
图4 MSN、EB@MSN、EB@MSN-0.3和EB@MSN-0.6的TGA和DTG图Fig. 4 TGA and DTG curves of MSN, EB@MSN, EB@MSN-0.3 and EB@MSN-0.6
2.5 释放动力学
通过分光光度法测定的EB@MSN在不同温度下甲醇/水溶液中的释放曲线见图5a。由图5a可见,在不同温度下,EB@MSN的释放规律大体一致:0~5 h释放速率较快;5 h后,EB@MSN的释放速率减慢;10 h后释放介质中药物浓度趋于平衡。另外,平衡浓度随介质温度的增加而增加,主要归因于随着温度升高,EB分子运动速度增加。图5b为EB和EB@MSN在相同条件下的药物释放曲线,由图5b可见,在相同条件下,EB释放速率较快,EB@MSN的释放速率慢于EB,表明EB@MSN存在一定药物缓释功能。图5c为EB@MSN、EB@MSN-0.3和EB@MSN-0.6在相同条件下的药物释放曲线,由图5c可见,药物负载量的变化并不会改变药物的释放行为。

a)EB@MSN在不同温度下的药物释放曲线;b)EB@MSN和EB在相同条件下的药物释放曲线;c)EB@MSN、EB@MSN-0.3和EB@MSN-0.6在相同条件下的药物释放曲线。
2.6 EB@MSN对松材线虫的毒力测试
EB与EB@MSN对松材线虫的毒力分析结果见表1。由表1可看出,EB@MSN的半致死浓度(LC50)为17.570 mg/L,相对于EB的半致死浓度(44.396 mg/L)提升了近1.5倍。由此可见,EB负载于MSN上后,对松材线虫的毒杀活性明显增强。分析其毒力增强的原因主要为两点:一是随着粒径减小,药物在水中的分散性能得到提高,EB@MSN和EB在水中的分散性比较见图6;二是纳米化提高了药剂的比表面积,增大了药剂在线虫体表的黏附,进而提升了对松材线虫的毒力。
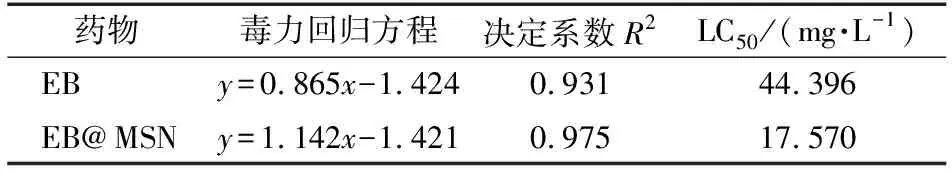
表1 EB与EB@MSN对松材线虫的毒力分析Table 1 Toxicity analysis of EB and EB@MSN to B. xylophilus

图6 EB@MSN和EB在水中的分散性比较Fig. 6 Comparison of the dispersion of EB@MSN and EB in water
2.7 EB@FITC@MSN处理松材线虫后的荧光成像
EB@FITC@MSN以LC50的浓度处理过的松材线虫在荧光显微镜下的成像见图7。从图7a和b的明场及暗场对比可以看出,荧光亮点富集在松材线虫的体壁外侧和体腔内,表明纳米药物大量富集于线虫体表。因EB@FITC@MSN粒径在55 nm左右,可在松材线虫体腔运输营养和代谢物质与外界进行交换时轻易进入松材线虫的体内。从图7c和d的明场及暗场对比可以看出,EB@FITC@MSN进入松材线虫后集中分布在头部和躯干部的上半部分,尤其在神经环周围比较集中,可见,纳米药剂在进入松材线虫体内后,在神经环处集中并释放药物,可加快EB对松材线虫的作用时间,实现精准用药,达到提高毒杀松材线虫效果的目的。

图7 EB@FITC@MSN处理后的松材线虫显微照片及荧光显微照片Fig. 7 EB@MSN@FITC treated B. xylophilus microphotographs and fluorescent microphotographs
2.8 EB@MSN对松材线虫取食繁殖影响
EB@MSN对松材线虫取食繁殖影响图见图8。图8a~d分别为EB@MSN、EB、无菌水处理松材线虫和不接松材线虫后松材线虫取食灰葡萄孢的面积,图8e为7 d后培养皿中松材线虫的种群数量。从图8可以看出,EB@MSN处理松材线虫后取食灰葡萄孢的面积明显小于EB处理松材线虫后取食灰葡萄孢的面积,表明经EB@MSN处理的松材线虫存活数量明显少于经EB处理的松材线虫数量(P<0.05)。另外,统计结果(图8e)显示,EB@MSN、EB和去离子水处理后松材线虫在培养皿中的存活数量分别为(983±73)、(3 076±178)和(33 250±482)条,同样可得,EB@MSN对松材线虫具有较好的毒力。
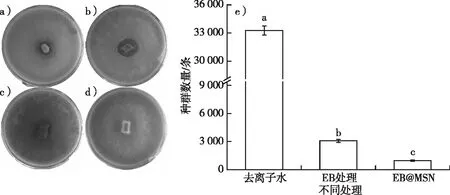
a)EB@MSN;b) EB;c)无菌水处理松材线虫;d)不接松材线虫;e)7 d后培养皿中松材线虫的种群数量。
3 结 论
本研究采用一锅溶胶-凝胶法制得的EB@MSN平均粒径为55 nm,最大载药量为44.16%,模拟释放实验显示其药物释放速率与温度正相关。EB@MSN对松材线虫的LC50为17.570 mg/L,高于EB近1.5倍,荧光探针实验结果显示EB@MSN提升EB对松材线虫的毒力主要归因于其提高了药物在水中的分散性和线虫体表的黏附性。另外,荧光显微探针显示,纳米药物富集于松材线虫神经环周围,提高了对线虫毒杀的精准度和效率。本研究成果为开发高效杀线甲维盐制剂提供了重要基础,但其在松树中的吸收、转运能力有待进一步研究。
