小麦低聚肽对小尾寒羊屠宰性能、肉品质及瘤胃菌群结构的影响
2023-12-04盛宇飞哈斯额尔敦敖长金张喜胜
白 晨 张 昊 盛宇飞 哈斯额尔敦* 敖长金 张喜胜
(1.内蒙古农业大学动物科学学院,内蒙古自治区高校动物营养与饲料科学重点实验室,呼和浩特 010018;2.锡林浩特市鼎安生物科技有限公司,锡林浩特 026000)
在畜禽营养研究中,饲用肽类的研究主要集中于植物源肽(如大豆肽等)或动物源肽对反刍动物瘤胃的调控以及对单胃动物免疫和抗氧化能力的调控等方面,并证实其具有抗菌、抗炎、提高生长性能和肉品质等作用[1-5]。作为小麦蛋白的深加工产品,小麦低聚肽含有较高含量的谷氨酸和较为丰富的支链氨基酸,具有抗氧化、调节免疫机能、提高肉羊生长性能等作用[6-8],是一种较好的营养调节剂。本课题前期研究表明,小麦低聚肽可以提高肉羊的日增重、降低料重比、提高营养物质消化率、改变小肠形态结构,并从营养物质吸收的角度探讨了小麦低聚肽对肉羊生长性能的影>响[8]。另有体外试验表明,瘤胃液中添加小麦低聚肽可以提高氨态氮、挥发性脂肪酸和微生物蛋白浓度,促进瘤胃发酵,提高营养物质利用率[9]。瘤胃微生物的群落变化直接影响营养物质的消化,进而影响肉羊的肉品质、屠宰性能等重要指标,然而目前关于小麦低聚肽对肉羊瘤胃微生物群落的影响尚未见报道。本试验拟通过分析饲喂小麦低聚肽对肉羊瘤胃微生物群落的改变,观测其对屠宰性能和肉品质的影响,旨在完善肉羊饲粮添加小麦低聚肽的系统性研究,为肉羊养殖中小麦低聚肽的应用提供科学依据。
1 材料与方法
1.1 试验设计与饲养管理
饲养试验于2021年11月至2022年1月进行。采用单因素随机试验设计,选取4月龄、检疫合格、平均体重35 kg、健康的小尾寒羊公羊30只,随机分为2组,即对照组(饲喂基础饲粮)和试验组(饲喂基础饲粮+0.3%小麦低聚肽),每组15只。饲喂量依据本课题组吕可欣等[9]的研究结果确定。羊只每日晨饲前将小麦低聚肽混于少量全混合日粮(TMR)中优先饲喂,待采食完成后再补齐剩余TMR。试验期共75 d,包括预试期15 d,正试期60 d。
试验所用小麦低聚肽是以谷朊粉为原料进行酶解制备的成品,由锡林浩特市某公司提供,主要含有谷氨酸(28.78%)、亮氨酸(5.14%)、异亮氨酸(2.54%)、蛋氨酸(1.16%)、缬氨酸(2.82%)、苯丙氨酸(3.91%)、赖氨酸(1.14%)、甘氨酸(2.64%)。
试验开始前,对羊舍进行分隔、消杀、清洁料槽、安装饮水装置,确保分圈饲养的2组条件、环境等一致。羊只每日08:00和16:00各饲喂1次,根据剩料情况及时调整下次供料量,羊只自由饮水。试验期所用饲粮采用TMR形式进行饲喂,基础饲粮组成及营养水平见表1,饲粮营养水平符合《肉羊营养需要量》(NY/T 816—2021)的要求,饲粮中的粗蛋白质(CP)、粗脂肪(EE)、中性洗涤纤维(NDF)、酸性洗涤纤维(ADF)、钙(Ca)、总磷(TP)含量的测定依据《饲料分析及饲料质量检测技术》[10]。试验期每天清理羊舍、料槽、水槽,早、晚各换水1次,保证羊舍卫生条件和试验羊只健康状况。

表1 基础饲粮组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of the basal diet (DM basis) %
1.2 样品采集与处理
在正试期第60天,每组选择6只检疫合格、体况相近的肉羊,禁食、称重后屠宰。屠宰后称胴体重,测定背膘厚度,描绘并计算眼肌面积,测定背最长肌pH。另取100 g左右的背最长肌样品用于检测其他肉品质指标。羊只屠宰后取瘤胃内容物,用4层纱布过滤得到瘤胃液,取20 mL瘤胃液分装于2个10 mL冻存管内,迅速放入液氮保存,带回实验室后存放入-80 ℃冰箱保存,用于测定瘤胃菌群结构。
1.3 指标测定及方法
1.3.1 屠宰性能测定
羊只禁食12 h后屠宰,屠宰前称重为宰前活重(kg);羊只屠宰放血后剥去毛皮,去除头、蹄和脏器,保留肾脏及肾周脂肪后称重为胴体重(kg);屠宰率为胴体重和宰前活重之比,即:屠宰率(%)=胴体重/宰前活重×100;采用游标卡尺测定第12~13根肋骨间眼肌中部正上方脂肪组织厚度,即为背膘厚度(mm);采用硫酸纸画出胴体第12~13根肋骨间对应的腰椎横断面眼肌的轮廓,再计算轮廓面积,即为眼肌面积(cm2)。
1.3.2 羊肉品质测定
pH测定:羊只屠宰后45 min,选择每只试验羊背最长肌相同部位样品,用无菌手术刀在样品上划一小口,然后将校准后的pH计的玻璃电极插入测定pH,即pH45 min;将样品放置于4 ℃的冰箱保存24 h后,采用相同方法测定相同位置的pH,即pH24 h。每个样品测定3次,取平均值。
肉色分析:取每只试验羊相同部位的背最长肌,选择3个点使用OPTO-STAR肉色测定仪测定亮度(L*)、红度(a*)和黄度(b*)值。各样品测定3次后取平均值。
剪切力测定:采用CL-ML3肌肉嫩度仪进行测定。取各羊只相同部位背最长肌样品,置于4 ℃冰箱过夜后,将筋膜和脂肪除去,切成3 cm3左右的肉块,在80 ℃水浴锅中加热30 min,待中心温度达到70 ℃后取出样品,将表面水分用滤纸吸干并冷却至室温,使用圆形取样器取样,测定剪切力。每个样品重复测定3次,取平均值。
蒸煮损失测定:取各羊只相同部位背最长肌30 g左右,将肌外膜和脂肪剔除,称重并记录。将样品在80 ℃水浴锅中加热30 min,取出样品冷却30 min后称重并记录。按照如下公式计算蒸煮损失:
蒸煮损失(%)=[(煮前样品重-煮后
样品重)/煮前样品重]×100。
失水率测定:取各羊只相同部位背最长肌样品,平置后用直径5 cm的圆形取样器于样品中心部位取厚约1 cm的样品,称重并记录。样品上下各放置12层中性滤纸,保证样品处于中央位置,在35 kg的压力下持续5 min,撤去外力,称重并记录。按照如下公式计算失水率:
失水率(%)=[(样品重-失水后样品重)/
样品重]×100。
1.3.3 瘤胃菌群结构分析
瘤胃菌群结构分析委托上海中科新生命科技有限公司进行。对瘤胃液微生物DNA进行提取,并进行纯度和浓度检测。对选定的V3~V4可变区进行PCR扩增。使用NEB Next®UltraTMDNA Library Prep Kit建库试剂盒进行文库构建。构建好的文库通过Agilent Bioanalyzer 2100和Qubit进行质检,文库质检合格后,使用Illumina MiSeq平台进行上机测序。
1.4 数据处理与分析
试验数据利用Excel 2019进行初步整理后,使用SAS 9.2软件进行统计分析,采用t检验进行组间差异显著性分析,定义P<0.05为差异显著,0.05≤P≤0.10为差异有显著的趋势。
2 结果与分析
2.1 小麦低聚肽对小尾寒羊屠宰性能的影响
由表2可知,与对照组相比,饲粮中添加小麦低聚肽对小尾寒羊的宰前活重、胴体重和屠宰率无显著影响(P>0.05)。与对照组相比,试验组背膘厚度显著增加(P<0.05),眼肌面积无显著变化(P>0.05)。

表2 小麦低聚肽对小尾寒羊屠宰性能的影响Table 2 Effects of wheat oligopeptides on slaughter performance of small-tailed Han sheep
2.2 小麦低聚肽对小尾寒羊肉品质的影响
由表3可知,试验组背最长肌肉色b*值显著高于对照组(P<0.05),L*和a*值与对照组没有显著差异(P>0.05)。背最长肌pH45 min、pH24 h在2组间无显著差异(P>0.05)。对照组背最长肌剪切力和失水率显著高于试验组(P<0.05),试验组蒸煮损失有低于对照组的趋势(P=0.09)。
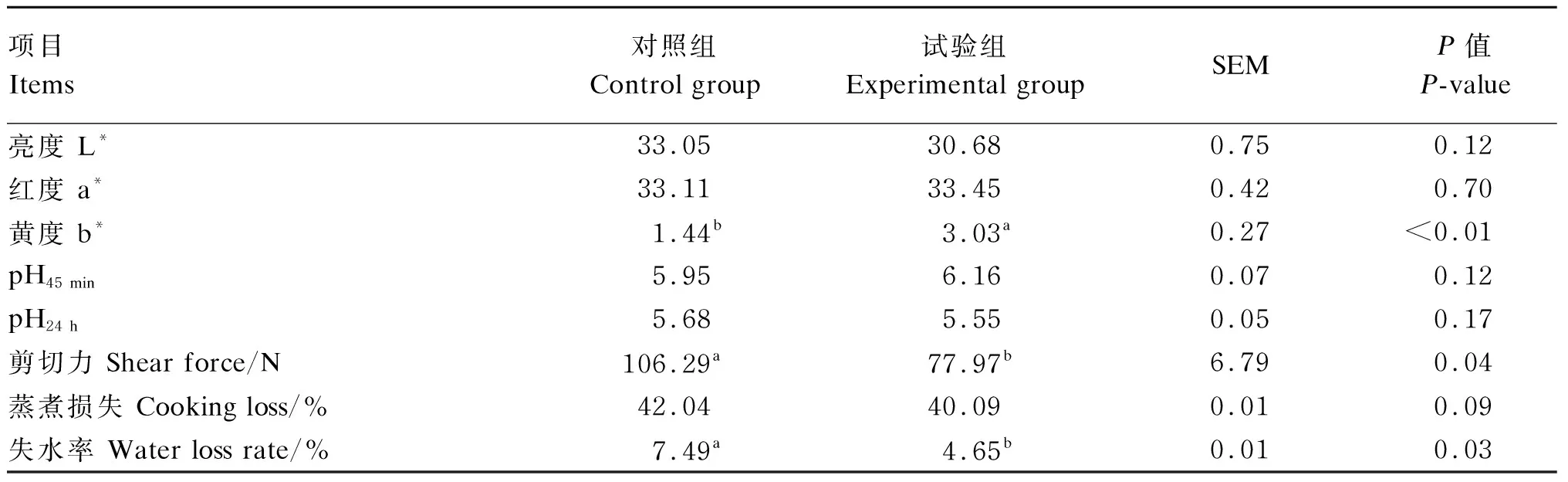
表3 小麦低聚肽对小尾寒羊肉品质的影响Table 3 Effects of wheat oligopeptides on meat quality of small-tailed Han sheep
2.3 小麦低聚肽对小尾寒羊瘤胃菌群结构的影响
2.3.1 操作分类单元(OTU)维恩(Venn)图
由图1可知,在相似度97%的水平下,2组样品中总共含有2 791个OTU,其中共有OTU为1 927个,占OTU总数的69.04%,对照组独有OTU为405个,试验组独有OTU为459个,分别占OTU总数的14.51%和16.45%;相比于对照组,试验组OTU数目相对较多。

C代表对照组,T代表试验组。C represents the control group, and T represents the experimental group.图1 操作分类单元Venn图Fig.1 Venn diagram of OTU
2.3.2 alpha多样性分析
由表4可知,与对照组相比,试验组的Ace指数、Chao指数、Shannon指数、Simpson指数和Coverage指数均无显著变化(P>0.05)。

表4 小麦低聚肽对小尾寒羊瘤胃菌群alpha多样性的影响Table 4 Effects of wheat oligopeptides on rumen microflora alpha diversity of small-tailed Han sheep
2.3.3 小麦低聚肽对小尾寒羊瘤胃菌群组成的影响
从本试验样本细菌中共检出21个门、32个纲、59个目、107个科、235个属、115个种。
由表5可知,在细菌门水平上,对照组相对丰度占比在1%以上的菌门有拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、螺旋体门(Spirochaetes)和变形菌门(Proteobacteria),试验组相对丰度在1%以上的菌门有拟杆菌门、厚壁菌门和螺旋体门;试验组拟杆菌门的相对丰度有高于对照组的趋势(P=0.08),蓝菌门的相对丰度显著低于对照组(P<0.05),其余菌门的相对丰度在2组间均无显著差异(P>0.05)。

表5 小麦低聚肽对小尾寒羊瘤胃主要菌门相对丰度的影响Table 5 Effects of wheat oligopeptides on relative abundances of major bacterial phyla in rumen of small-tailed Han sheep %
由表6可知,在细菌属水平上,对照组和试验组相对丰度较高的菌属均是理研菌科RC9肠道群(Rikenellaceae RC9 gut group)和普雷沃氏菌属1(Prevotella1);试验组丁酸弧菌属2(Butyrivibrio2)的相对丰度有低于对照组的趋势(P=0.10),其他菌属的相对丰度在2组间无显著差异(P>0.05)。

表6 小麦低聚肽对小尾寒羊瘤胃主要菌属相对丰度的影响Table 6 Effects of wheat oligopeptides on relative abundances of major bacterial genera in rumen of small-tailed Han sheep %
3 讨 论
3.1 小麦低聚肽对小尾寒羊屠宰性能和肉品质的影响
低聚肽类物质含有2~10氨基酸,由于分子质量较小,易于消化[11],是提高饲料利用效率、促进高精料条件下反刍动物瘤胃微生物活性的有效饲料添加剂[3]。目前关于植物来源肽的研究较为广泛。前人研究表明,棉籽蛋白来源肽显著提高了育肥牦牛的平均日增重,显著降低了料重比[5];大豆肽显著提高了泌乳奶牛的产奶量和乳蛋白产量[2];大豆肽还显著提高了肉鸡胸肌的pH,降低了失水率,改善了肉色[12]。小麦低聚肽具有较好的调节免疫、抗氧化、调控神经系统等作用[6,13]。本研究结果表明,小麦低聚肽具有改善小尾寒羊屠宰性能与肉品质的作用。
本试验中,饲喂小麦低聚肽虽没有显著影响小尾寒羊的宰前活重、胴体重、屠宰率,但显著增加了背膘厚度。此外,与对照组相比,试验组小尾寒羊背最长肌蒸煮损失有降低的趋势,失水率显著降低,综合失水率与蒸煮损失指标可以反映肌肉的保水能力[14],说明小麦低聚肽增强了肌肉的保水能力,对肉的保鲜具有促进作用。包志碧[15]指出,肉羊胴体背膘厚度的增加有助于降低肌肉水分的流失,本试验结果也间接证明了此观点。失水率也是反映肉风味的重要指标,失水率升高导致水分流失增加,则会降低肉的风味[16]。剪切力是反映肉嫩度的指标,也与肉的保水能力相关,剪切力降低则嫩度提高。研究表明,饲粮添加8 g/d抗菌肽显著降低了荷斯坦公牛背最长肌的剪切力[17]。本试验中,饲喂小麦低聚肽显著降低了小尾寒羊背最长肌的剪切力,说明小麦低聚肽有助于提高羊肉的嫩度。
肉色指标不仅体现了肌肉的外观及理化特性,还可反映肌肉的营养特性。肉色指标中的L*值反映了肌肉的光泽、亮度,并与肌肉的保水性呈负相关[18],a*值反映了肌肉中肌红蛋白的含量,b*值反映了肌肉中脂肪以及色素的沉积情况。本试验中,饲喂小麦低聚肽并未显著改变小尾寒羊背最长肌的L*值,但其在数值上有降低的趋势,可能与肌肉的保水性增加有关。背最长肌a*值未发生显著变化但b*值显著增加,提示小麦低聚肽虽未影响肌肉肌红蛋白的代谢,但可能影响肌肉脂肪酸的氧化,从而降低羊肉品质;羊肉pH45 min未受饲喂小麦低聚肽的影响,且2组羊肉的pH45 min均在正常刚屠宰肉的pH范围内[19],同时小麦低聚肽并未影响羊肉的pH24 h,且2组羊肉的pH24 h均符合屠宰24 h时pH的正常范围[20]。
3.2 小麦低聚肽对小尾寒羊瘤胃菌群结构的影响
本试验经过16S rRNA高通量测序共得到1 154 592条序列,序列平均长度为420 bp,试验组与对照组的Coverage指数均超过了99%,说明测序深度合理,能够准确地反映出瘤胃中细菌群落结构和种类的多样性[21]。Shannon指数和Simpson指数可以用来评价瘤胃菌群的多样性,Chao指数和Ace指数可以用来评价瘤胃菌群的丰富度。本试验结果提示,饲喂小麦低聚肽对小尾寒羊瘤胃菌群的alpha多样性无显著影响。这与前人研究结果相近,黎凌铄等[22]利用小肽与酵母培养物饲喂牦牛,对牦牛瘤胃微生物Shannon指数、Simpson指数、Chao指数和Ace指数无显著影响。
拟杆菌门和厚壁菌门是反刍动物瘤胃中的优势菌门[1,23]。本试验结果表明,拟杆菌门和厚壁菌门均为各组小尾寒羊瘤胃中的优势菌门,说明小麦低聚肽并未改变小尾寒羊瘤胃优势菌门的构成。拟杆菌门对瘤胃内非纤维物质降解具有重要作用[24],饲喂小麦低聚肽使瘤胃中拟杆菌门的相对丰度呈上升趋势,推测小麦低聚肽可能具有促进饲粮中非纤维物质降解的作用。陈芸[25]在山羊饲粮中添加复合菌肽,发现复合菌肽能够通过提高拟杆菌门和厚壁菌门的相对丰度,综合提高瘤胃对饲料的降解率。有研究指出,与蛋白质和碳水化合物降解有关的普雷沃氏菌属是瘤胃中的主要优势菌属[26]。本试验中,对照组与试验组小尾寒羊瘤胃内的第一优势菌属均为理研菌科RC9肠道群,第二优势菌属均为普雷沃氏菌属1。该结果与杜红喜[27]的研究发现一致,即小尾寒羊瘤胃内的优势菌属为理研菌科RC9肠道群和普雷沃氏菌属1。此外,小麦低聚肽并未改变小尾寒羊瘤胃内优势菌属的相对丰度和顺序。但有研究表明,饲粮中添加大豆肽显著增加了奶牛瘤胃中理研菌科RC9肠道群的相对丰度[2]。另有研究指出,在育肥湖羊饲粮中添加800 g/t蜜蜂肽,瘤胃内的第一优势菌属由普雷沃氏菌属1变为理研菌科RC9肠道群,而低剂量(200和400 g/t)添加800 g/t蜜蜂肽并无此现象[28]。本试验与上述研究结果不一致的可能原因是肽的来源与氨基酸组成不同。
瘤胃菌群结构的变化与畜禽生产性能和肉品质的改变紧密相关[14]。理研菌科RC9肠道群是促乙酸产生菌,与结构性碳水化合物发酵相关[29]。本试验中,添加小麦低聚肽后,小尾寒羊瘤胃中理研菌科RC9肠道群的相对丰度未发生显著变化,加之拟杆菌门的相对丰度呈上升趋势,表明小麦低聚肽可能通过调控瘤胃菌群结构来加强瘤胃对非纤维类物质的消化。结合本课题前期研究发现的小麦低聚肽可提高小尾寒羊的营养物质消化率,增加育肥前期的平均日增重并降低料重比[8],加之本试验中小麦低聚肽的添加增加了背膘厚度,而背膘厚度体现了机体脂肪的沉积情况,与机体瘦肉率呈负相关,提示小麦低聚肽可能通过调控瘤胃菌群结构进而改善小尾寒羊的生长性能和营养物质沉积代谢规律。由于本试验未观测机体脂肪沉积情况,因此上述推测尚需进一步研究证实。
4 结 论
饲粮中添加小麦低聚肽可增加小尾寒羊的背膘厚度,改善羊肉的嫩度和保水能力,同时有提高瘤胃中拟杆菌门相对丰度的趋势。
