肥育安格斯阉牛血清瘦素与剩余采食量、生长性能和脂代谢指标的表型关系
2023-12-04叶柏平阿茹娜崔晓婧胡三龙周治宇李冬冬周振明
李 伟 李 想 叶柏平 阿茹娜 崔晓婧 胡三龙 周治宇 程 阳 李冬冬 吴 浩 周振明
(中国农业大学动物科技学院,动物营养学国家重点实验室,北京 100193)
剩余采食量(residual feed intake,RFI)是动物实际采食量与其基于维持能量需求和生长速率的预测采食量之间的差值,是一个负向选择性状,且具有较高的遗传力[1-3],RFI越低,动物饲料效率越高[4]。瘦素主要在脂肪细胞中产生,通过与下丘脑瘦素受体相互作用,调节采食量、体重及能量消耗,且血清瘦素含量与体重、食物摄取量和体脂有关[5-6]。鉴于瘦素的生物学特性及其对干物质采食量(dry matter intake,DMI)的调节作用以及血浆生物标志物的高灵敏度和高特异性,瘦素有可能被用作肉牛采食量、生长和饲料效率等生产性状的生物标志物。以往研究表明,育肥肉牛的血清瘦素含量与RFI呈正相关[7-9],低剩余采食量(low residual feed intake,LRFI)内洛尔(Nellore)公牛血浆循环瘦素及其基因表达量更多[10],LRFI阉牛脂肪组织瘦素mRNA表达量更高[11]。然而,也有研究认为,瘦素和RFI之间没有明确相关性[12]。此外,血清瘦素参与糖和脂代谢、能量消耗及炎症反应等多种生物过程的调节[13]。尽管前人对瘦素的生理作用进行了大量的研究,但对瘦素与反刍动物的生长性能或饲料效率和表型的关系尚无定论,因此本试验旨在通过评估肥育肉牛血清瘦素含量与生长性能和脂代谢指标之间的表型关系,为后续血清瘦素作为生物标志物在肉牛生产上的应用提供理论依据。
1 材料与方法
1.1 饲养管理
选取60头体况良好、健康的640~720日龄安格斯肥育阉牛[(634.4±53.35) kg],随机分配到带有采食量自动记录系统(上海正宏农牧机械设备有限公司)的4个围栏中进行圈养饲养,每个围栏设有10个采食槽,测定每头肉牛每日的实际采食量。预试期14 d,正试期63 d。试验期间肉牛自由采食,充足饮水。每天08:00和16:00投喂2次,每4周采集1次饲料样品,60 ℃烘48 h制备风干样,测定常规营养成分含量。每7 d采集2次全混合日粮(total mixed ration,TMR)和剩料样本,105 ℃烘干24 h,用于测定其干物质含量,并计算肉牛每日DMI。根据NASEM(2016)[14]生长肥育牛日营养需要量和饲粮评估肉牛营养需要配制试验期饲粮,基础饲粮组成及营养水平见表1。干物质和粗蛋白质含量的测定参照AOAC(2000)[15],中性洗涤纤维含量的测定参照Van Soest等[16]的方法。

表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the basal diet (air-dry basis) %
1.2 试验设计
在正试期的第1、2、31、32、62和63天晨饲前对肉牛进行称重并记录体重数据,计算平均日增重(ADG);根据采食量自动记录系统采集每头牛每日的采食量,结合测定的饲粮干物质含量计算DMI;利用DMI和ADG计算增重饲料比(gain to feed ratio,G/F)。通过对每头肉牛的DMI、中期代谢体重(mid-trial metabolic weight,MMW)以及ADG进行线性回归分析,计算每头肉牛预测的DMI,再用预测的DMI减去实际的DMI得到每头肉牛的RFI[17]。根据RFI的数值大小将这些肉牛分为高剩余采食量(high residual feed intake,HRFI)(RFI>平均值+0.5标准差)肉牛和LRFI(RFI<平均值-0.5标准差)肉牛,采集上述肉牛的血液和瘤胃液,检测血清瘦素含量、脂代谢指标、血清生化指标及瘤胃发酵参数,并通过t检验和相关性分析比较HRFI肉牛和LRFI肉牛的生长性能、血清生化参数、脂代谢指标和瘤胃发酵参数的差异以及血清瘦素含量、RFI和脂代谢指标之间的关系。相关计算公式如下:
ADG(kg/d)=(终末体重-初始体重)/试验天数;
DMI(kg)=日采食量×饲粮干物质含量;
G/F=ADG/DMI;
RFI=β0+β1MMW+β2ADG-DMI;
MMW=MidtestBW0.75。
式中:β0为线性回归方程截距;β1为试验MMW的回归系数;β2为ADG的回归系数;DMI为肉牛实际DMI;MidtestBW为肉牛试验中期体重。
1.3 样品及数据采集
在饲养试验结束后,第64天,通过口腔胃管于晨饲前采集待测动物的瘤胃液,舍弃前段瘤胃液,用医用纱布过滤,然后置于螺纹冻存管中,于液氮中储存。通过尾根静脉采集动物的血液样本,静置30 min后,4 ℃低温4 000 r/min离心10 min,离心结束后取血清分装于0.5 mL的离心管中,-20 ℃冷冻保存,用于测定血清瘦素含量以及血清生化和抗氧化指标;在背中线左侧5 cm倒数第1肋和第2肋之间,通过超声诊断仪(ECM ref. 90-1119,Exago)评估牛背膘厚度和眼肌面积。
1.4 测定指标及方法
1.4.1 血清瘦素含量及脂肪沉积和蛋白质代谢相关指标测定
血清瘦素含量采用酶联免疫吸附试验(ELISA)法,使用瘦素放射免疫试剂盒(KJHE-000301B,北京康佳宏原生物科技有限公司)通过Multiskan MK12酶标仪(Thermo Fisher Scientific)测定;血清游离脂肪酸(non-esterified fatty acid,NEFA)含量通过微板法(A042-2-1试剂盒,南京建成生物工程研究所)使用分光光度计[Unico7200,尤尼柯(上海)仪器有限公司]测定;血清高密度脂蛋白(high-density lipoprotein,HDL)、低密度脂蛋白(low-density lipoprotein,LDL)、极低密度脂蛋白(very low-density lipoprotein,VLDL)、总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、葡萄糖(glucose,GLU)、总蛋白(total protein,TP)、白蛋白(albumin,ALB)、球蛋白(globulin,GLB)和尿素氮(urea nitrogen,UN)含量使用全自动生化检测仪(日立7600)检测。
1.4.2 血清生化指标
血清生化指标采用全自动生化检测仪(日立7600)测定,测定指标包括血清碱性磷酸酶(alkaline phosphatase,ALP)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)活性以及总胆红素(total bilirubin,TBiL)、肌酐(creatinine,CREA)含量。
1.4.3 血清抗氧化指标
血清抗氧化指标采用比色法,使用试剂盒(南京建成生物工程研究所)测定,测定指标包括总超氧化物歧化酶(total superoxide dismutase,T-SOD)和总抗氧化能力(total antioxidant capacity,T-AOC)。
1.4.4 瘤胃发酵参数
采用pH计(PHS-3C,上海雷磁仪器厂)测定pH;采用苯酚-次氯酸钠比色法测定氨态氮(ammonia nitrogen,NH3-N)含量[18];采用气相色谱法测定挥发性脂肪酸(volatile fatty acid,VFA)含量[19];微生物蛋白(microprotein,MCP)含量参考Makkar等[20]的考马斯亮蓝法,使用酶标仪(AW-87,北京科动力仪器有限公司)测定。
1.5 数据统计分析
使用Excel 2019软件对数据进行初步整理,使用SAS 9.4软件进行t检验,并使用R语言4.2.3进行相关性分析和热图制作。P<0.05表示差异显著,P<0.01表示差异极显著,0.05≤P<0.10表示差异有显著趋势。
2 结 果
2.1 RFI对安格斯肉牛生长性能的影响
由表2可知,LRFI肉牛和HRFI肉牛间初始体重、终末体重、MMW和ADG差异不显著(P>0.05),LRFI肉牛RFI和DMI极显著低于HRFI肉牛(P<0.01),LRFI肉牛G/F极显著高于HRFI肉牛(P<0.01)。
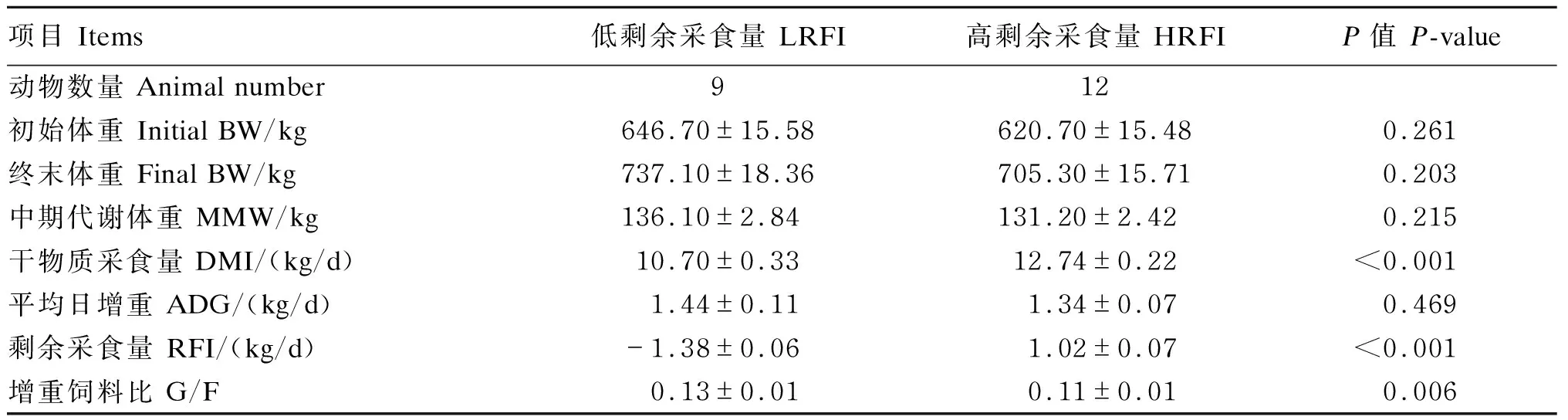
表2 RFI对安格斯肉牛生长性能的影响Table 2 Effects of RFI on growth performance of Angus beef cattle
2.2 RFI对安格斯肉牛血清瘦素含量及脂肪沉积和蛋白质代谢相关指标的影响
由表3可知,LRFI肉牛血清瘦素含量和眼肌面积显著高于HRFI肉牛(P<0.05),背膘厚度以及血清LDL和VLDL含量极显著低于HRFI肉牛(P<0.01),血清HDL、NEFA、TC、TG、GLU、TP、ALB、GLB和UN含量以及白球比(A/G)与HRFI肉牛均无显著差异(P>0.05)。

表3 RFI对安格斯血清瘦素含量及脂肪沉积和蛋白质代谢相关指标的影响Table 3 Effects of RFI on serum leptin content and fat deposition and protein metabolism related indices of Angus beef cattle
2.3 RFI对安格斯肉牛血清生化和抗氧化指标的影响
由表4可知,LRFI肉牛血清ALP活性有低于HRFI肉牛的趋势(P=0.074),血清ALT活性有高于HRFI肉牛的趋势(P=0.055),其他血清生化和抗氧化指标与HRFI肉牛差异均不显著(P>0.05)。

表4 RFI对安格斯肉牛血清生化和抗氧化指标的影响Table 4 Effects of RFI on serum biochemical and antioxidant indices of Angus beef cattle
2.4 RFI对安格斯肉牛瘤胃发酵参数的影响
由表5可知,不同RFI肉牛间瘤胃pH以及NH3-N、总挥发性脂肪酸(total volatile fatty acid,TVFA)、乙酸、丙酸、丁酸、戊酸、异丁酸和异戊酸含量均无显著差异(P>0.05)。LRFI肉牛瘤胃MCP含量显著高于HRFI组(P<0.05),瘤胃乙酸(P=0.086)和乙酸/丙酸(A/P)值(P=0.084)有高于HRFI肉牛的趋势,瘤胃异戊酸(P=0.050)和戊酸(P=0.066)含量有低于HRFI肉牛的趋势。

表5 RFI对安格斯肉牛瘤胃发酵参数的影响Table 5 Effects of RFI on rumen fermentation parameters of Angus beef cattle
2.5 相关性分析
如图1所示,RFI与DMI、背膘厚度以及血清LDL和VLDL含量呈显著正相关(P<0.05),与G/F、血清瘦素含量、眼肌面积、血清ALT活性以及瘤胃MCP含量呈显著负相关(P<0.05);血清瘦素含量与RFI、背膘厚度以及血清VLDL和GLU含量呈显著负相关(P<0.05),与G/F和血清CREA含量呈显著正相关(P<0.05)。

RFI:剩余采食量 residual feed intake;ADG:平均日增重 average daily gain;MMW:中期代谢体重 mid-trial metabolic weight;DMI:干物质采食量 dry matter intake;G/F:增重饲料比 gain to feed ratio;LEP:瘦素 leptin;BF:背膘厚度 backfat thickness;LM:眼肌面积 loin muscle aera;NEFA:游离脂肪酸 non-esterified fatty acid;HDL:高密度脂蛋白 high-density lipoprotein;LDL:低密度脂蛋白 low-density lipoprotein;VLDL:极低密度脂蛋白 very low-density lipoprotein;TC:总胆固醇 total cholesterol;TG:甘油三酯 triglyceride;GLU:葡萄糖 glucose;UN:尿素氮 urea nitrogen;TP:总蛋白 total protein;ALB:白蛋白albumin;GLB:球蛋白 globulin;A/G:白球比 albumin/globulin;ALT:丙氨酸氨基转移酶 alanine aminotransferase;AST:天冬氨酸氨基转移酶 aspartate aminotransferase;ALP:碱性磷酸酶 alkaline phosphatase;TBiL:总胆红素 total bilirubin;CREA:肌酐 creatinine;T-SOD:总超氧化物歧化酶 total superoxide dismutase;T-AOC:总抗氧化能力 total antioxidant capacity;NH3-N:氨态氮 ammonia nitrogen;MCP:微生物蛋白 microprotein;TVFA:总挥发性脂肪酸 total volatile fatty acid;Acetate:乙酸;Propionate:丙酸;A/P:乙酸/丙酸 acetate/propionate;Isobutyrate:异丁酸;Butyrate:丁酸;Isovalerate异戊酸;Valerate:戊酸。图1 每个表型的成对相关的皮尔逊相关系数热图Fig.1 Heatmap of Pearson’s correlation coefficient of pairwise correlation of each phenotype
3 讨 论
3.1 血清瘦素与RFI、生长性能和脂代谢相关指标的关系
血清瘦素是一种由脂肪细胞产生的激素,其主要功能是通过调节食欲和能量代谢来维持体重平衡[21],是肉牛DMI的潜在调控分子,但其与RFI的关系尚不明确。本研究观测到,与HRFI肉牛相比,LRFI肉牛的RFI和DMI显著降低,G/F显著提高,这与前人的试验结果[22-24]一致。此外,本试验显示血清瘦素含量与RFI呈负相关关系,即LRFI肉牛血清瘦素含量更高;而且,血清瘦素含量与G/F呈正相关关系,即G/F高的肉牛血清瘦素含量更高。2种饲料效率的衡量指标结果都表明,饲料效率高的肉牛血清瘦素含量更高,这表明血清瘦素含量有作为筛选LRFI或高饲料效率肉牛生物标志物的潜力。
LRFI动物脂肪沉积更少,血液循环胆固醇含量降低[25],并且能够更有效地利用能量[26]和蛋白质[27-28]。在Taussat等[29]对夏洛莱牛的研究中,RFI与肌肉含量呈负相关,与脂肪含量呈正相关,这与本试验观测到的LRFI肉牛更薄的超声背膘厚度、更大的超声眼肌面积以及更高的瘤胃MCP含量和血清TP含量结果一致。血清VLDL及其脂解转化产物LDL是与脂质代谢相关的指标,分别在肠道和肝脏中产生,在血流中运输大部分胆固醇和TG[30]。由相关性分析得出,血清瘦素含量与RFI、背膘厚度和血清VLDL含量呈显著负相关,RFI与DMI、背膘厚度以及血清LDL和VLDL含量呈显著正相关。即血清瘦素含量高的肉牛脂肪沉积水平更低(更薄的背膘厚度和更低的血清VLDL含量),胆固醇和TG外周转运更少;同时,血清瘦素含量更高的肉牛饲料效率更高,DMI更低,这可能是由于在没有瘦素抵抗的情况下,瘦素能够有效地减少食物摄入并增加能量消耗,从而减少脂质积累[31],并促进骨骼肌脂质代谢的分解代谢调节和脂肪酸的利用,以产生能量并减少肌内脂质积累[32]。这论证了瘦素对采食量和脂肪沉积的调控作用[33]。然而,有一些研究认为,血清瘦素含量与RFI呈正相关[7-9],还有研究认为瘦素与RFI之间没有相关性[12,34]。这可能与过度肥胖而产生的瘦素耐受有关,即对较大比例的身体脂肪,产生的瘦素含量升高也无法控制饥饿和调节身体脂肪[35]。
3.2 RFI与瘤胃发酵参数的关系
瘤胃发酵参数与RFI之间存在一定的关系,但受到多种因素的影响。Guan等[36]报道称,LRFI肉牛瘤胃TVFA含量更高,瘤胃丁酸和戊酸含量也更高;梁玉生[37]研究表明,LRFI育肥湖羊瘤胃丙酸含量较高,且瘤胃A/P值较低,瘤胃发酵趋于丙酸型发酵。也有研究表明,瘤胃发酵参数与RFI不存在显著相关关系,反而是饲粮组成对瘤胃细菌发酵的影响更加重要[38-39]。本研究表明,不同RFI肉牛瘤胃发酵参数除MCP含量外均无显著差异,LRFI肉牛瘤胃乙酸含量和A/P值有高于HRFI肉牛的趋势,瘤胃异戊酸和戊酸含量有低于HRFI肉牛的趋势。针对这一结果,笔者认为TVFA和NH3-N结果的差异可能是由于口腔胃管插入瘤胃位置的不同而导致的,采样部位可能是造成经由口腔胃管获得的瘤胃液发酵参数差异的主要因素。与中央或腹侧瘤胃相比,颅背侧瘤胃的pH及氨和钠含量显著提高,乙酸、丙酸和丁酸含量显著降低[40]。由于口腔胃管无法精确控制探头所在的位置,因而得出的TVFA和NH3-N可能无法在同一水平上反映不同RFI肉牛的瘤胃发酵差异。具体VFA含量的差异则可能与饲粮类型有关。McGovern等[39]研究发现,在生长阶段采用高精料饲粮育肥时,LRFI肉牛瘤胃丙酸和TVFA含量较低,这与本文结果一致。而当提供青贮饲料作为饲粮时,HRFI和LRFI牛之间没有任何代谢物含量的差异,即对于TVFA含量与RFI之间的关系,饮食阶段、年龄和品种是潜在的混杂因素,而RFI和瘤胃发酵特征之间的关联并无显著相关性。此外,本研究发现LRFI肉牛瘤胃MCP含量更高,MCP是反刍动物易于消化吸收利用的优质蛋白,能够提供肉牛生长所需代谢蛋白质的50%乃至全部[41-42]。因此,笔者认为LRFI肉牛瘤胃细菌对饲粮营养物质的消化能力更强,消化每单位营养物质为肉牛提供的MCP也更多。
综上可知,血清瘦素与RFI、生长性能和脂肪沉积存在着密切的关系。血清瘦素含量高的肉牛RFI更低,饲料效率更高,生长性能更佳,DMI更低,脂肪沉积指标更低,其有可能成为快速筛选LRFI肉牛的生物标志物。同时,血清瘦素对饲料效率和脂代谢的具体调控机制值得进一步探索,由于血清瘦素含量在喂养期间会发生变化,并且受到动物性别的影响,因此通过多次采样测定血清瘦素含量的平均值和通过屠宰试验测定胴体组成可能是必要的。
4 结 论
① 与HRFI肉牛相比,LRFI肥育安格斯肉牛在相似的ADG和MMW条件下表现出更低的DMI、更高的血清瘦素含量、更薄的背膘厚度、更大的眼肌面积、更高的瘤胃MCP含量和G/F以及更低的血清载脂蛋白含量。
② 血清瘦素含量与RFI、背膘厚度以及血清VLDL和GLU含量呈负相关,与G/F和血清CREA含量呈正相关;RFI与DMI、背膘厚度以及血清LDL和VLDL含量呈正相关,与G/F、血清瘦素含量、眼肌面积、血清ALT活性以及瘤胃MCP含量呈负相关。
③ 血清瘦素含量可以作为筛选LRFI安格斯肉牛的潜在生物标志物。
