燕麦草在奶牛瘤胃中的降解规律与黏附细菌区系变化
2023-12-04郑会超郭晓辉蒋永清孙富祥
郑会超 郭晓辉 蒋永清 孙富祥 孙 伦
(1.浙江省农业科学院畜牧兽医研究所,杭州 310021;2.杭州萧山富伦奶牛场,杭州 311251)
反刍动物瘤胃内含有众多微生物,包括细菌、原虫和真菌,这些微生物可产生纤维素酶和半纤维素酶,并可降解反刍动物采食的饲料,其中细菌对将饲料转化为挥发性脂肪酸和微生物蛋白贡献最多[1]。此前的一项研究表明,微生物附着在牧草上是牧草降解过程中的关键步骤,超过70%的瘤胃微生物附着在瘤胃的固态内容物当中[2]。因此,研究饲料在瘤胃中黏附的细菌区系和降解曲线对于提高瘤胃饲料利用效率至关重要。许多研究表明,瘤胃微生物可迅速黏附于摄入的饲料颗粒并定植[3-4];另一些研究表明,饲料种类和培养时间对定植微生物群的多样性、组成、结构和潜在功能有显著影响[5-6]。然而,尽管黏附的瘤胃微生物群落受饲料种类的影响,但这些研究大多数没有检测宿主瘤胃微生物群落。燕麦草是奶牛的主要粗饲料来源之一,我国的燕麦草每年的进口量超过20万t。目前已有关于稻草、麦秸、苜蓿、黑麦草及柳枝稷等在瘤胃中的动态降解与黏附细菌变化的研究[4,7-9],但鲜有燕麦草的相关研究报道。因此,本研究拟采用尼龙袋法研究燕麦草在瘤胃中的动态降解与黏附细菌变化情况,同时检测宿主瘤胃微生物区系构成,以进一步丰富粗饲料降解过程中黏附细菌区系的基础数据库,为深入理解瘤胃微生物与饲料底物的互作机制以及提高反刍动物的饲料利用率提供理论依据和实践指导。
1 材料与方法
1.1 试验动物
本试验在杭州市临安区正兴牧业牧场进行,使用3头经产泌乳后期荷斯坦瘘管奶牛,拴系饲养,并饲喂相同的饲粮[(15.2±0.9) kg/d全混合日粮(TMR)和(1.7±0.6) kg/d羊草)。TMR包含[干物质(DM)基础]:14.0%玉米青贮饲料、10.0%啤酒糟、9.6%苜蓿干草、6.6%甜菜颗粒、5.9%燕麦草、6.6%稻草、20.6%玉米、11.8%豆粕、5.9%棉籽粕、2.5%膨化大豆、2.0%菜籽粕和4.5%预混料。每天08:00和15:00各饲喂奶牛1次,自由饮水。预试期30 d,正试期3 d。
1.2 试验设计和样品收集
将燕麦草在60 ℃下烘干,粉碎过10目的筛网,将粉碎的燕麦草用分析天平称重后放入8 cm×12 cm的尼龙袋中(5.0 g/袋),尼龙袋孔隙为38.5 μm。将108只尼龙袋均分成3份并放入用棉绳系好的大网袋(20 cm×30 cm)中,在晨饲前分别放入3头瘘管牛的瘤胃中。分别在2、6、12、24、48和72 h从每头瘘管牛瘤胃内取出6只尼龙袋,将其中4只尼龙袋用自来水冲洗直到水变得清澈,然后用手挤压尼龙袋以去除多余的水,并用于营养成分降解分析;剩余2只尼龙袋用磷酸盐缓冲液(PBS,pH 7.4)冲洗以除去松散附着的微生物,分装后置入液氮中冷冻保存。正试期第3天06:00、10:00、13:00和17:00共4个时间点通过瘘管人工采集瘤胃食糜2 kg左右,人工混合均匀后采样,然后立即将样本冷冻在液氮中。样本转入实验室后存放在-80 ℃冰箱,直到提取DNA。
1.3 燕麦草及其降解残渣营养成分分析
燕麦草及其降解残渣的DM含量采用恒温鼓风干燥箱在105 ℃下烘干测定,中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)含量分别通过中性和酸性洗涤溶液测定[10]。
1.4 细菌DNA提取和实时荧光定量PCR
通过磁珠和苯酚-氯仿-异戊醇提取方法提取DNA[11]。采用50 mL Tris-乙二胺四乙酸(EDTA)缓冲液洗脱DNA,并采用NanoDrop 1000分光光度计(Nyxor Biotech,法国)测定其浓度,然后采用ABI7300实时荧光定量PCR仪和SYBR试剂盒进行实时荧光定量PCR。本研究使用的通用细菌引物及序列如下[12]:上游引物,5′-CCTACGGGAGGCAGCAG-3′;下游引物,5′-ATTACCGCGGCTGG-3′。每次试验做3个重复,通过对细菌克隆的纯化质粒DNA进行10倍的连续稀释来制备外部标准品,结果以降解后的燕麦草残渣每克鲜重标记基因拷贝数表示。
1.5 细菌Illumina MiSeq测序和数据处理
根据Behrendt等[13]的研究,细菌16S rRNA基因的V3~V4区域的PCR扩增使用细菌通用引物(341F,5′-CCTAYGGGRBGCASCAG-3′;806R,5′-GGACTACNNGGGTATCTAAT-3′)进行。PCR扩增子测序在北京奥维森基因科技有限公司的Illumina MiSeq PE300平台(Illumina,Inc.,美国)上进行。原始数据以登录号为SRP110222的形式提交到NCBI序列读取档案,然后使用QIIME 1.80软件包进行处理。经过质量过滤和配对端连接后,使用uParse算法将序列聚类为操作分类单元(OTU)。利用Silva 128数据库对OTU代表性序列从门到属进行物种注释,在QIIME 1.80软件中进行alpha多样性指数分析,并在RStudio(http://www.rstudio.org)中进行偏最小二乘判别分析(PLS-DA)。
1.6 数据统计分析
干物质降解率(DMD)、中性洗涤纤维降解率(NDFD)和酸性洗涤纤维降解率(ADFD)数据通过SPSS 16.0的一般线性模型(GLM)程序进行分析,不同时间点降解率通过Duncan氏法进行多重比较。同样,通过单因素方差分析,衡量细菌基因拷贝数和alpha多样性指数随时间的线性变化。采用RStudio(http://www.rstudio.org)中Kruskal-Wallis检验的非参数Scheirer-Ray-Hare扩展对不同时间点细菌群落相对丰度进行多重比较,显著性定义为P<0.05。
2 结果与分析
2.1 燕麦草的营养成分与瘤胃降解率
本试验采用的燕麦草在风干条件下营养成分如下:DM含量为89.0%,粗蛋白质(CP)含量为5.8%,NDF含量为55.4%,ADF含量为33.6%,粗灰分含量为6.0%。燕麦草在瘤胃中的动态降解率见表1,培养时间显著影响燕麦草DMD、NDFD和ADFD(P<0.05)。其中,燕麦草DM在2 h时快速降解23.4%,之后随着时间延长,DMD逐渐提高,至72 h时燕麦草DMD近49%。燕麦草NDF和ADF降解曲线略有不同,NDFD在2~6h和6~12 h无显著差异(P<0.05),出现滞后期;ADFD在6~12 h出现滞后期;但是NDFD和ADFD在12 h后各时间点均有显著差异(P<0.05)。综上可知,燕麦草的DM降解呈现2个阶段,NDF和ADF的降解则呈现3个阶段。
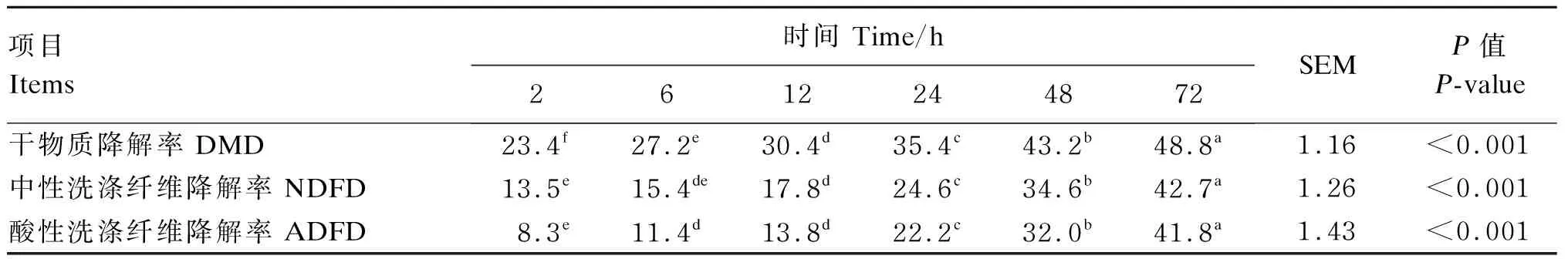
表1 燕麦草在瘤胃中的动态降解率Table 1 Dynamic degradation rate of oat grass in rumen %
2.2 定植在燕麦草及瘤胃的细菌群落
由表2可知,瘤胃内定植的细菌总数(细菌拷贝数)以及alpha多样性指数大于定植在燕麦草上的细菌总数。由表3可知,在燕麦草上定植的微生物群落与在瘤胃内定植的微生物群落有所不同,瘤胃内的优势菌门是厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes),而燕麦草上的优势菌门是变形菌门(Proteobacteria)。进一步分析发现,定植在瘤胃内的优势菌属为普雷沃氏菌属1(Prevotella_1),其次是理研菌科RC9肠道群(Rikenellaceae_RC9_gut_group)、克里斯滕森菌科R-7群(Christensenellaceae_R-7_group)、瘤胃球菌属1(Ruminococcus_1)、解琥珀酸菌属(Succiniclasticum)和Saccharofermentans,相对丰度分别为8.7%、8.7%、6.2%、5.9%、3.7%和2.5%,相对丰度>1.0%的瘤胃菌属还包括瘤胃球菌科UCG-005(Ruminococcaceae_UCG-005)、普雷沃氏菌科UCG-001(Prevotellaceae_UCG-001)、毛螺菌科NK3A20群(Lachnospiraceae_NK3A20_group)、密螺旋体属(Treponema)和丁酸弧菌属2(Butyrivibrio_2)等;而定植在燕麦草上的优势菌属为假单胞菌属(Pseudomonas)、泛生菌属(Pantoea)、Bromus_tectorum、Solitalea、明串珠菌属(Leuconostoc)、Rosenbergiella、类芽孢杆菌属(Paenibacillus)和鞘氨醇单胞菌属(Sphingomonas),相对丰度分别为17.3%、17.2%、10.4%、8.2%、3.2%、2.3%、1.9%和1.7%。

表2 定植在燕麦草及瘤胃的细菌群落16S rRNA拷贝数和alpha多样性指数Table 2 16S rRNA copy number and alpha diversity indices of bacterial communities colonized in oat grass and rumen
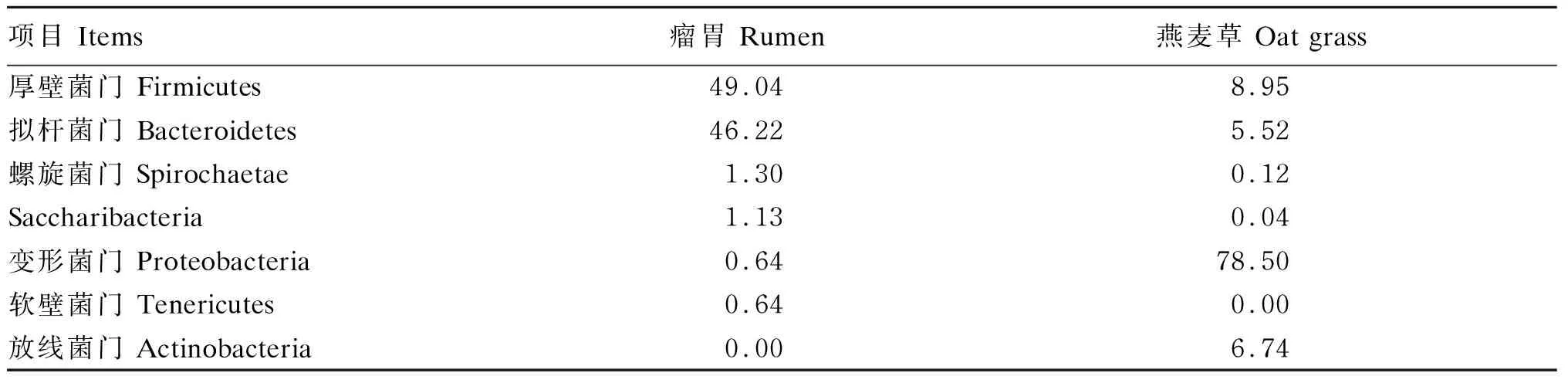
表3 定植在燕麦草及瘤胃的细菌在门水平上的相对丰度Table 3 Relative abundance of bacteria colonized in oat grass and rumen at phylum level %
2.3 燕麦草在瘤胃降解过程中黏附的细菌群落动态分析
30个样品经质量过滤后共保留了1 811 310条序列,其中大多数序列长度在400~440 bp;最终共鉴定出4 050个OTU,而相对丰度高于0.1%的OTU有225个。由表4可知,Good’s覆盖度均大于0.97,表明获得了合理的测序深度水平;培养时间会影响燕麦草在瘤胃降解过程中黏附的细菌群落的alpha多样性,观测物种数和Chao指数在72 h时低于2和6 h时(P>0.05);与燕麦草紧密黏附的细菌的Shannon指数在各时间点上无显著差异(P>0.05)。
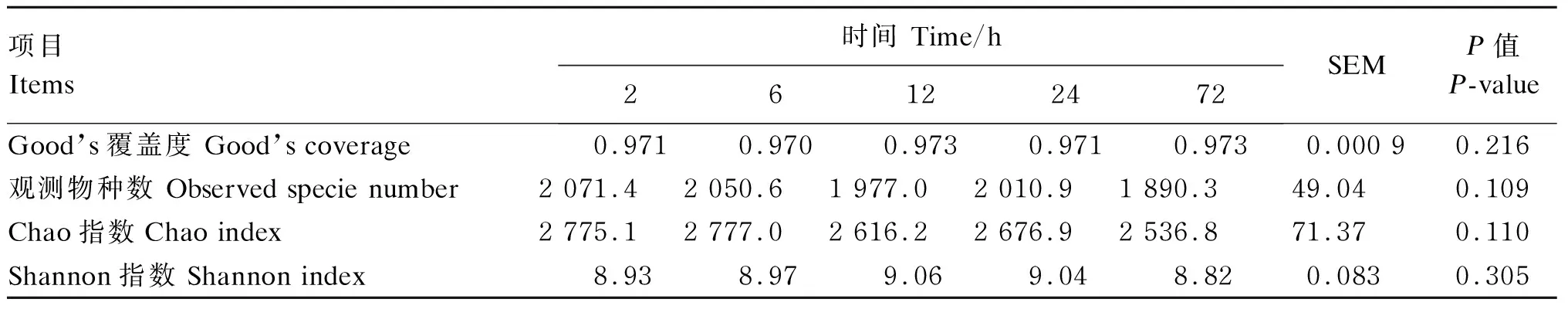
表4 燕麦草在瘤胃降解过程中黏附的细菌群落alpha多样性Table 4 Alpha diversity of bacterial community attached to oat grass during rumen degradation
由表3和图1可知,细菌16S rRNA高通量测序数据显示,燕麦草在瘤胃降解2 h时,其上定植的变形菌门和放线菌门(Actinobacteria)的相对丰度大幅下降且降至较低的水平,而一些菌群如厚壁菌门和拟杆菌门的相对丰度则提升到较高的水平。如图1-a所示,在门水平上,有10个门的菌群相对丰度超过0.1%;所有样本中相对丰度最高的菌门是厚壁菌门和拟杆菌门,分别占(49.2±5.5)%和(40.9±3.8)%,其余8个门相对丰度相对较低。此外,厚壁菌门和拟杆菌门的相对丰度随着培养时间的延长保持着相对稳定,而变形菌门、软壁菌门(Tenericutes)和SR1_Absconditabacteria的相对丰度随着培养时间的延长而降低,纤维杆菌门(Fibrobacteres)和螺旋菌门(Spirochaetae)的相对丰度则随着培养时间的延长而提高。
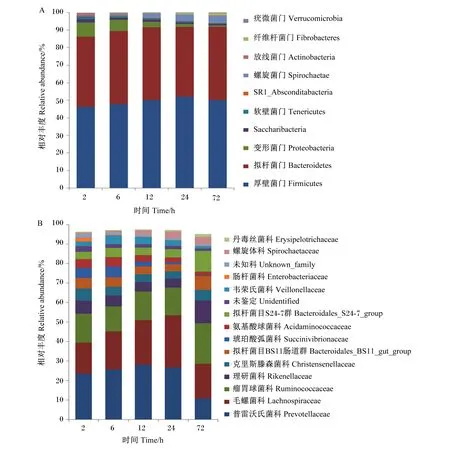
图1 燕麦草在瘤胃降解过程中黏附的细菌在门(a)和科(b)水平上的相对丰度Fig.1 Relative abundances of bacteria attached to oat grass during rumen degradation at phylum (a) and family (b) levels
在科水平上,燕麦草在瘤胃降解过程中至少有28个科的相对丰度超过0.1%。这28个科的总相对丰度为(99.3±0.1)%,且包括26个分类科和2个未确定的科,其中未确定的科的相对丰度为(3.1±1.0)%。如图1-b所示,瘤胃球菌科(Ruminococcaceae)和普雷沃氏菌科(Prevotellaceae)相对丰度在2~24 h保持稳定,72 h时相对丰度则分别提高和降低;肠杆菌科(Enterobacteriaceae)和未鉴定(unidentified)科在6 h时降低,而在6~72 h保持稳定;氨基酸球菌科(Acidaminococcaceae)和琥珀酸弧菌科(Succinivibrionaceae)相对丰度随着培养时间的延长先保持稳定,然后出现降低;拟杆菌目BS11肠道群(Bacteroidales_BS11_gut_group)和理研菌科(Rikenellaceae)相对丰度随着培养时间的延长呈现先降低后提高的变化趋势;韦荣氏菌科(Veillonellaceae)和毛螺菌科(Lachnospiraceae)相对丰度随着培养时间的延长呈现先提高后降低的变化趋势;克里斯滕森菌科(Christensenellaceae)相对丰度随着培养时间的延长基本没有变化。
由表5可知,在属水平上,共鉴定出31个属的相对丰度超过0.5%,而未鉴定属相对丰度占(19.8±3.5)%。其中,相对丰度最丰富的属是普雷沃氏菌属1,其次主要是克里斯滕森菌科R-7群、理研菌科RC9肠道群、瘤胃球菌科NK4A214群(Ruminococcaceae_NK4A214_group)、瘤胃球菌属1、解琥珀酸菌属、丁酸弧菌属2、Saccharofermentans、琥珀酸弧菌科UCG-002(Succinivibrionaceae_UCG-002)、密螺旋体属2(Treponema_2)和毛螺菌科NK3A20群等。黏附在燕麦草残渣上的主要菌属与定植在燕麦草和瘤胃的菌属相比对发现,绝大多数菌属来源于瘤胃内容物。

表5 燕麦草在瘤胃降解过程中黏附的细菌在属水平上相对丰度的变化Table 5 Changes in relative abundances of bacteria attached to oat grass during rumen degradation at genus level %
此外,普雷沃氏菌属1相对丰度在2~24 h保持稳定(P>0.05),而在72 h时显著降低(P<0.05);解琥珀酸菌属相对丰度起初保持稳定,然后随着培养时间的延长而显著降低(P<0.05);聚乙酸菌属(Acetitomaculum)和理研菌科RC9肠道群相对丰度随着培养时间的延长而出现显著变化(P<0.05),呈现先降低后提高的变化趋势;瘤胃球菌科菌属相对丰度随着培养时间的延长表现出不同的变化趋势,其中瘤胃球菌科NK4A214群相对丰度在2~24 h保持稳定,而瘤胃球菌属1相对丰度在12~24 h达到峰值;克里斯滕森菌科R-7群、丁酸弧菌属2、Candidatus_Saccharimonas和毛螺菌科XPB1014群(Lachnospiraceae_XPB1014_group)等相对丰度在2~72 h保持稳定,变化不显著(P>0.05)。
基于OTU水平对燕麦草在瘤胃降解过程中黏附的细菌群落进行PLS-DA,结果发现:可根据降解时间对燕麦草上黏附的细菌群落进行分离,共鉴定出4个组(图2)。燕麦草在瘤胃降解72 h时黏附的细菌群落与其他降解时间群落完全分离,24 h时黏附的细菌群落与2和6 h时完全分离,而燕麦草在瘤胃降解2、6和12 h时黏附的细菌群落未完全分离。
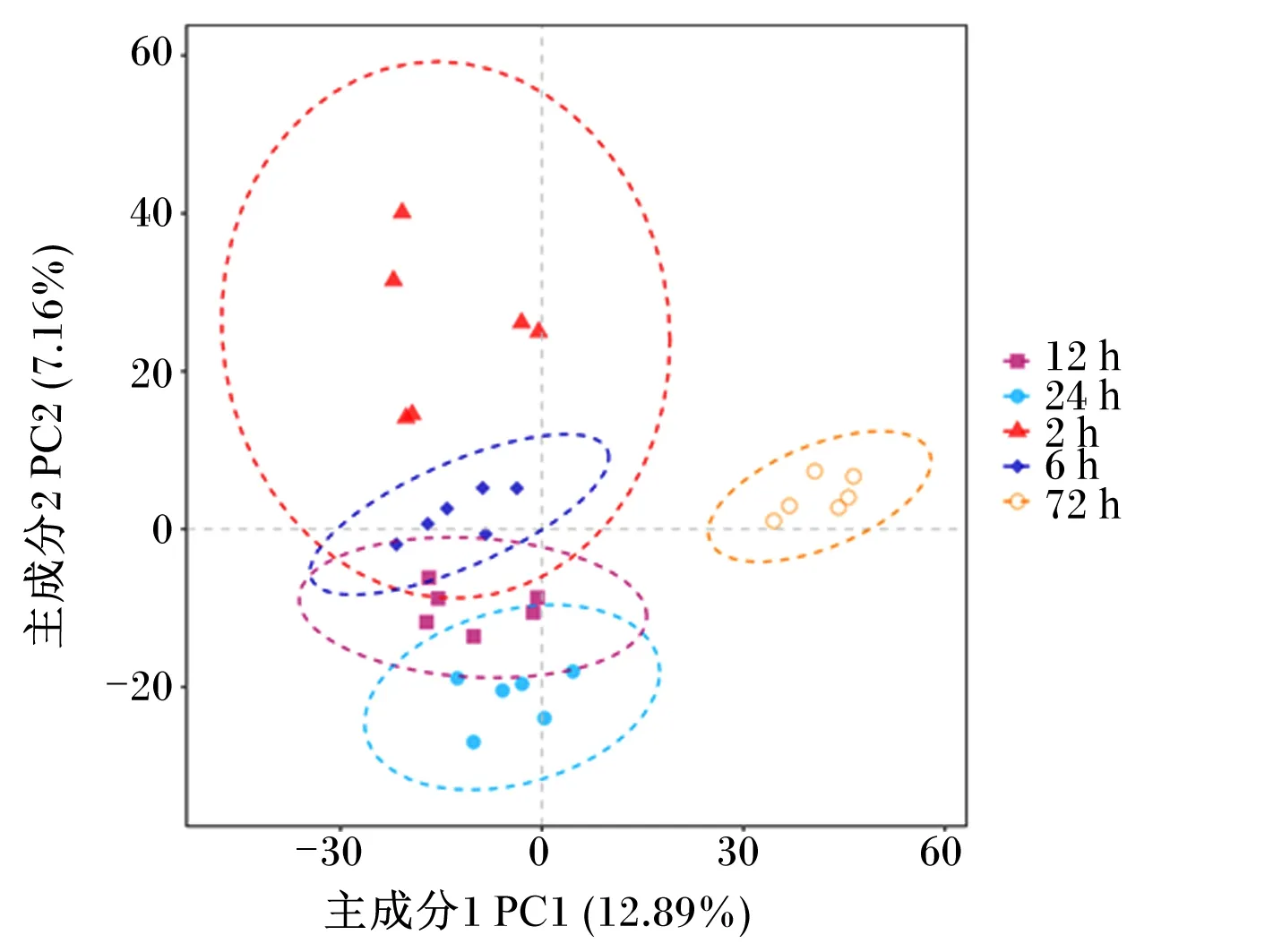
图2 基于 OTU水平的燕麦草在瘤胃降解过程中黏附的细菌群落PLS-DAFig.2 PLS-DA of bacterial community attached to oat grass during rumen degradation based on OTU levels
2.4 燕麦草DM、NDF和ADF含量与细菌群落的相关性
对燕麦草降解过程中的DM、NDF和ADF含量与优势菌属相关丰度进行相关分析,结果如图3所示,在属水平上,密螺旋体属2、Saccharofermentans、毛螺菌科AC2044群(Lachnospiraceae_AC2044_group)和丁酸弧菌属2与DM、NDF和ADF含量均呈显著负相关(P<0.05);理研菌科RC9肠道群相对丰度与NDF含量呈显著负相关(P<0.05);毛螺菌科XPB1014群相对丰度与ADF含量呈显著负相关(P<0.05);解琥珀酸菌属、琥珀酸弧菌科UCG-002、普雷沃氏菌属1、普雷沃氏菌科UCG-001和Candidatus_Saccharimonas相对丰度与DM、NDF和ADF含量呈显著正相关(P<0.05);月形单胞菌属1(Selenomonas_1)相对丰度与NDF含量呈显著正相关(P<0.05)。

根据Pearson相关系数对单元格进行着色,红色表示正相关,蓝色表示负相关。*表示显著相关(P<0.05),**表示极显著相关(P<0.01)。Cells were colored based on Pearson correlation coefficient, and red color and blue color indicated positive and negative correlation, respectively. * mean significantly correlated (P<0.05), and ** mean extremely significantly correlated (P<0.01).图3 燕麦草在瘤胃降解过程中营养成分含量与优势黏附菌属相对丰度的相关分析Fig.3 Correlation analysis between nutrient contents of oat grass and relative abundances of dominant attached genera during rumen degradation.
3 讨 论
在本研究中,燕麦草的NDF和ADF降解表现出3个阶段,且定植在燕麦草上的细菌群落随培养时间的延长发生显著变化。有研究表明,干稻草和苜蓿干草的降解时间曲线相似[4],但与新鲜多年生黑麦草的降解时间曲线明显不同[8]。干牧草降解的停滞期比新鲜牧草长。
许多研究表明,黏附在饲料表面的变形菌门在瘤胃内快速被厚壁菌门和拟杆菌门取代[4,7]。本研究也证实了这些转变。本研究还观察到细菌群落的时间变化与饲料降解之间存在正相关关系。随着饲料降解,细菌群落第2次转变的时间有所不同,具体取决于饲料种类。对于稻草和苜蓿草,在发酵6 h后观察到第2次转变[4];而对于柳枝稷,则在16 h后发生[7]。在本研究中,第2次转变发生在6 h后,第3次转变发生在24 h后,这大约是快速降解第2阶段的中间点。Jin等[9]也观察到小麦秸秆在24 h后的第3次转变。
本研究发现,普雷沃氏菌属1、理研菌科RC9肠道群、克里斯滕森菌科R-7群、瘤胃球菌属1和解琥珀酸菌属在发酵燕麦草上的细菌群落中占主导地位。这一发现与之前的研究结果[4]部分一致,即普雷沃氏菌属(Prevotella)、丁酸弧菌属(Butyrivibrio)、瘤胃球菌属(Ruminococcus)、纤维杆菌属(Fibrobacter)和密螺旋体属在瘤胃消化的水稻秸秆和苜蓿中占主导地位。Piao等[7]在新鲜多年生黑麦草定植的细菌群落中观察到普雷沃氏菌属、丁酸弧菌属、瘤胃球菌属和纤维杆菌属的相对丰度很高。这些研究表明,饲料类型显著影响附着在其上的微生物群落的组成和结构。值得注意的是,本研究的瘤胃优势菌属为普雷沃氏菌属1、理研菌科RC9肠道群、克里斯滕森菌科R-7群、瘤胃球菌属1、解琥珀酸菌属和Saccharofermentans,说明宿主瘤胃细菌群落也发挥了重要作用。
有研究表明,半纤维素、淀粉、木聚糖、果胶和蛋白质的降解均与普雷沃氏菌属有关[14-15]。有报道表明,瘤胃球菌属可在瘤胃中产生最大比例的纤维素酶以及大量的半纤维素酶和寡糖降解酶[14],其因高纤维降解能力而得名[16]。理研菌科是一个相对较新的细菌科,迄今为止对其在瘤胃中的代谢功能研究较少。之前的一项研究发现,在高脂肪饮食和高剂量染料木黄酮小鼠组中,理研菌科RC9肠道群相对丰度显著提高,表明其可能在脂质代谢中发挥重要作用[17]。
克里斯滕森菌科R-7群和丁酸弧菌属2的持续高丰度表明它们在饲料降解中起着重要作用。克里斯滕森菌科和丁酸弧菌属与甲烷排放量呈负相关,与可消化DM摄入量和可消化有机物摄入量呈正相关[18]。克里斯滕森菌科R-7群与参与氨基酸生物合成和能量底物代谢的代谢物呈正相关[19]。丁酸弧菌属还与牛瘤胃中寡糖的降解有关[14],该属还具有蛋白质水解和多糖降解活性[20-21]。
解琥珀酸菌属是本研究中另一个丰富的属,其与淀粉降解有关[22]。解琥珀酸菌属可以将琥珀酸转化为丙酸[23],因此其在瘤胃微生物群落中的高丰度表明会产生大量的琥珀酸。琥珀酸弧菌科也与淀粉降解有关[24],并且它被认为是一种生物标志物,表征反刍动物的肠道甲烷排放因子较低[25]。据报道,Saccharofermentans和密螺旋体属与纤维素降解有关[26-27]。密螺旋体属的出现可能与果胶的降解有关[28]。一些研究表明,在毛螺菌科和乙酸之间存在正相关关系[29]。
Fuma等[30]研究发现,纤维杆菌属是瘤胃中的主要纤维素分解菌。Liu等[4]观察到纤维杆菌属相对丰度与NDF含量呈正相关。而在本研究中,纤维杆菌的相对丰度相对较低。Jin等[9]也观察到经瘤胃发酵后小麦秸秆上定植的纤维杆菌的相对丰度相对较低。造成这种差异的原因可能是由于宿主瘤胃细菌中的纤维杆菌相对丰度较低。在饲喂高纤维饲粮的奶牛中,与饲喂其他纤维含量较低饲粮的动物相比,纤维溶解和纤维素分解细菌[如毛螺菌科、瘤胃球菌科和纤维杆菌科(Fibrobacteraceae)]的相对丰度较高[31]。此外,本研究发现,燕麦草残渣黏附主要菌属绝大多数来源于瘤胃内容物,可见宿主瘤胃细菌群落对饲料降解过程黏附菌落具有一定影响。
在本研究中,未鉴定属相对丰度接近20%。这些未鉴定属的功能仍然不清楚。随着细菌鉴定工作的不断推进,对这些未分类细菌的进一步了解将有助于提高反刍动物的饲料养分利用率。
4 结 论
① 在瘤胃中定植的细菌总数和alpha多样性均高于燕麦草干草。
② 燕麦草上的优势菌门迅速被瘤胃微生物取代,宿主瘤胃细菌群落影响饲料上附着的细菌种类和数量。
③ 黏附在燕麦草上的细菌群落组成和结构随着培养时间的推移发生了显著变化,且与燕麦草残渣营养成分组成呈强相关。
