微生物与仔猪肠道脂质代谢-免疫应答网络互作研究进展
2023-12-04周锡红印遇龙
曾 琰 周锡红 印遇龙
(中国科学院亚热带农业生态研究所,长沙 410125)
仔猪断奶时肠道微生态、免疫以及消化系统发育均不完善,易受外源病原菌感染以及营养物质供给不足等影响,导致生长缓慢和疾病发生等。肠道脂质代谢为仔猪生命活动提供了绝大部分能量。饲粮中补充脂肪酸可以促进肠道脂质代谢,增加能量供应。脂肪酸可以调节肠道菌群组成,促进仔猪免疫功能完善。因此,揭示仔猪肠道免疫系统和微生物的发育规律,解析脂肪酸调控微生物与宿主互作及免疫应答的机制,不仅有利于改善仔猪的免疫功能和抗病力,减少养殖过程中抗生素的使用量,还有助于提高饲料利用率,降低养殖成本。基于此,本文针对仔猪肠道免疫系统发育,微生物与肠道脂质代谢和免疫功能互作,以及脂肪酸对机体脂质代谢、微生物组成和免疫功能等影响作一全面系统的阐述,旨在为饲粮中应用脂肪酸改善仔猪肠道健康提供参考。
1 猪肠道免疫系统组成和发育
动物机体70%以上的免疫细胞位于肠黏膜内,肠相关淋巴组织是体内最大的免疫器官。肠道黏膜免疫系统主要分为有结构的淋巴组织和呈弥散分布的淋巴组织。有结构的淋巴组织包括黏膜相关淋巴组织、肠道相关淋巴组织和派氏淋巴结;呈弥散分布的淋巴组织包括肠道黏膜上皮内淋巴细胞以及固有层内散在的淋巴细胞。肠黏膜免疫系统按功能分为以小肠派氏淋巴结为主的诱导部位和以肠黏膜上皮和固有层为主的效应部位。猪派氏淋巴结分为空肠和回肠前段散在分布的淋巴结和回肠末端连续分布的淋巴结。仔猪一般出生几天后淋巴细胞开始增殖,并逐渐扩散形成淋巴结。肠道微生物对派氏淋巴结的发育极为关键,研究发现,与常规环境中饲养的猪相比,无菌猪派氏淋巴结发育慢,体积小[1]。但是肠道微生物主要影响派氏淋巴结的大小而不影响其数量和分布[2-3]。位于肠上皮细胞间的上皮内淋巴细胞是一类T细胞。研究发现,新生仔猪肠上皮内淋巴细胞几乎不表达CD2+、CD4+和CD8+,甚至有研究在发育成熟的猪上皮内淋巴细胞内也未检测到CD8+[4]。
肠道免疫细胞主要位于肠上皮层、固有层和肠道相关淋巴组织。它们聚集于这些部位发挥免疫调节作用并清除病原菌,以保护机体免受损伤。肠道免疫细胞主要包括先天性免疫细胞和适应性免疫细胞。先天性免疫细胞主要包括先天淋巴细胞、巨噬细胞、树突状细胞和粒细胞等,而适应性细胞主要是T细胞和B细胞。T细胞是肠道中数量最丰富的免疫细胞,且T细胞可与肠道数以千万计的微生物发生互作,因此肠道T细胞处于高度活跃状态[5]。小肠固有层含有大量CD4+辅助T细胞(Th细胞),这些细胞在维持肠道稳态和机体抵抗力方面发挥重要作用,它们的组成变化与肠道炎症及疾病相关。Th细胞包括Th1细胞、Th2细胞、Th17细胞、滤泡辅助T细胞(Tfh细胞)和调节性T细胞(Treg细胞)。猪固有层中的B细胞主要是活化的B细胞和分泌免疫球蛋白A(IgA)的浆细胞,浆细胞主要位于肠隐窝部位,而固有层中的CD4+和CD8+T细胞则集中在肠绒毛间[6]。仔猪刚出生时小肠绒毛和隐窝中有少量不具备成熟功能的巨噬细胞和中性粒细胞,极少量的CD4+和CD8+T细胞,而几乎没有可分泌抗体的细胞;在出生后的前2周,仔猪肠上皮和固有层逐渐出现CD2+淋巴细胞和结构成形的派氏淋巴结;在第2~4周,固有层出现较多CD4+T细胞和少量CD8+T细胞,同时有少量可分泌免疫球蛋白M(IgM)的B细胞;到第5周,肠上皮出现大量CD8+T细胞和主要分泌IgA的固有层B细胞[7]。
2 微生物与肠道免疫功能
微生物及其代谢物在机体免疫系统发育和成熟以及免疫功能调节方面发挥重要作用。无菌动物肠道淋巴组织结构和免疫功能存在缺陷,其上皮内淋巴细胞数量显著低于正常动物,无菌动物定植微生物后其上皮内淋巴细胞数量显著增加[8]。新生仔猪早期包括断奶期是肠道微生物对宿主发挥免疫刺激作用的最关键时期,这一时期也是机体免疫系统发育最快速和最重要的阶段。研究表明,小鼠肠道上皮鞭毛蛋白受体Toll样受体(TLR)5随日龄增加而变化,出生早期先天性免疫受体TLR5可感知细菌鞭毛蛋白并调控鞭毛菌定植[9]。无菌动物和刚出生动物其体内IgA浓度非常低,但定植微生物后IgA浓度迅速上升[10],共生菌分泌的信号分子可调节黏膜B细胞产生免疫球蛋白。无菌小鼠定植分节丝状菌或其他共生菌后,其肠上皮固有层开始出现Th17细胞,青少年(人)双歧杆菌引发了与分节丝状杆菌明显不同的转录程序,表明了促进Th17细胞积累的替代机制[11]。肠道共生菌脆弱拟杆菌(Bacteroidesfragilis)产生的细菌多糖通过改善无特定病原体(SPF)小鼠肠淋巴组织中Th1细胞和Th2细胞之间的平衡促进免疫系统成熟[12]。
肠道微生物产生的肽聚糖可激活核苷酸结合寡聚化结构域蛋白1(Nod1)信号通路,从而促进肠淋巴细胞分泌白细胞介素-17A(IL-17A)并调节血液中吞噬细胞水平[13-14]。在抗生素导致的小鼠肠道微生态失衡情况下,非病原微生物可以聚集在肠系膜淋巴结并诱导T细胞反应和IgA抗体生成[15]。Th1细胞和Th17细胞在断奶后聚集于肠上皮固有层发挥重要免疫功能,研究发现,抗生素处理清除肠道细菌后,富集于固有层的Th1细胞和Th17细胞的数量显著减少,这一结果表明Th1细胞和Th17细胞的富集过程高度依赖于肠道微生物的驱动[16]。
正常情况下,微生物与免疫应答网络之间存在着相互调节的动态平衡。然而,在外部因素如饲粮脂肪含量过度增加、肠道脂质代谢紊乱和外源致病菌入侵等条件下,微生物与免疫系统之间的平衡被打破,进而导致肠道微生态失调和免疫功能紊乱,从而引起肠道疾病包括腹泻和炎症性肠病等。
3 脂质代谢与肠道免疫功能
饲粮营养不平衡可导致机体代谢紊乱,进一步可引起免疫功能紊乱。动物机体代谢与免疫功能之间存在着紧密互作关系。机体免疫系统尤其是先天免疫功能失常是引起代谢紊乱发生和发展的因素,而营养物质代谢对免疫系统发育以及免疫稳态发挥关键性的调节作用[17]。小肠是饲粮脂肪消化、吸收和代谢的最主要场所,脂肪酸是细胞能量的主要来源之一,同时也是构成细胞结构的重要物质。饲粮中的脂肪酸以甘油三酯的形式与胆固醇、疏水维生素等形成微粒,然后经胆汁酸盐乳化以及胰脂肪酶消化成游离脂肪酸或者甘油二酯后,被肠上皮细胞吸收。与碳水化合物相比,随饲粮摄入的脂肪可引起相对滞后但更强烈的肠系膜淋巴结反应。脂质吸收主要受细胞(含免疫细胞)表面表达的低密度脂蛋白受体(LDLR)和清道夫受体(SR)如CD36、B类1型清道夫受体(SR-B1)等介导。例如,B细胞表面表达的SR-B1可降低下游信号分子TLR9的表达;T细胞和B细胞在一定的刺激条件下可诱导表达LDLR;CD8+T细胞表达的CD36可介导该细胞摄入氧化型低密度脂蛋白[18]。肠道生物学功能尤其是免疫功能受饲粮脂肪酸的影响,肠道免疫细胞的功能可受脂肪酸含量和组成及其可渗透进入细胞的代谢物直接调控。但是,这些受体是如何协同调节免疫细胞摄入脂肪酸从而影响免疫细胞的功能尚不清楚。
脂肪酸可分为长链饱和脂肪酸(如棕榈酸和硬脂酸等)、长链单不饱和脂肪酸(如油酸等)、长链多不饱和脂肪酸(LCPUFA,如亚油酸和亚麻酸等)、中链脂肪酸(MCFA)(如辛酸、癸酸和月桂酸等)。脂肪酸对免疫细胞的影响主要取决于其碳链长度。长链脂肪酸(LCFA)需要经肉毒碱转运载体才能进入线粒体进行氧化,而MCFA则不需要。脂肪酸的链长和饱和度不同导致其在代谢以及信号转导方面存在差异,因此其对肠道细胞免疫功能的影响不同。长链饱和脂肪酸和大部分中链饱和脂肪酸可以促进Th1细胞和Th17细胞分化,而月桂酸则抑制Treg细胞分化[19-20]。月桂酸通过降低拟杆菌门发酵纤维类食物而产生短链脂肪酸(SCFA),从而减少其与Treg细胞表达的游离脂肪酸受体2(FFAR2)结合;但富含月桂酸的饲粮可以促进小肠Th1细胞和Th17细胞反应[20]。多不饱和脂肪酸(PUFA)可以抑制Th17细胞功能,从而缓解结肠炎。PUFA还可以通过促进脂肪酸氧化和线粒体氧化磷酸化调节Treg细胞分化并发挥功能[21]。此外,研究发现饱和脂肪酸与不饱和脂肪酸均可通过调节TLR和炎症小体信号通路对肠道免疫机能发挥复杂的双向作用。例如,饱和脂肪酸可激活TLR2和TLR4,而不饱和脂肪酸尤其是二十二碳六烯酸(DHA)则抑制二者活性[22]。
4 微生物与脂质代谢-肠道免疫功能
肠道微生物在机体营养代谢中发挥重要作用。脂肪酸作为饲粮主要成分之一,其在肠道中的代谢与微生物存在互作调控。脂肪酸既可作为肠道微生物的代谢底物,又可对微生物发挥毒性作用从而抑制其生长。肠道微生物可直接调节脂质代谢,从而影响机体血液和组织中脂肪酸的含量,还可以通过其代谢产物如短链脂肪酸、次级胆汁酸和三甲胺等物质调节宿主脂质代谢[23]。无菌小鼠饲喂高脂饲粮后,其小肠脂质消化和吸收显著低于饲喂高脂饲粮的正常小鼠,而粪便中脂质含量显著升高[24]。小肠内微生物通过调节肠上皮细胞对脂质的消化和吸收,使宿主适应饲粮脂肪含量的变化。约氏乳杆菌通过改变肠道微生物群和脂质代谢相关基因促进脂质沉积和代谢[25]。
生命早期的肠道菌群对于维持宿主代谢和免疫稳态至关重要。近年来大量研究发现,饲粮脂肪酸可通过影响微生物及其代谢,进而调控肠道免疫功能。当父母双方均饲喂高脂饲粮时,其后代出生早期免疫力和抗病力显著下降,肠道发生炎症反应且血液中脂多糖含量显著增加[26]。这些结果说明,母体微生物及代谢的变化可传递给子代,并影响子代早期的免疫功能和营养物质代谢。在动物幼龄阶段摄入过量能量也会导致肠道通透性,以及促炎因子表达和微生物群产生的硫化氢增加,从而对动物免疫系统产生不良影响[27]。高脂饲粮可改变肠道微生物特定菌群的丰度,抑制CD4+T细胞表达肠道白细胞介素-17(IL-17)和维甲酸相关孤儿受体(ROR)γt,进而诱导效应T细胞产生炎症因子[28]。此外,高脂饲粮还可促使肠道微生物作用于肠上皮细胞和抗原呈递细胞(树突状细胞和巨噬细胞)的模式识别受体,将信号传导至先天淋巴细胞和T细胞,进而引发炎症等反应[29]。
胆汁酸是胆固醇分解代谢的主要产物,可调节机体胆固醇代谢平衡;胆汁酸也是影响脂肪在肠道消化和吸收的最主要物质。肠道微生物与胆汁酸之间存在紧密的互作关系。大部分肠道微生物中存在可解离胆汁酸的胆盐水解酶。肠道内醋酸菌和拟杆菌中的7α和7β脱羟基酶,可将初级胆汁酸包括胆酸和鹅去氧胆酸分别分解成次级胆汁酸脱氧胆酸和石胆酸[30]。这一过程直接影响了胆汁酸的多样性和可溶性。微生物代谢产生的这些次级胆汁酸可作为拮抗剂或激动剂调控肠上皮细胞上胆汁酸受体表达,进行调节肝脏胆汁酸合成[29]。胆汁酸一方面可以作为某些特定微生物的营养成分促进其生长,另一方面可直接影响脂质代谢以及肠道免疫细胞功能。研究发现,正常生理条件下,胆汁酸可作为内源调控因子抑制炎性小体活性[31];高水平的粪便脱氧胆酸可激活NLR家族pyrin结构域3(NLRP3)炎性小体,从而引起与高脂饮食相关的炎症反应[32]。动物机体摄入脂肪后,胆汁酸的分泌水平以及胆汁酸组成及成分的疏水性差异决定了其对炎性小体的不同调节作用。微生物与仔猪肠道脂质代谢-免疫应答关系如图1所示。
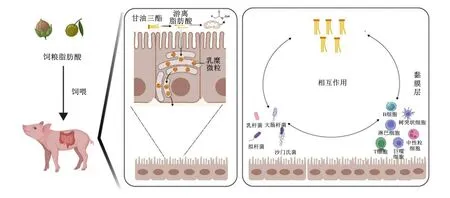
图1 微生物与仔猪肠道脂质代谢-免疫应答关系Fig.1 Relationship between microorganisms and lipid metabolism-immune response in piglets
5 饲粮脂肪酸对仔猪肠道微生物的作用研究
仔猪肠道定植的大量微生物对于肠道健康十分重要,它们参与维持黏膜屏障完整性和调节免疫功能等。因此,维持肠道微生物区系平衡对于仔猪健康必不可少。仔猪在断奶期胃肠道系统敏感,自身氧化还原系统还未发育完善,肠道菌群易发生显著变化[33]。饲粮中添加不同类型的脂肪酸会影响仔猪肠道微生物区系稳态。
LC-PUFA主要包括n-3 PUFA和n-6 PUFA 2种。饲粮中添加n-3 PUFA可以增加肠道益生菌丰度,减少有害菌丰度。例如,缺乏n-3 PUFA的小鼠肠道厚壁菌门与拟杆菌门比例下降,而补充n-3 PUFA提高了双歧杆菌和乳酸杆菌的丰度[34]。不同类型PUFA对肠道微生物的影响不同。Andersen等[35]在仔猪饲粮中分别添加富含n-3 PUFA的鱼油和富含n-6 PUFA葵花油(提供等量PUFA),结果发现,与肥胖有关的拟杆菌属在饲喂葵花油的仔猪肠道微生物中所占比重显著高于饲喂鱼油的仔猪。
MCFA可以通过直接溶解细菌细胞膜,抑制细菌脂肪酶活性或诱导革兰氏阳性菌产生自溶酶发挥抗菌作用[36-37]。饲粮中添加MCFA可以显著增加仔猪肠道微生物多样性,7.75 g/kg的包被MCFA增加了盲肠拟杆菌门和螺旋体纲的相对丰度,降低了厚壁菌门、放线菌门和协同菌门的相对丰度[38];甲酸钙、乳酸钙、柠檬酸以及月桂酸和葵酸混合添加到饲粮中可显著提高断奶仔猪回肠乳酸菌数量[39];1.2%的葵酸和辛酸与有机酸混合可以增加断奶仔猪粪便中乳酸杆菌数量[40];将MCFA(己酸、癸酸、辛酸和月桂酸混合物)、乳酸和牛至油添加至饲粮中饲喂沙门氏菌高发猪,结果发现,盲肠内容物和淋巴结中沙门氏菌数量均显著降低[41];给断奶仔猪饲喂含MCFA的饲粮显著降低了盲肠沙门氏菌以及回肠和结肠大肠杆菌数量[42]。
SCFA是肠道微生物的发酵产物。饲粮中添加SCFA具有抑菌作用,其主要机制是通过降低胃肠道pH破坏有害菌的生长环境,从而发挥抑菌作用。SCFA进入肠道后释放氢离子,酸性环境利于乳酸杆菌等益生菌的生长,而抑制大肠杆菌等有害菌的生长[43]。Boyen等[44]发现,饲粮中添加2 g/kg包被丁酸显著减少了仔猪肠道和粪便中鼠伤寒杆菌的定植量;Wen等[45]发现,饲粮中添加1 g/kg的丁酸钠可以降低近端结肠梭状芽孢杆菌和大肠杆菌数量。综上所述,不同链长的脂肪酸均可改善仔猪肠道菌群组成;在仔猪饲粮中适当添加脂肪酸有利于肠道有益菌的生长,抑制潜在病原菌的生长,从而促进肠道健康。
6 饲粮脂肪酸对仔猪肠道免疫功能的作用研究
饲粮脂肪酸可影响仔猪肠道免疫功能。n-3 PUFA可缓解脂多糖、葡聚糖硫酸钠和过氧化氢导致的猪肠上皮细胞损伤,维持细胞活力和膜完整性[46]。饲粮中添加富含n-3 PUFA的亚麻籽油可增加猪体内亚麻酸、二十碳五烯酸(EPA)和n-3 PUFA含量,显著改善仔猪肠道完整性和屏障功能,增强免疫功能[47];饲粮添加鱼油可抑制仔猪TLR4通路相关基因如IL-1受体相关激酶1、TNFR相关因子6的表达[48]。TLR4通路是重要的炎症相关通路,激活后促进炎性因子表达[49-50]。饲粮中高含量的PUFA与适宜的n-6与n-3 PUFA比例对于维持仔猪肠道免疫稳态十分重要。饲粮中较低的n-6与n-3 PUFA比例有助于改善仔猪免疫状态[51]。将富含n-6 PUFA的玉米油和富含n-3 PUFA的亚麻油混合使用,使母猪饲粮中n-6与n-3 PUFA比例为9∶1,哺乳期仔猪免疫状态可得到显著改善[52]。
MCFA同样具有改善猪肠细胞系免疫功能的作用[53]。饲粮中添加中链甘油脂肪酸可增加仔猪血液中免疫球蛋G(IgG)含量[54];添加中链甘油脂肪酸酯可以增加仔猪体内MCFA含量以及十二指肠、回肠和空肠绒毛高度[55]。饲粮中添加己酸可以降低经免疫抑制剂环磷酰胺处理的仔猪体内促炎、氧化应激和肠道屏障相关基因的表达,从而维持肠道屏障功能完整性[56];此外,MCFA与有机酸混合添加到饲粮还可以增加猪空肠上皮淋巴细胞数量[57];当饲粮中单独补充MCFA时,仔猪空肠绒毛高度仅有增长的趋势[58]。中链脂肪酸甘油酯饲喂仔猪能够增加肠道中紧密连接蛋白封闭蛋白-2(Claudin-2)、闭锁小带蛋白-1(ZO-1)表达,并增加分泌型免疫球蛋白A(SIgA)含量[59]。
SCFA在缓解仔猪肠道炎症方面发挥重要作用。Fang等[60]发现,饲粮中添加1 g/kg丁酸钠可显著降低仔猪腹泻率,并增加血清中IgG含量和空肠IgA阳性细胞数量;此外,丁酸钠还可以降低血清中肿瘤坏死因子-α(TNF-α)和白细胞介素-6(IL-6)含量,抑制核转录因子-κB(NF-κB)信号通路激活导致的炎症反应[45]。Zeng等[61]的研究显示,0.3%的丁酸盐可促进仔猪空肠细胞更新和回肠隐窝细胞增殖,改善肠道形态。Hou等[62]发现,饲粮中添加0.1%的三丁酸甘油酯可以促进仔猪肠道细胞间形成紧密连接蛋白,激活表皮生长因子受体信号传导,从而减轻肠道损伤。当丁酸与MCFA混合加入饲粮时,也可以改善免疫功能,从而促进仔猪生长性能[63]。综上可知,不同类型的饲粮脂肪酸均可以改善仔猪肠道免疫功能,缓解炎症反应;脂肪酸可以作为饲料添加剂添加到饲粮中,有利于仔猪稳定度过断奶期。
7 饲粮脂肪酸对仔猪肠道脂质代谢的作用研究
肠道是脂质代谢的主要场所,脂质代谢可为新生仔猪提供大量能量[64-65]。饲粮脂肪酸组成和含量影响仔猪肠道脂质代谢和能量供给。脂肪酸在仔猪体内的代谢速率一定程度上取决于它的链长。一般来说,脂肪酸的链长与吸收速率呈负相关,SCFA比LCFA更易溶于水,可直接扩散至肠细胞[64,66];而LCFA需要被同化为长链磷脂和甘油三酯之后才能被氧化。仔猪饲粮中的亚油酸和α-亚麻酸需首先代谢为EPA、二十二碳六烯酸(DHA)或花生四烯酸等才能被肠道细胞吸收,而这一过程受到去饱和酶限制[67-68]。饲粮中含有的部分MCFA酯化程度低,甘油三酯在经过肠道时可以被小肠上皮细胞吸收,在微粒体脂肪酶作用下水解;但大多数MCFA无需脂肪酶水解即可直接吸收,其氧化速率也明显高于其他类型的脂肪酸[69-70]。饲粮中的脂肪酸还可以通过影响脂质代谢相关酶的活性调节仔猪肠道脂质代谢,不同类型脂肪酸对脂质代谢相关酶活性的影响不同。当MCFA单独饲喂时,随着碳链长度从C4延长至C10,新生仔猪肠道脂肪酶活性随之降低[71]。饲粮中添加甘油月桂酸酯或联合添加甘油三辛酸酯和甘油三葵酸酯可以显著促进断奶仔猪空肠和回肠脂肪酶和胰蛋白酶活性,促进营养物质吸收以及脂质代谢[72]。饲粮脂肪酸中饱和脂肪酸与不饱和脂肪酸对脂肪酶活性的影响相反,随着饲粮不饱和脂肪酸与饱和脂肪酸比例升高,饲粮脂肪酸在肠道中的消化率增加[73]。
不同类型脂肪酸均可影响仔猪肠道脂质代谢。PUFA通过控制转录因子活性调控基因表达,进而影响脂质代谢。过氧化物酶体增殖物激活受体(PPAR)和肝X受体(LXR)是脂质代谢相关基因的重要调节因子,PUFA可以作为其配体发挥调节作用[74],促进脂质氧化;固醇调节元件结合蛋白-1c(SREBP-1c)的表达也受到PUFA调控,该蛋白会干扰小鼠肝脏中胆固醇和脂质合成相关基因的表达[75]。新生仔猪饲喂含MCFA的甘油三酯可显著减少24 h氮排泄并提高机体血糖水平,改善能量代谢[76]。饲粮中添加20~60 g/kg的MCFA可以显著提高断奶仔猪饲料转化率[77]。丁酸是结肠细胞主要能量来源[78],可以减少HepG2细胞脂质代谢[79]。回肠输注SCFA可以促进仔猪结肠中糖异生过程中的关键酶葡萄糖-6-磷酸酶、磷酸烯醇丙酮酸羧激酶1和游离脂肪酸受体2的表达[80]。25 mg/kg的SCFA可以增加仔猪空肠溶质载体家族7(SLC7A1)和再生蛋白(REG)-Ⅲγ的mRNA表达,并增加脂肪酶、胰蛋白酶等消化酶的活性[81],促进肠道发育和提高吸收功能。因此,饲粮脂肪酸不仅可作为能量来源,同时还可调节仔猪肠道脂质代谢。
8 小 结
总而言之,仔猪脂肪酸和肠道脂质代谢稳态之间的平衡是肠道微生物调节肠道免疫稳态的基础。合适的肠道菌群对于饲粮脂肪酸的有效吸收必不可少,而肠道中脂肪酸的含量和类型也有利于肠道菌群稳态并增加微生物多样性;此外,肠道微生物区系与肠道脂质代谢的稳态有利于免疫细胞成熟,促进免疫系统发育与完善。然而,关于不同脂肪酸来源和组成对仔猪肠道脂质代谢和免疫应答影响的研究报道较少;同时,微生物如何介导脂肪酸调控免疫细胞功能以及如何通过调控脂质代谢-免疫应答网络维持肠道稳态的作用机制尚不清楚。目前,虽有大量研究证明饲粮中添加脂肪酸可以影响仔猪肠道微生物区系、免疫功能和脂质代谢,但是由于脂肪酸类型多样,作用各有异同,关于仔猪饲粮最适脂肪酸添加类型以及组成和比例还有待进一步研究。此外,不同类型脂肪酸在仔猪肠道内的具体作用机制还有待进一步阐述。
