幼龄反刍动物胃肠道免疫系统发育及其调控的研究进展
2023-12-04宋明明党丹岐赵佳楠张立阳
宋明明 党丹岐 赵佳楠 张立阳
(河南农业大学动物科技学院,河南省家畜营养调控与生态养殖国际联合实验室,郑州 450046)
幼龄反刍动物胃肠道健康及免疫系统的成熟是保证其成年后发挥正常生产性能的基石。反刍动物早期胃肠道功能发育不全,免疫功能也相对薄弱,病原菌入侵或其他因素干扰极易造成胃肠道微生态失衡,引发腹泻等疾病[1]。反刍动物胃肠道内存在众多且复杂的微生物群落,不仅具有消化功能,还在免疫系统发育过程中扮演重要角色。因此,明晰幼龄反刍动物胃肠道及微生物群落和免疫系统如何发育、演变、调控等关键问题,能够进一步拓展对机体、微生态环境和免疫系统的相互作用的认知,对预防疾病的发生及维护动物健康尤为重要。
1 幼龄反刍动物胃肠道免疫系统的建立和发育
1.1 幼龄反刍动物胃肠道发育及其免疫系统的组成和功能
瘤胃及肠道的发育对幼龄反刍动物的生长和健康至关重要,不仅直接影响其对营养物质的消化和代谢,同时也是机体自身免疫系统发挥功能的基础。瘤胃的发育主要发生在反刍动物断奶前,除了重量和容积的增加外,还包括瘤胃壁的生长发育以及瘤胃微生物的定植。这个发育过程主要依赖于饲粮成分、物理形态的变化、消化系统菌群的建立以及消化和吸收的机制等,饲粮中开食料及粗饲料分别主导对瘤胃乳头和瘤胃肌肉层发育的调控[2]。瘤胃微生物群对瘤胃结构和生理发育也表现出较大的影响,微生物在瘤胃内定植也随着消化系统的发育而发展。肠道的发育对断奶前反刍动物的营养吸收和代谢是非常重要的,同时肠道也代表机体最大的免疫器官,发挥着重要的免疫调节功能。肠道的发育围绕饲料形态的转变可以分为2个阶段:一是肠道消化吸收液体饲料提供营养阶段;二是肠道消化吸收固体食物提供营养阶段[3]。在此期间,除了肠道的整体形态变化外,肠道微生态系统组成也发生着剧烈变化。肠道中的微生物群除了直接构建屏障结构协助宿主抵御疾病,维护肠道健康外,也间接地通过促进机体免疫系统的发育完善来发挥作用。
在反刍动物幼龄阶段,肠道黏膜免疫是机体免疫的重要组成部分,并且在结构和功能上与其他哺乳动物相差无异,主要由物理屏障、化学屏障、模式识别受体(pattern recognition receptors,PRRs)以及多种有助于宿主防御的免疫细胞等组成[4-5]。肠上皮细胞(intestinal epithelial cells,IECs)通过紧密连接在身体和肠腔内容物之间形成不可渗透的屏障,并负责导入管腔营养素以及将免疫球蛋白A(immunoglobulin A,IgA)释放到管腔中[6]。肠道杯状细胞合成和分泌黏蛋白,在IECs表面聚集形成黏性涂层即黏液层,抵御绝大多数病原体入侵[7-8]。先天免疫系统在宿主抵抗感染的第1道防线中起着关键作用,并配备了识别病原相关分子模式(pathogen-associated molecular patterns,PAMPs)、损伤相关分子模式(damage-associated molecular patterns,DAMPs)和微生物相关分子模式(metabolism-associated molecular patterns,MAMPs)的PRRs,直接激活免疫细胞[9]。肠道固有层中的T细胞、B细胞、先天淋巴样细胞(innate lymphoid cell,ILC)、树突状细胞(dendritic cells,DCs)等免疫细胞,能够吞噬并呈递和清除抗原、分泌细胞因子、调节免疫应答。另外,肠道相关的淋巴组织(gut associated lymphoid tissues,GALT),也是肠道免疫系统的重要组成部分。组织型的GALT负责免疫反应的诱导部位,弥漫型的GALT构成免疫反应的效应部位,其能够监测肠道内抗原并激活免疫反应,介导免疫应答[10]。
1.2 被动免疫转移为幼龄反刍动物胃肠道免疫系统发育筑基
反刍动物生命早期,免疫系统的发育并不是孤立的,而是受到母体免疫功能的强烈影响。妊娠期间,母体胎盘的特殊结构阻止了免疫球蛋白从母体循环系统到胎儿的传递[11]。出生以后,反刍动物必须依靠摄入初乳以克服低丙种球蛋白(先天性或获得性血清免疫球蛋白浓度低)的状态,实现被动免疫,减少或避免初生环境中各种细菌或病毒的感染[5,12-13]。研究表明,犊牛接受初乳后血清葡萄糖、总蛋白和免疫球蛋白G(immune globulin G,IgG)等浓度均显著升高[12]。而且国外调查研究显示,被动免疫失败犊牛的患病率和死亡率均会有所提高[14]。初乳除了为高度敏感的新生反刍动物提供被动免疫的转移外,还影响新生反刍动物胃肠道菌群的定植和稳态。Stabel等[15]的研究表明,初乳缺乏可能会对犊牛在总微生物种群中建立平衡的能力产生重大影响并将导致生物失调和发病率的增加。但幼龄反刍动物仅在出生24 h内肠道通透性较高,这对促进免疫球蛋白通过非选择性大分子转运系统从初乳转移至机体血液中至关重要,随着出生时间的增加,肠道发生闭锁,IgG等大分子再无法通过[16]。此外,新生反刍动物依靠初乳获得的IgG的半衰期仅为11.5~19.9 d,而内源IgG在出生后8~16 d才开始产生。因而,幼龄反刍动物被动免疫的转移可以为自身免疫系统的发育筑基,对其快速建立至关重要。
1.3 微生物定植促进幼龄反刍动物胃肠道免疫系统的发育
幼龄反刍动物胃肠道微生物的定植对宿主免疫系统的建立、发育和成熟非常关键。胃肠道微生物在免疫系统的建立和发育过程中扮演重要角色,而微生物的定植又直接或间接影响胃肠道免疫系统的成熟。新生反刍动物获取母体和环境中的微生物,并经过选择和适应后在胃肠道中存活、增殖形成稳定的微生物区系,定植的微生物通过刺激肠上皮黏膜免疫系统的功能促进先天性免疫和适应性免疫的发育。由IECs中的肠道杯状细胞分泌的黏蛋白组成的肠黏膜可有效阻止细菌的移位,而微生物的存在又可刺激杯状细胞合成和分泌黏蛋白,维持组织屏障的完整性[17]。肠道微生物的定植催动了肠黏膜和GALT的成熟,促进了免疫系统的发育。虽然派氏淋巴结(Peyer’s patch,PP)和肠系膜淋巴结(mesenteric lymph node,MLN)在妊娠时就已经发育,但每一个淋巴组织都需要来自肠道菌群感应的信号来刺激其发育成熟[18];并且无菌动物GALT的发育会出现缺陷,造成PP和MLN的减小[19]。细菌及其代谢产物被DCs摄取和呈递从而刺激GALT的发育:DCs被细菌活化后能够诱导PP生发中心T细胞的增殖,使B细胞分泌IgA,继而诱导MLN中效应T细胞的增殖,推动MLN的发育成熟[17]。
2 幼龄反刍动物胃肠道微生态系统与免疫功能的互作
2.1 胃肠道微生态系统对幼龄反刍动物肠道免疫功能的影响
胃肠道微生物、代谢物及其与宿主共代谢物组成的复杂环境是幼龄反刍动物机体最大的微生态系统,其形成和发展为幼龄反刍动物胃肠道免疫系统的发育和功能提供了关键信号,同时胃肠道免疫系统的发育和功能又受到微生态系统的调控[20]。胃肠道微生物群能够指导宿主先天性和适应性免疫功能的成熟,包括丁酸梭菌、双歧杆菌、脆弱拟杆菌、干酪乳杆菌以及鼠李糖乳杆菌等均表现出肠道免疫调节作用[21-22]。微生物可通过识别IECs表面的MAMPs,激活肠道中的Toll样受体(Toll-like receptors,TLRs)或NOD样受体(NOD-like receptors,NLRs)等来区分病原体和共生菌以及识别不同的微生物成分并直接激活免疫细胞调控宿主免疫应答。髓样分化因子88(MyD88)等信号通路能够感知细菌成分,并诱导信号转导,产生抗菌分子和细胞因子等并清除细菌,如图1所示[23]。并且小肠上皮细胞中MyD88缺陷会导致IECs产生的抗菌凝集素RegⅢγ减少,从而导致肠上皮表面有害菌定植增加,影响肠道健康[24]。
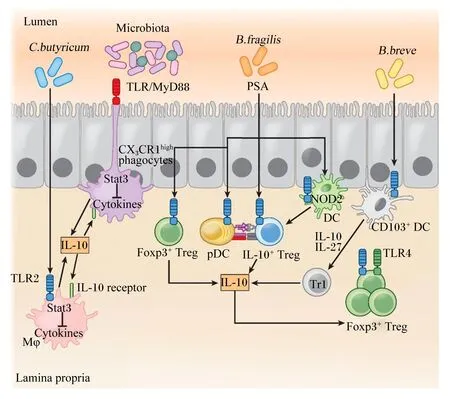
Lumen:肠腔;Lamina propria:固有层;Microbiota:微生物群;C.butyricum:丁酸梭菌 Clostridium butyricum;B.fragilis:脆弱拟杆菌 Bacteroides fragilis;B.breve:短双歧杆菌 Bifidobacterium breve;TLR2:Toll样受体2 Toll-like receptor 2 ;TLR4:Toll样受体4 Toll-like receptor 4;Stat3:信号转导及转录激活因子3 signal transducer and activator of transcription 3;PSA:多糖A polysaccharide A;IL-10:白细胞介素-10 interleukin-10;IL-27:白细胞介素-27 interleukin-27;IL-10 receptor:IL-10受体interleukin-10 receptor;IL-10+Treg:IL-10+调节性T细胞 IL-10+ regulatory T cells;Foxp3+Treg:Foxp3+调节性T细胞 Foxp3+ regulatory T cells;NOD2:核苷酸结合寡聚化结构域蛋白2 nucleotide-binding oligomerization domain-containing protein 2;Mφ:巨噬细胞 macrophages;CX3CR1high phagocytes:CX3C趋化因子受体1高表达吞噬细胞 CX3C chemokine receptor 1high phagocytes;DC:树突状细胞 dendritic cell;pDC:浆细胞样树突状细胞 plasmacytoid dendritic cell;CD103+DC:CD103+树突状细胞 CD103+ dendritic cell;Tr1:1型调节型T细胞 type 1 regulatory T cells;Cytokines:细胞因子。图1 肠道菌群调控宿主肠道免疫屏障功能Fig.1 Intestinal flora regulates host intestinal immune barrier function[23]
反刍动物宿主和肠道微生物群相互作用,产生广泛的代谢产物或化合物,如外源性未消化膳食成分厌氧发酵产生短链脂肪酸(short-chain fatty acids,SCFAs),内源性微生物和宿主反应产生胆汁酸(bile acids,BAs)代谢产物等,均是参与免疫系统调控的重要代谢产物[25]。SCFAs不仅能作为宿主的能量来源,也通过增加紧密连接蛋白相关基因的表达促进IECs的增殖,增强肠道屏障功能,调节免疫应答[23,26]。其通过激活G蛋白偶联受体或抑制组蛋白去乙酰酶(histone deacetylase,HDAC)来促进IECs产生细胞因子清除病原菌,作用机制如图2所示。另外,胆汁酸,特别是由细菌代谢肝脏中的胆汁酸而产生的次级胆汁酸(secondary bile acids,SBAs),可以调控肠道炎症的发生,发挥免疫调节作用。已有研究的SBAs石胆酸(LCA)和脱氧胆酸(DCA)作为重要的信号分子调节辅助性T细胞17(helper T cell 17,Th17)和调节性T细胞(regulatory T cells,Tregs)的分化[25]。BAs也可通过激活法尼醇X受体(FRX)来调控肠道菌群的组成,促进或抑制IECs的增殖,调节免疫屏障;并通过与TGR5的相互作用抑制核转录因子-κB(nuclear factor-kappa B,NF-κB)信号传导来降低巨噬细胞促炎症细胞因子的产生[27]。
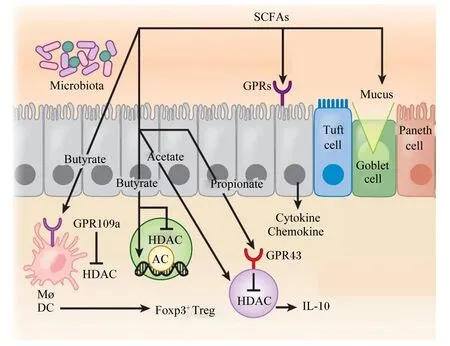
Microbiota:微生物群;SCFAs:短链脂肪酸 short chain fatty acids;Acetate:乙酸;Propionate:丙酸;Butyrate:丁酸;GPRs:G蛋白偶联受体 G protein-coupled receptors;Mucus:黏液;Tuft cell:簇状细胞;Goblet cell:杯状细胞;Paneth cell:潘氏细胞;GPR109a:G蛋白偶联受体109a G-protein coupled receptor 109a;GPR43:G蛋白偶联受体43 G-protein coupled receptor 43;AC:组蛋白乙酰化 histone acetylation;HDAC:组蛋白去乙酰酶 histone deacetylase;Mø:巨噬细胞 macrophages;DC:树突状细胞 dendritic cells;Foxp3+Treg:Foxp3+调节性T细胞 Foxp3+ regulatory T cells;IL-10:白细胞介素-10 interleukin-10;Cytokine:细胞因子;Chemokine:趋化因子。图2 挥发性脂肪酸调控肠道免疫屏障功能Fig.2 Volatile fatty acids regulate intestinal immune barrier function[23]
2.2 胃肠道黏膜免疫系统对微生物菌群的调控作用
胃肠道黏膜免疫系统受微生物菌群的调控,相反也对微生物菌群的定植和功能发挥作用。肠道黏膜免疫系统通过物理屏障、化学屏障、微生物屏障以及免疫屏障来调节微生物与宿主组织的相互作用以及微生物菌群的组成,控制细菌在宿主组织的暴露,从而减少病理结果的可能性,这一影响在反刍动物幼龄阶段更为重要[5]。不同的肠道菌群黏附于肠道黏膜层上,形成了一个多层次的肠道微生物屏障,是维持肠上皮的完整性和防止病原微生物入侵的天然屏障。先天免疫系统的PRRs能够诱导肠道潘氏细胞合成抗菌蛋白,并通过与MAMPs互作活化多条信号通路,提高肠道黏膜屏障功能,促进抗菌蛋白以及IgA的分泌抑制有害菌的定植[20]。IECs通过细胞间的紧密连接、黏附链接和桥粒等形成不可渗透的物理屏障,有效阻挡细菌、病毒和内毒素等的进入。黏液层的免疫效应因子IgA、抗菌肽(antimicrobial peptides,AMPs)和防御素等抑菌和杀菌物质构成了能够抑制黏膜层致病菌的化学屏障[28]。GALT和各种免疫细胞构成了肠道的免疫屏障,在免疫防御中也发挥了极大的作用[29]。其他免疫细胞群也促进了共生细菌对肠道部位的控制[7]。总之,免疫细胞、免疫效应因子和屏障系统共同作用,控制微生物群的定位和群落的组成,并减少细菌与上皮细胞的接触,维持免疫系统和微生物之间的平衡。
3 幼龄反刍动物胃肠道免疫功能的营养调控
由于肠道微生物的组成和产物对免疫应答有很大影响,因此通过微生态制剂、酶制剂等营养制剂干预胃肠道菌群影响反刍动物瘤胃及肠道微生态,或直接发挥免疫作用调控免疫功能,能够为免疫系统的调控提供新的思路和手段。
3.1 益生菌制剂的免疫调控作用
益生菌对调控动物肠道健康有着重要意义。许多试验与实践证明,乳酸杆菌等益生菌能够在肠道内黏附、定植,通过平衡肠道菌群、稳定肠黏膜屏障以及调节肠黏膜免疫起到免疫助剂的作用,缓解肠道疾病症状[30]。益生菌可以抑制病原菌在肠道的定植,帮助宿主建立健康的肠黏膜保护层,增强宿主免疫力。通过添加外源益生菌调控腹泻及肠道炎症对于维护反刍动物胃肠道微生态具有重要意义。外源益生菌除了通过SCFAs或诱导抑制物质(防御素、细菌素、抗菌肽等)抑制肠道病原体的定植外,还能调控肠黏膜屏障和免疫刺激促进肠道健康。Izuddin等[31]的研究表明,植物乳杆菌RG14制剂作用于羔羊能够增加管腔中β-防御素等抗菌肽的分泌量,并通过紧密连接蛋白调节肠屏障,进一步提高肠黏膜的健康和完整性,增强其免疫状态。据研究所述,犊牛食用复合微生态制剂能显著提高IgA与IgG以及抗炎细胞因子白细胞介素-4(IL-4)的含量,降低腹泻率,增强机体免疫功能[32]。另外,体外试验结果表明,鼠李糖乳杆菌GG(LactobacillusrhamnosusGG,LGG)作为益生菌能够极大增强受感染巨噬细胞的免疫应答水平[33]。而且,生产中的粪菌移植(fecal microbiota transplantation,FMT)技术也可以作为独特的益生菌制剂改善动物机体肠道健康。有研究将被动免疫成功犊牛的粪菌应用于被动免疫失败的犊牛,结果表明FMT可以改善肠道上皮紧密连接结构,提高肠道屏障完整性,具有促进肠道健康、提高犊牛免疫力的积极作用[20]。此外,FMT还能够改善羔羊[34]和犊牛[35]的腹泻情况、重塑肠道菌群,促进肠道微生态健康,并具有提高生长性能的可能性。
3.2 酶制剂的免疫调控作用
作为同时具有营养性添加剂和功能性添加剂双重特性的饲料添加剂,酶制剂除了具有基本的营养功能外,还对肠道健康、免疫调节、杀菌抑菌等均有益处,已经成为动物的常规饲料添加剂。但目前酶制剂相关研究主要集中在其对反刍动物的营养调控,而对胃肠道免疫屏障功能的调节研究较少[36]。由于幼龄反刍动物瘤胃发育不全,其消化吸收方式与单胃动物较为相似,外源酶能够逃脱瘤胃微生物及其酶的分解破坏,进入瘤胃后段的真胃和小肠部位,因此酶制剂在幼龄反刍动物生产及胃肠道功能调控中作用更为明显。酶制剂的主要功能包括辅助瘤胃微生物发挥消化功能,调节瘤胃的理化环境,产生微生物需要的益生元,进而间接对幼龄反刍动物胃肠道微生态环境,免疫系统方面发挥调控作用。随着日龄的增加,反刍动物瘤胃及肠道系统发育不断完善,瘤胃的功能逐渐成熟,酶制剂的应用将区别于普通猪、禽等单胃动物用酶制剂的传统思路,建立反刍动物酶制剂改善瘤胃及肠道的酶菌协同生态体系[37]。
3.3 植物提取物的免疫调控作用
近年来,植物提取物作为天然饲料添加剂代替抗生素受到广泛关注,如黄芩苷、植物精油以及中草药提取物等。它们在改善动物胃肠道微生态环境,促进免疫细胞的活性,改善机体免疫状态方面发挥了积极作用。研究发现,黄酮类物质黄芩苷能够改善断奶前犊牛血液抗氧化、抗炎和免疫功能,并降低犊牛腹泻的严重程度和发生率,起到调节免疫平衡的作用[38]。Oh等[39]研究发现,植物提取物大蒜油、姜黄油树脂和辣椒素可通过激活和诱导CD4细胞的扩张而具有免疫刺激作用。另外,中药大黄是自古以来传统中医治疗消化不良、便秘等疾病的常用草药,除了具有抗菌和抗肿瘤等的特性外还能发挥一定的免疫调节作用。Jiao等[40]的研究表明,在反刍动物发育早期,补充大黄可通过调节肠道上皮微生物群来增强宿主黏膜固有免疫稳态。此外,丝兰(Yuccaschidigera,YS)是一种富含抗微生物、抗氧化剂和免疫调节剂的植物,其作为饲料添加剂能提高断奶前犊牛的生长发育、饲料效率和免疫力,降低粪便评分和腹泻率[41]。同样,海藻提取物被用作饲料补充剂,以改善幼年动物的肠道微生物群。有研究报道,牛奶中添加海藻提取物在一定程度上能够增加先天免疫系统的活性,调控免疫功能[42]。
3.4 功能性氨基酸及微量元素等营养制剂的免疫调控作用
限抗/禁抗背景下,通过饲粮营养调控宿主肠道免疫,是当前畜禽健康养殖的有效策略。营养免疫学(nutritional immunology)主要研究免疫反应的营养调节机制及免疫应答对动物生长和营养需要的影响、以及用免疫学技术进行营养调控等问题[43]。多种因素制约免疫力的强弱,其中营养因素起着相当重要的作用,其不仅维持正常免疫功能和健康的物质基础,同时也表现出复杂的调控作用[44]。一些研究表明,氨基酸可作为信号分子调节动物生长健康和免疫功能。Wu[45]于2010年提出了具有调节动物机体关键代谢通路,改善动物体健康、存活、生长、发育、泌乳和繁殖的“功能性氨基酸”的概念。众多试验与实践证明,功能性氨基酸中尤其是精氨酸、谷氨酰胺等能够通过平衡肠道菌群、稳定肠黏膜屏障以及调节免疫细胞的能力和特性起到免疫助剂作用[46]。精氨酸作为先天免疫和适应性免疫的重要营养物质,可以刺激免疫球蛋白M(immune globulin M,IgM)和IgA的产生,从而增强机体的免疫防御能力[47]。而精氨酸的缺乏会抑制T细胞的增殖,影响T细胞受体复合物的组装,并且还会影响T细胞的糖酵解功能[48]。谷氨酰胺在肠道完整性和先天免疫系统发育中具有重要功能,因为它是淋巴细胞和巨噬细胞的重要底物,并在细胞免疫中发挥重要作用[48]。因此,谷氨酰胺补充剂有助于恢复肠道屏障,提高免疫水平。
微量元素是指生物体内含量极小,但具有强大生物学作用的生命元素,其能够作用于细胞调节、神经传导、机体代谢等生物学过程指导免疫应答。微量元素通过直接和间接作用调控免疫应答过程:一是免疫细胞借助微量元素来表达和保障关键金属蛋白的结构与功能。微量元素缺乏时会直接引起机体内免疫器官、免疫细胞等组织的损伤、改变或分化,导致免疫缺陷。二是通过影响机体内其他组织的营养、生长和代谢,间接引起免疫功能下降,降低抗病能力。铁、锌、铜是反刍动物繁殖、生长和免疫所必需的微量元素。铁在T细胞的分化和增殖中具有重要作用,并有助于调节免疫微环境中辅助性T细胞和细胞毒性T细胞之间的最佳比例,而且,它在干扰素γ的产生中也有显著作用[48]。据了解,锌能够通过增强自然免疫系统来增强各种哺乳动物细胞的抗病毒能力[49]。而缺锌的影响是多方面的,最主要是影响T淋巴细胞的功能,还影响胸腺素的合成与活性、NK细胞和吞噬细胞的功能等。铜对于体内很多种酶的功能的正常运作起着至关重要的作用,缺乏铜会影响免疫活性细胞的铜依赖酶而介导免疫抑制作用。总之,氨基酸和微量元素与免疫系统的发展密切相关,了解它们之间的相互作用对未来的免疫疗法和药物开发意义重大。
4 小 结
幼龄反刍动物胃肠道功能建立及其免疫系统的成熟是保证机体健康和生产性能的关键。初生阶段被动免疫的转移可以为免疫系统的发育筑基,胃肠道微生物的定植及微生态系统的建立能够促进宿主免疫系统的发育,且胃肠道微生物和代谢物及其与宿主共代谢物与机体免疫功能之间存在紧密的互作。随着反刍动物绿色生态养殖的发展,“减抗/替抗”相关技术解决方案需求广泛,通过微生态制剂等手段干预瘤胃及肠道微生态,或直接发挥免疫功能,能够为幼龄反刍动物免疫系统的调控提供新的思路和手段。
