种植方式对‘赤霞珠’葡萄酒发酵中酵母菌多样性的影响
2023-12-03刘俊妤郭方圆孙悦
刘俊妤,郭方圆,孙悦*
(宁夏大学葡萄酒与园艺学院,宁夏银川 750021)
近年来,葡萄种植模式对酿酒微生物和葡萄酒品质的影响逐渐成为研究热点。由于消费者对食品安全和健康问题的关注度增加,“可持续性”理念将成为葡萄酒进入市场的先决条件[1],有机葡萄酒市场在全球范围内呈上升趋势[2],葡萄种植者和消费者均对有机葡萄酒,尤其是生物动力葡萄酒的生产表现出越来越高的兴趣[3-4]。
目前,葡萄的种植方式有常规种植、有机种植和生物动力种植。常规种植中,一般使用合成化肥、杀虫剂、杀菌剂、除草剂等进行田间管理[5]。有机种植则限制了这些合成制品的使用,种植过程中避免使用合成化肥和农药、转基因生物及其产物和其他合成添加剂,主要依靠堆肥、有机肥、菌肥等方法来提高葡萄园的土壤活力和生态多样性[6]。生物动力种植强调葡萄园的整体性和生物多样性,在各项田间管理的时间上使用特定的生物动力制剂,刺激土壤养分循环,采用特定的天文学日历进行施肥、修剪、播种等活动[7-8]。在有机葡萄酒和生物动力葡萄酒中,适应环境条件的本土酵母非常重要,它们直接影响葡萄酒的风土特征[9-10],促进微生物多样性的形成,使葡萄酒保留典型的感官特征,并具有更复杂的风味[11]。
不同种植模式影响葡萄表面及葡萄园中的酵母菌群结构[12]。研究表明,有机葡萄栽培提高了葡萄和葡萄园的微生物群落多样性[13-14]。Hendgen等[15]在德国的长期试验中发现,在有机葡萄栽培中,采用覆盖植被等措施会影响表层土壤的真菌群落组成,使表土细菌生物多样性增加,而不会影响其物种丰富度。Radić等[16]研究发现,与常规管理相比,有机管理下葡萄藤和相关杂草根器官的真菌内生菌定殖、物种丰富度、多样性指数更高。Setati等[17]从南非传统种植和生物动力种植相邻的葡萄园中采集葡萄样品,发现生物动力葡萄园展示了独特的生物多样性和丰富的物种构成。然而,我国葡萄酒行业的有机栽培和生物动力法栽培刚刚起步,这些种植模式对本土葡萄酒微生物的影响鲜见报道,因此研究不同种植模式下酵母菌多样性差异对葡萄酒质量的提高具有重要意义。
本研究采用WLN培养基形态学鉴定和26S rDNA D1/D2区序列分析,以贺兰山东麓银川产区有机种植、生物动力种植和常规种植模式下的‘赤霞珠’葡萄为原料,分析其自然发酵过程中酵母菌群的动态变化,旨在明确不同种植模式对葡萄酒发酵过程中酵母菌群的影响,以期为葡萄种植模式的选择和本土酵母菌株的开发与利用提供理论依据。
1 材料与方法
1.1 材料
原料来自宁夏贺兰山东麓银川产区2020年份的‘赤霞珠’葡萄,设置有机种植(ORG)及常规种植对照组(ORGc),生物动力种植组(BND)及常规种植对照组(BNDc)。因有机种植(106°27′E,38°06′N)和生物动力(106°26′E,38°31′N)种植园区相距较远,故每种模式都设有对照。常规种植葡萄园按照产区葡萄园管理规范进行管理,如使用杀虫剂等预防葡萄疾病,施用化肥,采用清耕法除草等;有机种植近5年来按照国家“有机产品”标准[18]要求进行管理;生物动力种植近五年来按照“Demeter生物动力认证”[19]要求进行管理。
培养基及主要试剂:WLN营养琼脂培养基、YPD培养基(青岛高科技工业园海博生物技术有限公司);引物NL1和NL4(上海生工生物工程股份有限公司);DNA裂解液(2% Titiov 1% SDS、10 mmol Tris、1 mmol EDTA、100 mmol NaCl);TE缓冲液;IMTris(pH=7.5);0.5 mol·L-1EDTA(pH=8.0);RNase;10×PCR Buffer(含Mg2+);Taq Plus DNA聚合酶;50×TAE。
主要仪器:高压蒸汽灭菌锅(LDZX-50FBS),上海申安医疗器械厂;电泳仪(DYY-6C),北京六一生物科技有限公司;电泳槽凝胶成像仪(DYCP-32B),北京六一仪器厂;PCR仪(844-0069),德国耶拿分析仪器股份公司;全自动凝胶成像仪(Champ Gel 15000),北京赛智创业科技有限公司。
1.2 方法
1.2.1 葡萄汁发酵试验
每个葡萄园随机采集45 kg健康、无破损的葡萄,并在采集当天置于冷冻盒中运回实验室,在无菌环境下破碎后,每15 kg放于10 L发酵罐(发酵体积为8 L)中进行发酵,添加60 mg·L-1焦亚硫酸钾、30 mg·L-1果胶酶,5~6 ℃浸渍48 h,然后26~28 ℃控温发酵,采用CO2失重法监控发酵过程(连续两天失重为0.1 g视为发酵结束)。3个发酵重复。
1.2.2 酵母菌分离、纯化与保藏
在破碎的第0、2、4、6、8天(发酵结束)5个时期取样,根据不同时期选用各自合适的稀释梯度在WLN培养基上进行涂布,添加青霉素抑制细菌生长,于28 ℃培养3~5 d,根据菌落的菌株形态选取50~60个酵母单菌落进行纯化;纯化后的酵母菌使用YPD液体培养基进行活化,活化菌液置于20%的无菌甘油中,-80 ℃条件下保藏备用。
1.2.3 酵母菌26S rDNA D1/D2区分子鉴定
酵母菌DNA的提取采用石英砂破壁法。酵母菌的26S rDNA D1/D2区序列扩增参考Wang等[20]的方法进行,具体的PCR扩增体系与扩增程序如下。
PCR 扩增体系( 25 μL ) : 引 物N L 1(5'-GCATATCAATAAGCGGAGGAAAAG-3')和NL4(5'-GGTCCGTGTTTCAAGACGG-3')各0.5 μL,10×Easy Taq Buffer 2.5 μL,2.5 mmol·L-1dNTPs 2 μL,10×Easy Taq Buffer Polymerase 0.25 μL,酵母菌DNA模板1 μL,加ddH2O至25 μL。
PCR扩增程序:95 ℃下预变性5 min;94 ℃变性1 min,52 ℃退火1 min ,72 ℃延伸80 s,循环36次;72 ℃保温8 min。PCR产物经2%琼脂糖凝胶电泳(电压110 V,电流90 mA,时间约40 min)进行检验。
将PCR扩增产物送至生工(上海)生物工程股份有限公司进行测序。测序结果与NCBI数据库进行同源性对比。
1.3 数据处理
试验数据使用Excel进行统计分析,绘图使用软件Origin 2021。
2 结果与分析
2.1 基本理化指标
按照葡萄酒国家标准[21]测定了未发酵葡萄醪及其发酵结束时样品的基本理化指标(表1)。由表1可知,4组样品葡萄醪的含糖量分别为223.00、224.67、226.33、223.00 g·L-1,且BND的含糖量最高,ORG和BNDc的含糖量最低。4组样品发酵结束时的含糖量均低于4.0 g·L-1,表明样品均已完成酒精发酵,ORGc酒精度最高(13.68%),BND的酒精度(12.85%)最低。BND的糖-酒精转化率明显低于其他组,推测其发酵过程中副产物占比较大,有筛选出低产乙醇酵母的可能,后续可以做其酿酒特性的相关研究。葡萄醪的总酸总体在4.09~4.50 g·L-1,pH在3.50~3.90。发酵结束时,ORG和ORGc的总酸有较为明显的升高,BND和BNDc的总酸变化较小,pH总体在3.80~3.95。
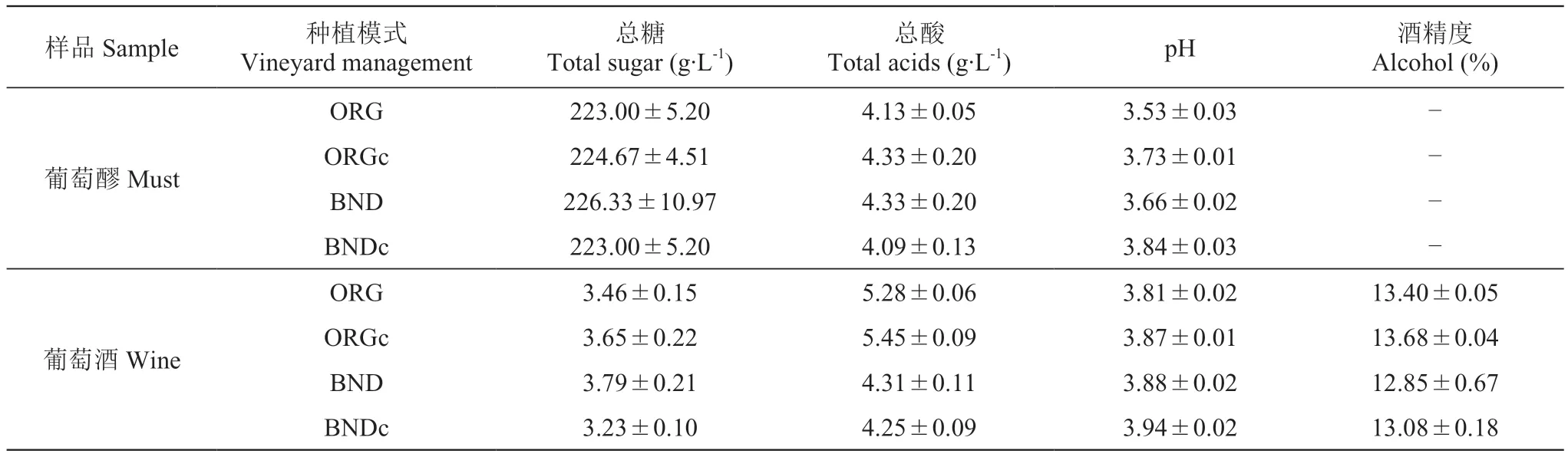
表1 葡萄醪及其发酵结束时葡萄酒的基本理化指标Table 1 Basic physicochemical indexes of grape must and final wine
2.2 酵母菌WLN形态学鉴定结果
本研究于不同种植模式、不同发酵时期共分离出1075株酵母菌。根据WLN琼脂培养基上所表现出的特点,将所有酵母菌初步分为16个类型(I~XⅥ),结果见图1,菌株菌落形态及数量统计见表2。

图1 WLN培养基上酵母菌种的不同形态Figure 1 Different morphologies of yeasts on WLN medium
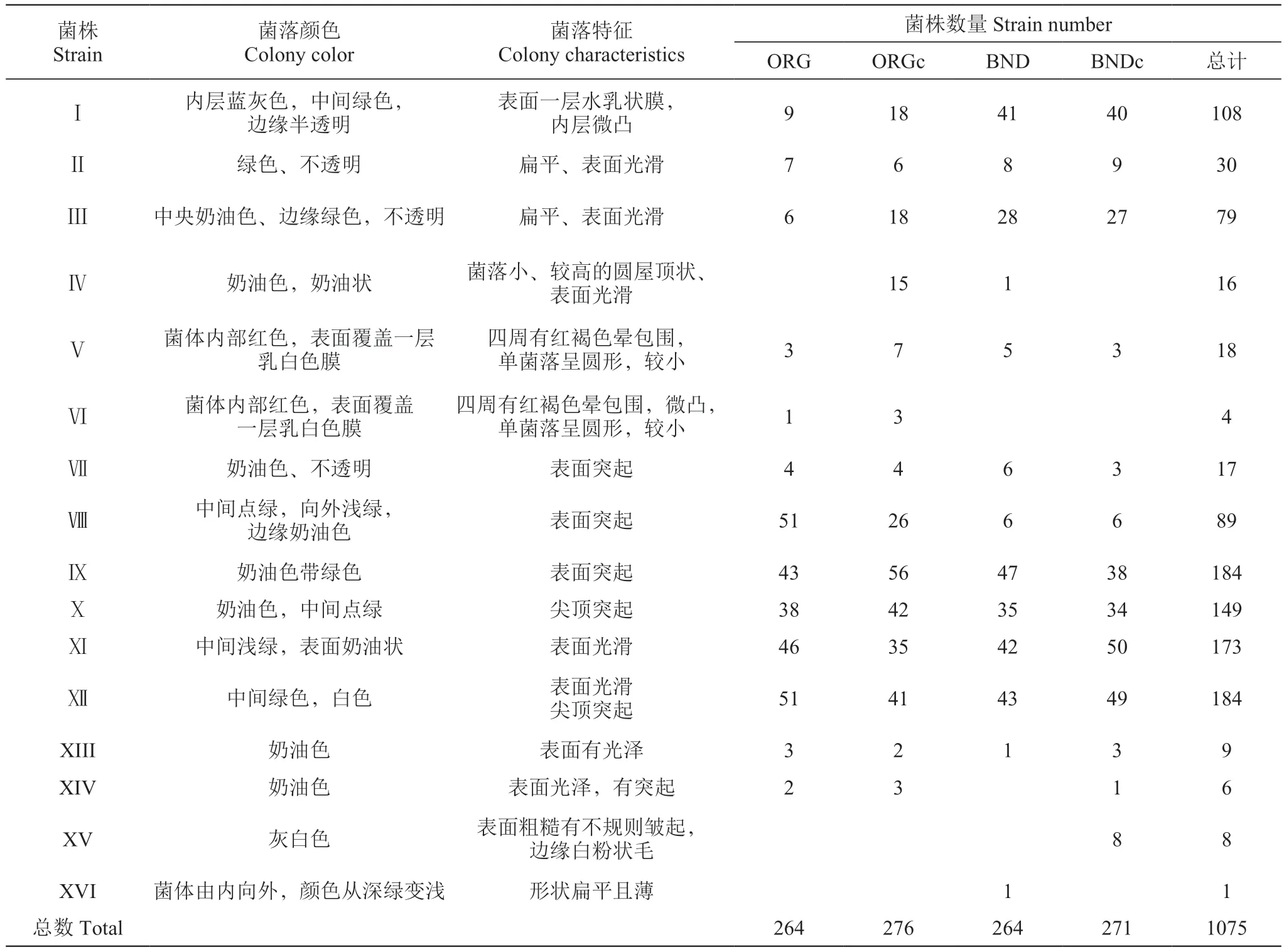
表2 酵母菌的WLN形态特征及分类结果Table 2 WLN morphological characteristics and classification results of yeast
在不同种植模式下分离出的酵母菌的WLN类型及其数量差异较大。由表2可知,ORG共有264个菌落,其中类型Ⅷ和Ⅻ的数量最多,均是51株,分别占分离自ORG总菌株的19.32%;类型Ⅵ和XⅣ数量最少,分别是1株和2株。ORGc共有276个菌落,其中类型Ⅸ的数量最多,共56株酵母菌,占分离自ORGc总菌数的20.29%;数量最少的是类型XⅢ,只有2株。BND共有264个菌落,其中类型Ⅸ的数量最多,共47株酵母菌,占分离自BND总菌数的17.80%;数量最少的是类型Ⅳ、XⅢ和XⅥ,均有1株。BNDc共有271个菌落,其中类型Ⅺ的数量最多,共50株酵母菌,占分离自BNDc总菌数的18.45%;数量最少的是类型XⅣ,只有1株。
2.3 26S rDNA D1/D2区序列分析
对W L N 形态鉴定出来的1 6 个类型,在不同种植条件下自然发酵的各时期随机选取1~3株代表菌株进行26S rDNA的D1/D2区测序鉴定。结果表明,测序菌株PCR片段大小为486~626 bp。经26S rDNA D1/D2区序列分析被归为8属9种(表3),分别为葡萄汁有孢汉逊酵母(Hanseniasporauvarum)、假丝酵母(Candida zemplinina)、拜尔接合酵母(Zygosaccharomyces bailii)、美极梅奇酵母(Metschnikowia pulcherrima)、桃梅奇酵母(Metschnikowia fructicola)、酿酒酵母菌(Saccharomyces cerevisiae)、隐球酵母(Cryptococcus saitoi)、库德毕赤酵母(Pichia kudriavzevii)、单孢酿酒酵母(Kazachstania bulderi)。其中,酿酒酵母在WLN培养基上表现出6种菌落形态(分别为Ⅶ、Ⅷ、Ⅸ、X、Ⅺ、XⅡ),葡萄汁有孢汉逊酵母和隐球酵母在WLN培养基上表现出2种菌落形态(分别为I、Ⅱ和XⅢ、XⅣ),而C.zemplinina、Z.bailii、M.pulcherrima、M.fructicola、P.kudriavzevii和K.bulderi这6种酵母菌均只表现出1种形态(分别对应WLN类型中的Ⅲ、Ⅳ、Ⅴ、Ⅵ、XⅤ、XⅥ)。

表3 测序菌株片断大小及与相关菌株的序列相似性Table 3 Size of the fragment and sequence similarity to related strains
2.4 自然发酵各阶段酵母群落结构演替及差异比较
由图2 可见,在未发酵的葡萄醪中,O RG 有6种酵母菌,其中H.uvarum为优势酵母,占酵母总数的33.33%;而S.cerevisae、C.zemplinina、M.pulcherrima、M.fructicola、C.saitoi占比分别为16.67%、12.50%、12.50%、4.17%和20.83%。ORGc有7种酵母菌,其中H.uvarum为优势酵母,占酵母总数的33.33%;而Z.bailii、C.saitoi、M.fructicola、M.pulcherrima、C.zemplinina、S.cerevisiae占比分别为2.78%、13.89%、8.33%、19.44%、11.11%和11.11%。BND有6种酵母菌,H.uvarum、S.cerevisiae两种酵母占比最高,均占酵母总数的25.00%;而Z.bailii、C.saitoi、C.zemplinina、M.pulcherrima占比分别为4.17%、4.17%、20.83%和20.83%。BNDc有6种酵母菌,H.uvarum占酵母总数的25.81%为优势酵母;P.kudriavzevii、M.pulcherrima、C.saitoi、C.zemplinina、S.cerevisiae占比分别为19.35%、9.68%、12.90%、22.85%和9.68%。
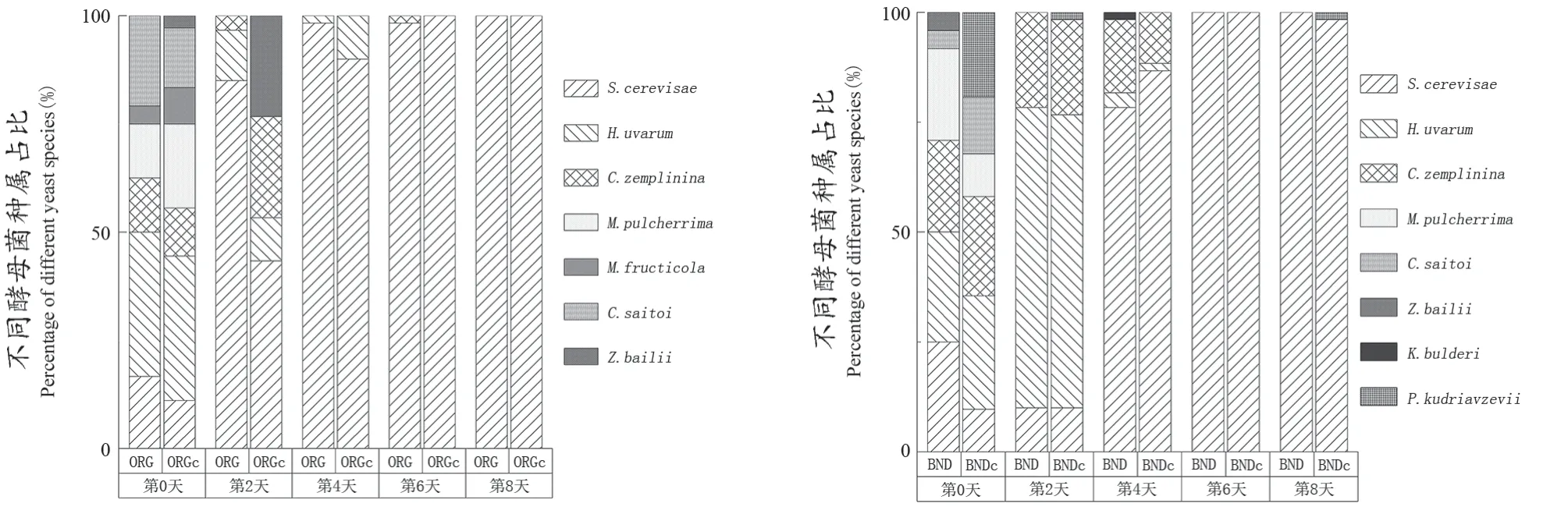
图2 不同种植模式处理下不同时期酵母菌种属占比Figure 2 Proportion of yeast species in different periods under different vineyard managements
在葡萄酒发酵过程中,不同酵母菌种属的比例表现出较大差异。ORG在第0天以非酿酒酵母为主,从第2天开始,酿酒酵母菌株开始占据主导地位,H.uvarum还有一定占比,第4、6、8天以酿酒酵母占据绝大多数,完全取代非酿酒酵母;ORGc在第0天以非酿酒酵母为主,在第2天酿酒酵母占比上升到43.3%,非酿酒酵母菌占比明显高于ORG,从第4天到第8天,酿酒酵母为优势酵母,第4天占比90%以上,第6天、第8天占比达到100%;BND在第0天、第2天均以非酿酒酵母为主,在第4天酿酒酵母占主导地位,但是非酿酒酵母仍有21.7%的占比,第6天、第8天酿酒酵母占比达到100%;BNDc在第0天、第2天均以非酿酒酵母为主,在第4天,酿酒酵母占主导地位,非酿酒酵母只有13.3%的占比,第6天酿酒酵母占比达到100%,第8天酿酒酵母占比98.3%。
3 讨论与结论
本研究从宁夏贺兰山东麓银川产区的有机种植、生物动力种植与常规种植模式的‘赤霞珠’葡萄自然发酵样品中共分离到1075株酵母菌,采用WLN培养基形态分类和26S rDNA D1/D2区序列分析进行了菌种鉴定。将其归为8属9种,分别是H.uvarum、C.zemplinina、Z.bailii、M.pulcherrima、M.fructicola、S.cerevisae、C.saitoi、P.kudriavzevii、K.bulderi。值得关注的是,与此前该产区分离出的酵母结果相比[22-23],有孢汉逊酵母属(Hanseniaspora)、酵母属(Saccharomyces)、毕赤酵母属(Pichia)、隐球酵母属(Cryptococcus)、梅奇酵母属(Metschnikowia)、假丝酵母属(Candida)较为常见,而拜尔接合酵母(Z.bailii),以及单孢酿酒酵母(K.bulderi)鲜见报道。在常规种植模式下,葡萄醪中发现的Z.bailii酵母通常对许多不利条件具有极强的耐受性,例如高渗透压、低pH和各种食品防腐剂[24],有较大可能性存活于使用化学合成试剂的常规种植模式,因其对乙醇更敏感[25],所以在酒精发酵过程中减少,酿酒酵母成为优势菌种。相关研究表明,在生物动力种植模式下,葡萄发酵第4天新增的酵母菌K.bulderi能够在低pH条件下依靠葡萄糖和δ-葡萄糖酸内酯有效生长,这种独特性使K.bulderi成为低pH发酵过程的理想菌种[26]。
与陈学莲等[27]研究相比,在同一生物动力种植模式下,两研究均分离出了9种酵母菌,酵母菌多样性水平相近,但除H.uvarum和S.cerevisae外,其他7种酵母均不相同,表明酵母菌种类在两年份之间存在较大差异。在常规种植模式下,本研究分离出6种酵母菌,比陈学莲等[27]的结果少1种,但M.pulcherrima、H.uvarum和S.cerevisae酵母菌均被分离出,表明常规种植模式下,两年份之间酵母菌种类差异小。
本研究中,不同种植模式下的葡萄自然发酵中的酵母群落结构有一定的差异,尤其是生物动力种植模式对‘赤霞珠’葡萄酒发酵中的酵母多样性具有积极影响。生物动力种植组的酵母菌多样性最高,该种植模式下的葡萄酒自然发酵过程中出现了7属7种酵母菌,即S.cerevisiae、H.uvarum、C.zemplinina、M.pulcherrima、C.saitoi、Z.bailii和K.bulderi。Bagheri等[28]也发现,生物动力种植中分离出的酵母多样性更高,与本研究结果类似。
本文探究了宁夏贺兰山东麓产区3种种植模式下的‘赤霞珠’葡萄在自然发酵过程中的酵母菌群演替,为利用有机种植、生物动力种植葡萄酒的生产提供了理论依据。后续可进一步研究有机种植模式和生物动力种植模式对‘赤霞珠’葡萄酒的酵母菌代谢产物和香气成分等发酵特性的影响,为葡萄种植模式的选择和本土酵母的开发利用提供更多依据。
