一株拜耳接合酵母菌的基本性能及发酵香气研究
2023-12-03汤晓宏丁燕钟轲荆晓姝韩晓梅李志宇杨阳孙玉霞
汤晓宏,丁燕,钟轲,荆晓姝,韩晓梅,李志宇,杨阳,孙玉霞*
(山东省葡萄研究院/山东省酿酒葡萄与葡萄酒技术创新中心,山东济南 250100)
在食品产业中,拜耳接合酵母(Zygosaccharomyces bailii)被普遍认为是一株腐败酵母,能够导致蛋黄酱、沙拉酱、调味汁和葡萄酒等食品的腐败,给食品企业造成巨大经济损失。Z.bailii之所以能成为腐败酵母,是由于其对各种胁迫环境的特殊耐受性,特别是对弱酸的显著耐受性,而弱酸常被用作食品防腐剂,例如:乙酸、苯甲酸、丙酸、山梨酸和二氧化硫。尽管早期Z.bailii被认为是食品中的有害微生物,但近年来研究表明,Z.bailii作为食品发酵的微生物具有潜在的生物学价值[1-2],如它对葡萄酒组成和风味形成有积极贡献。Zuehlke等[3]对几株拜尔接合酵母进行研究发现,在‘赤霞珠’葡萄酒的酒精含量13%时,Z.bailiiB2能去除酒中残留的果糖(果糖>60%),达到发酵干型葡萄酒的目的。Escribano-Viana等[4]研究了几株非酿酒酵母与酿酒酵母混菌发酵对‘丹魄’葡萄酒的影响,结果发现,Z.bailii不仅能改善单体花青素组成,还能提高二苯乙烯的含量,提升葡萄酒品质。Garavaglia等[5]研究了Z.bailiiBCV 08混菌发酵对葡萄酒香气品质的影响,结果发现,在所有含有Z.bailiiBCV 08的试验中,乙酯类香气化合物的含量均比对照有所增加。
混菌通常包括酿酒酵母菌和非酿酒酵母菌,通过混菌发酵,能够丰富葡萄酒中的香气成分,增加香气的层次感,因此近些年的研究较多[6-8]。葡萄中富含葡萄糖和果糖,混菌发酵中的微生物优先转化利用葡萄糖,其次是果糖,导致酒精发酵周期延长[9]。另外,混菌中的微生物竞争激烈,在碳源丰富时期,优势菌在整个发酵过程中大量繁殖,而劣势菌可能自始至终都难以发挥预期的作用,从而导致同时期的葡萄酒品质产生差异[10]。因此,提供一种既能在发酵过程中减少混菌竞争、又能改善葡萄酒香气的微生物在葡萄酒酿造中具有重要意义。
1 材料与方法
1.1 材料
‘小芒森’葡萄:2021年10月取自蓬莱,可溶性固形物25.6 %,总酸5.6 g·L-1,pH 3.56。
拜耳接合酵母(Z.bailii)JDCD01保藏于中国典型培养物保藏中心(简称CCTCC),保藏编号为CCTCC NO: M2022204;酿酒酵母(Saccharomyces cerevisiae)EC1118:烟台帝伯仕自酿机有限公司。
①YPD液体培养基(葡萄糖培养基):酵母浸粉10 g·L-1,蛋白胨20 g·L-1,葡萄糖20 g·L-1,自然pH;
②自制果糖培养基:在YPD液体培养基的基础上略作改动,将20 g·L-1的葡萄糖改为果糖20 g·L-1,其它不变;
③自制双糖培养基:在YPD液体培养基的基础上略作改动,将20 g·L-1的葡萄糖改为葡萄糖10 g·L-1,果糖10 g·L-1,其它不变;
④模拟葡萄汁(M4241D):葡萄糖100 g·L-1,果糖100 g·L-1,酒石酸3 g·L-1,柠檬酸0.3 g·L-1,L-苹果酸为0.3 g·L-1,MgSO4·7H2O 0.2 g·L-1,(NH4)2SO40.3 g·L-1,天冬酰胺0.6 g·L-1,MnSO4·H2O 4 mg·L-1,ZnSO4·7H2O 4 mg·L-1,CuSO4·5H2O 1 mg·L-1,KI 1 mg·L-1,H3BO31 mg·L-1,(NH4)6Mo7O24·4H2O 1 mg·L-1,CoCl2·6H2O 4 mg·L-1,肌醇0.3 g·L-1,生物素0.04 mg·L-1,维生素B11 mg·L-1,维生素B61 mg·L-1,烟酸为1 mg·L-1,泛酸1 mg·L-1,对氨基苯甲酸1 mg·L-1,购自山东拓扑生物工程有限公司。
发酵液制备:‘小芒森’除梗破碎,压榨取汁,室温8000 r·min-1离心5 min,先经0.8 µm滤膜过滤后,再用0.45 µm无菌滤膜过滤,备用。
1.2 仪器和设备
DXL100A全自动高压蒸汽灭菌器(山东德祥仪器有限公司);Eppendorf Centrifuge 5810R冷冻离心机(德国);Agilent 1260 InfinityⅡ高效液相色谱仪(Hi-Plex H型色谱柱:300×7.7 mm),7890A-5977B型GC-MS联用仪(DB-WAX型色谱柱:60 m×0.32 mm×0.25 μm),美国Agilent公司;DVB/CAR/PDMS型萃取头(50/30 μm),美国Supelco公司。
1.3 试验方法
1.3.1 JDCD01生长曲线及其对应酶活
菌种的活化:取1环JDCD01加入YPD液体培养基中,在28 ℃、200 r·min-1条件下震荡培养24 h,然后20 ℃、8000 r·min-1离心5 min,收集新鲜菌体。
接种培养:称取0.25 g新鲜的JDCD01,加至100 mL YPD液体培养基中,第1组在28 ℃、200 r·min-1条件下震荡培养,第2组置于28 ℃恒温培养箱中静置培养,每组3个重复。
生长曲线:分别在0、4、8、12、16、20、24、32、48、72、96、120 h对第1组取样,测定菌悬液在600 nm波长处的吸光度值,以培养时间为横坐标,吸光度值为纵坐标,绘制生长曲线。
酶活曲线:分别在接种后的24、32、48、72、96、120 h对第1组和第2组进行取样,测定β-葡萄糖苷酶活性,以培养时间为横坐标,酶活为纵坐标,绘制累计酶活[11]曲线。
1.3.2 JDCD01对葡萄糖、果糖的利用
用1 μL接种环取1环活化后的JDCD01、EC1118(对照)分别接种于不同糖源组成的①~④号培养基中,每隔2 d取样1次,采用HPLC法测定葡萄糖和果糖组成。
1.3.3 JDCD01对酿造环境的耐受性
以EC1118为对照,用1 μL接种环取一环JDCD01分别接种于葡萄糖和果糖质量浓度均为(10%、20%、30%、40%)、酒精梯度(6%、8%、10%、12%、14%、16%、18%,Vol)、pH(2.5、3.0、3.5、4.0、4.5)、渗透压(以KCl浓度计,0.8、1.0、2.4、2.6、2.8 mol·L-1)、SO2质量浓度(100、150、200、250、300、350、400、500 mg·L-1)、温度(11、12、13、38、39、47、48 ℃)的装有5 mL YPD液体培养基的带杜氏管的试管中,28 ℃恒温培养1周,观察其生长状况。
1.3.4 JDCD01的发酵特性研究
取1环斜面JDCD01,接种于YPD液体培养基中,28 ℃ 200 r·min-1摇床培养24 h收集菌体,无菌水清洗3次,备用。每瓶(800 mL)灭菌‘小芒森’葡萄汁接种0.5 g鲜菌体,接种浓度约为107cfu·mL-1;顺序发酵组先接种0.25 g JDCD01鲜菌体,20 ℃条件下发酵48 h后,再接种0.25 g EC1118鲜菌体;所有发酵组合都在20 ℃条件下进行,发酵过程中每天测定CO2损失量[12],直到相邻两次失重差小于0.2 g。结束发酵,存于-20 ℃冰箱,取样测葡萄酒理化指标及香气组成,以EC1118为对照。
1.3.5 高效液相色谱仪测葡萄糖/果糖组成
高效液相色谱工作条件:色谱柱为Hi-Plex H,300 mm×7.7 mm;流动相为0.05 mol·L-1硫酸溶液,流量0.6 mL·min-1;柱温70 ℃;示差检测器,检测温度30 ℃,进样量20 μL。
外标法定量:分别精密称取200.00 mg的葡萄糖和果糖于10 mL容量瓶中,超纯水定容,即得20 g·L-1的混标溶液,按一定浓度作梯度稀释,制作标准曲线。
1.3.6 香气分析
取8 mL 1.3.4中发酵结束的葡萄酒样品,加入1.5 g NaCl和20 μL 2.00 g·L-1的4-甲基-2-戊醇(内标)于15 mL顶空瓶中,45 ℃预热10 min,然后萃取50 min,萃取过程中顶空瓶在搅拌器中连续振荡,进样口250 ℃解析10 min。
程序升温:初温40 ℃,以1 ℃·min-1升至45 ℃,保持2 min;以3 ℃·min-1升至84 ℃,保持2 min;然后以3 ℃·min-1升至120 ℃,保持3 min;以3 ℃·min-1升至200 ℃,再保持3 min;以5 ℃·min-1升至230 ℃,也保持3 min。进样器温度250 ℃;检测器温度25 ℃,不分流进样,恒流模式,流速0.8 mL·min-1。
MS条件:电子轰击(EI)离子源;电子能量为70 eV;离子源温度 200 ℃;接口温度 250 ℃;全扫描模式,质量扫描范围35~450 amu。
定性分析:将MS图运用计算机谱库(NIST14/NIST20)进行初步检索和分析,再结合相关文献资料对人工谱图进行解析,确定挥发性物质的各个化学成分。定量分析:采用内标法半定量分析,计算样品中各香气组分的含量。
1.3.7 感官分析
参照Martínez-Gil等[13]的方法,再结合国标(GB 15037—2006)中葡萄酒感官分级评价描述。邀请8名国家级的品酒师,分别从外观、香气、滋味、典型性等方面对酒样进行感官品评。品评结果以10分制计,从0到10分依次代表感官逐渐增强。根据定量描述结果绘制葡萄酒感官分析雷达图。
1.4 数据分析
采用SPSS 17.0软件进行数据分析,多组间比较采用One-Way ANOVA法,作图采用Excel 2007软件。
2 结果与分析
2.1 JDCD01生长曲线及其对应酶活
由图1可知,拜耳接合酵母JDCD01在振荡培养48 h左右生长曲线达到平衡期,开始迅速积累次级代谢产物,120 h摇床培养累计酶活高达116.8 U·L-1,β-葡萄糖苷酶酶活受氧气影响较大,静止与摇床培养120 h累计酶活相差68.1 U·L-1。
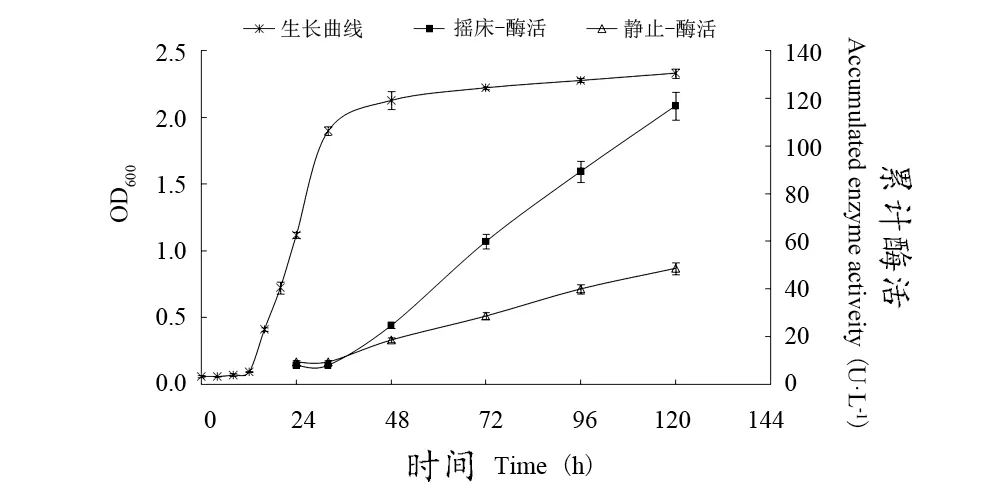
图1 JDCD01生长曲线及其β-葡萄糖苷酶累计酶活Figure 1 Growth curve of JDCD01 and corresponding enzyme activity
2.2 JDCD01对葡萄糖、果糖的利用
不管是葡萄糖或果糖单独存在,还是二者同时存在的情况下,拜耳接合酵母JDCD01对果糖的代谢速率都快于葡萄糖,而EC1118对果糖和葡萄糖的代谢速率与之相反(图2、3、4);也就是说,拜耳接合酵母JDCD01和EC1118对果糖和葡萄糖利用的优先顺序上不同,因此,在葡萄酒发酵中,可以将JDCD01和EC1118混合发酵,以减少菌株对碳源的竞争。
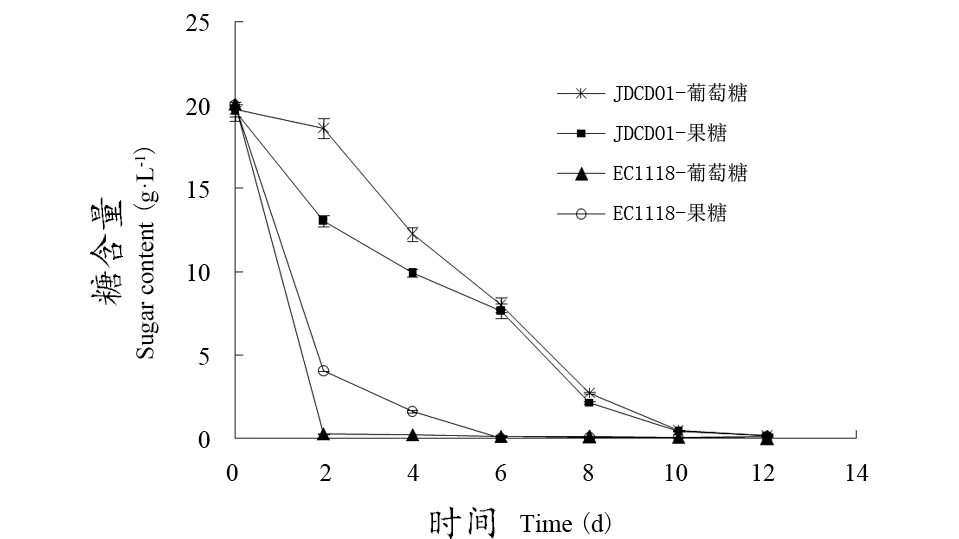
图2 在单一糖源培养基中JDCD01对糖的利用Figure 2 Utilization of sugar by JDCD01 in a single glycogen medium
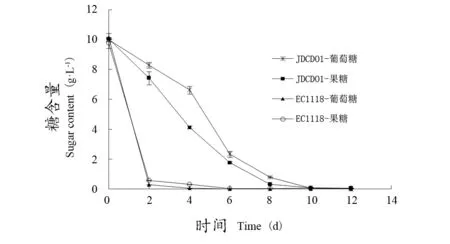
图3 在双糖源培养基中 JDCD01对糖的利用Figure 3 Utilization of sugar by JDCD01 in disglycogen medium

图4 模拟葡萄汁中JDCD01对葡萄糖和果糖的利用Figure 4 Metabolism of glucose or fructose by JDCD01 under fermentation conditions
2.3 JDCD01对酿造环境的耐受性
由表1可知,经试验观察菌株JDCD01对SO2、葡萄糖、果糖和pH的耐受性与EC1118相当,耐受能力较强,具有一定潜力。JDCD01对酒精、渗透压和低温的耐受性略低于EC1118。虽然JDCD01在低温10 ℃不生长,但将其放回室温仍能生长,说明此条件下只是抑制了它的生长,并未使其失活。

表1 JDCD01对酿造环境的耐受性Table 1 Brewing environment tolerance of JDCD01
2.4 JDCD01的发酵特性研究
在发酵过程中,碳水化合物代谢会产生乙醇、CO2和多种副产品。发酵过程的失重是CO2释放的结果。由图5可知,在前两周内,EC1118释放的CO2最多,发酵速率最快;JDCD01释放的CO2最少,发酵速率最慢;混菌发酵释放CO2的能力与EC1118接近。
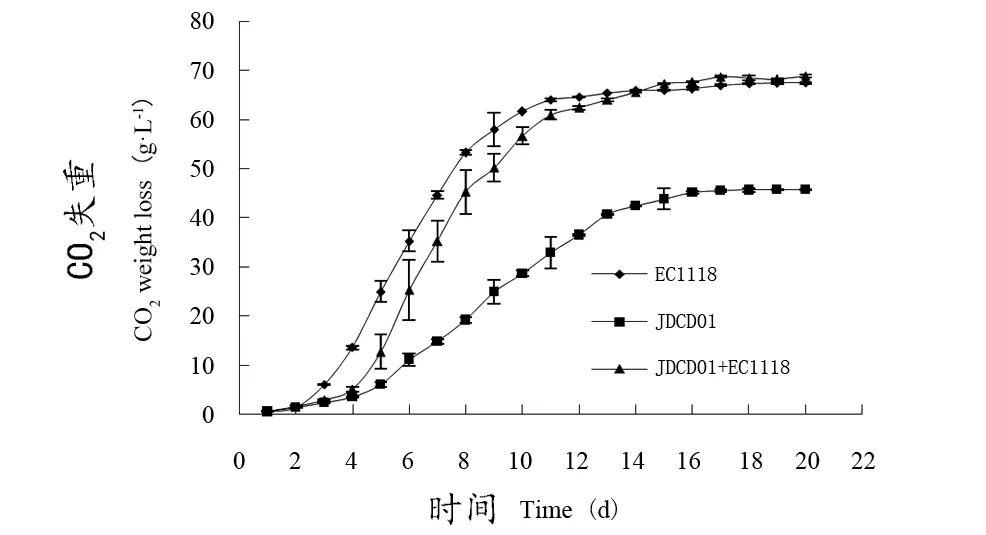
图5 混菌发酵过程中CO2累计失重变化Figure 5 Changes of CO2 accumulated weight loss in the mixed fermentation process
由表2可知,用JDCD01发酵的葡萄酒在发酵结束时(相邻两次CO2失重差小于0.2 g),葡萄糖剩余量为22.67 g·L-1,EC1118、JDCD01+EC1118组均发酵比较彻底。混菌发酵组不仅能够提高甘油产量,乙醇产量也更高一些,且能降低乙酸含量。
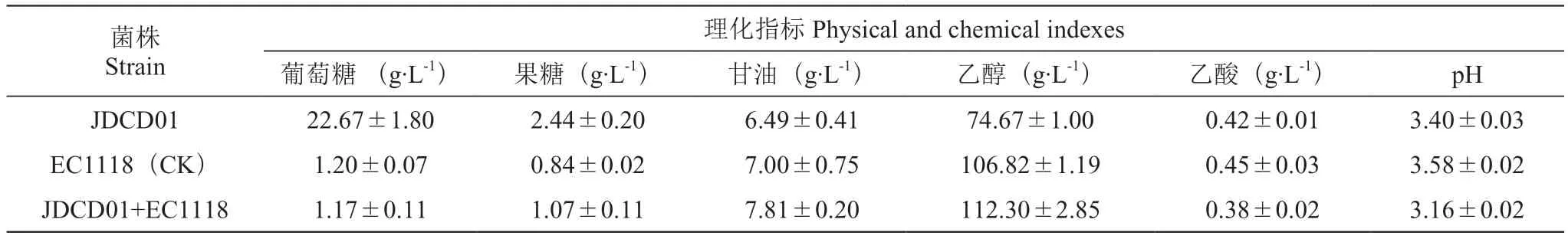
表2 不同菌株发酵的葡萄酒理化指标Table 2 Physicochemical indexes of wine fermented by different strains
通过GC-MS分析,3组发酵样品中都检测到了醇类、酮类、酸类、酯类、苯环类和萜烯类等香气组分。对照组EC1118检测出31种香气成分,总含量为152.03 mg·L-1;拜耳接合酵母JDCD01共检测出31种香气成分,总含量为155.87 mg·L-1;EC1118和JDCD01混菌发酵共检测出32种香气成分,总含量为143.32 mg·L-1,JDCD01 16 500 400 400 2.5 2.6 12 EC1118 18 500 400 400 2.5 2.8 10具体香气组成见表3。
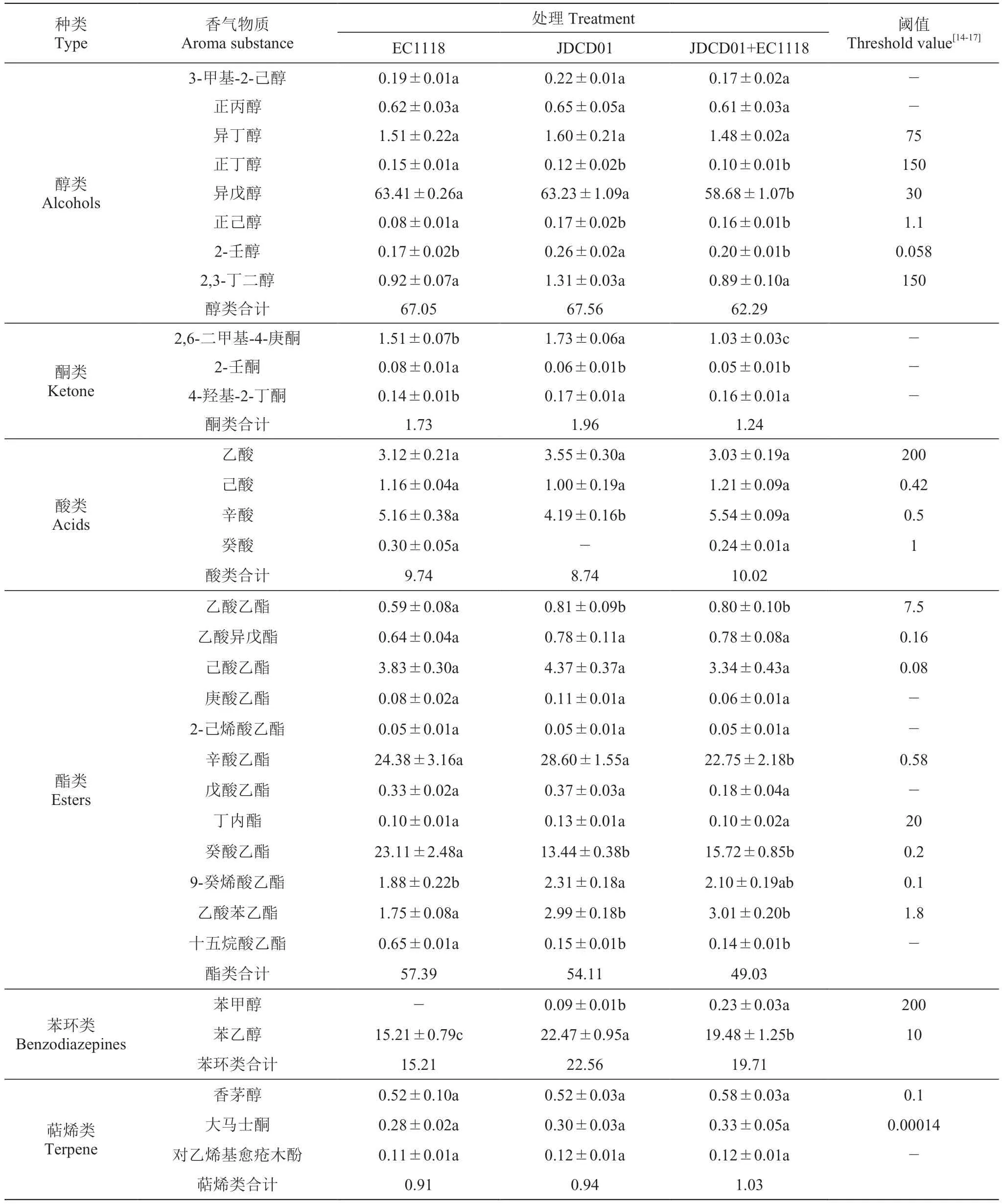
表3 不同菌株发酵的葡萄酒香气成分Table 3 Aroma composition of wine fermented by different strains mg·L-1
从表3可以看出,JDCD01纯种发酵和两种酵母顺序接种的发酵萜烯类香气含量略高于对照组。JDCD01纯种发酵的葡萄酒苯乙醇、2,3-丁二醇、辛酸乙酯、9-癸烯酸乙酯等香气成分的含量更为丰富;EC1118纯种发酵的葡萄酒酯类化合物略高,特别是癸酸乙酯的含量高达23.11 mg·L-1;两种酵母顺序接种的辛酸、乙酸苯乙酯、香茅醇和大马士酮高于纯种发酵组。
2.5 主成分分析
对不同发酵组合酒样的所有香气成分进行主成分分析,3种组合发酵方式的香气成分(含量大于阈值,即OAV>1)差异及分布情况如图6所示。
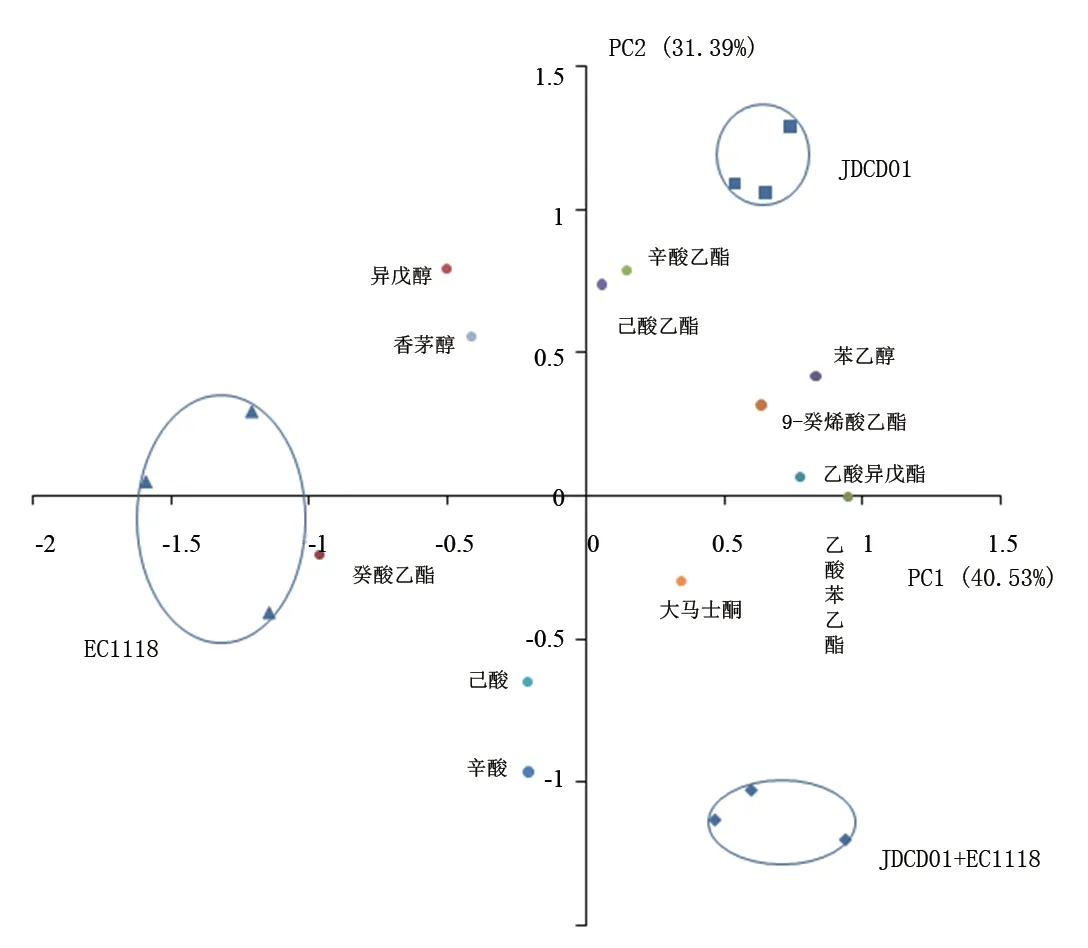
图6 葡萄酒样品中挥发性有机物的PCA图Figure 6 PCA diagram of volatile compounds in wine
由图6可知,PCA分析中3个平行样品大致能聚到一起,说明试验平行效果良好。添加不同酵母组合的发酵样品都分布在不同的项限,说明不同组合之间差异明显。PC1和PC2的方差贡献率分别为40.53%和31.39%。提取出的前两个主成分对整体方差的累计贡献率达到71.92%,表明这两个主成分可代表酒样挥发性香气物质的主要特征。JDCD01分布在第1项限,对应特征香气成分为苯乙醇、辛酸乙酯、己酸乙酯、9-癸烯酸乙酯和乙酸异戊酯;EC1118在第一主成分的负半轴,对应特征香气成分为癸酸乙酯、异戊醇、香茅醇、己酸和辛酸;JDCD01和EC1118顺序接种发酵分布在第4项限,对应特征香气成分为大马士酮和乙酸苯乙酯。
2.6 感官分析
采用定量描述分析法对不同接种方式的葡萄酒样品进行感官评价。由8位评委分别从:视觉(色泽、澄清度),香气(浓郁度、花香、果香、酒香),滋味(甜味、酸味、酒体饱满度、平衡感、持久性)和典型性等11个属性对不同组合方式发酵的葡萄酒样品进行品评,根据定量描述结果做感官分析雷达图,如图7所示。
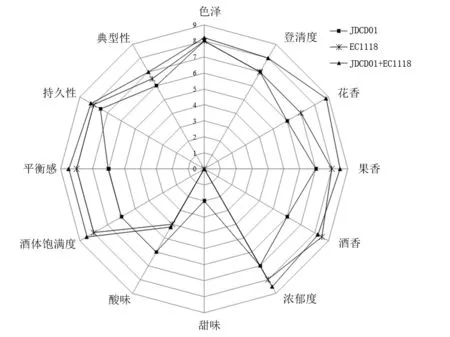
图7 葡萄酒酒感官分析雷达图Figure 7 Radar map of sensory analysis for wine
从外观方面来看,JDCD01和EC1118共同发酵组的葡萄酒样品更澄清,色泽更鲜亮。从香气角度分析,JDCD01和EC1118共同发酵的葡萄酒样品花香更突出;EC1118发酵的果香更突出,但也略低于顺序接种发酵组;JDCD01单独发酵表现出更多的焦糖甜香。从风味角度分析,JDCD01和EC1118顺序发酵葡萄酒样品酸度适中,口感更加柔顺、酒体更饱满,其次是EC1118单独发酵的葡萄酒,JDCD01单独发酵的葡萄酒酸度更突出。总体来看,JDCD01和EC1118顺序接种发酵有利于提高葡萄酒香气品质。
3 讨论与结论
混菌发酵中的微生物竞争激烈,葡萄糖、果糖等底物不同会引起代谢产物的差异。有研究发现,相较于葡萄糖而言,拜耳接合酵母更倾向于利用果糖[5,18],这与本研究结果一致。不管葡萄糖或果糖单独存在还是同时存在的情况下,拜耳接合酵母JDCD01对果糖的代谢速率均快于葡萄糖,这与酿酒酵母EC1118相反。因此,在葡萄酒发酵中,可以将JDCD01和EC1118混合发酵,以减少菌株对碳源的竞争。
非酿酒酵母主要在葡萄酒浸渍和发酵初期发挥作用,相对于酿酒酵母,非酿酒酵母各方面的耐受能力都低于酿酒酵母。刘宜睿等[19]从桑葚自然发酵汁和桑葚果表皮中分离纯化出的4株产香非酿酒酵母耐酒精能力为9%,远低于本试验JDCD01的耐受性;刘灿珍等[20]研究发现,戴尔有孢圆酵母对乙醇的耐受浓度为18%,对SO2和葡萄糖的耐受性分别为420 mg·L-1和500 g·L-1,对SO2的耐受性远低于本试验中JDCD01的耐受性,说明不同酵母间耐受性差异较大;董琦楠等[21]研究发现,非酿酒酵母菌株LT1能耐受酒精度为12%、耐受糖浓度为400 g·L-1及pH最低2.75;庄孝杰等[22]通过试验获取了一株性状优良的Z.bailii15,可耐受pH 2.0和37 ℃高温及8%酒精度,较模式株更适应酿造环境。本研究筛选的非酿酒酵母JDCD01的酒精耐受性为16%,葡萄糖和果糖耐受性均为400 g·L-1,KCl耐受性为2.6 mol·L-1,SO2耐受性为500 mg·L-1,pH耐受性为2.5~4.5,温度耐受范围为12~48 ℃,适应葡萄酒酿造环境。
Z.bailii作为食品发酵微生物具有潜在的生物学价值,例如它能产生乙酯类化合物,对葡萄酒风味形成有积极贡献。Ciani等[23]研究发现,Z.bailii产生高水平的乙酸苯乙酯、乙酸异戊酯和乙酸乙酯,这与本试验结果一致,不管是JDCD01纯种发酵还是与EC1118混合发酵,这3种物质的含量都增加。此外,本试验的拜耳接合酵母JDCD01还能提高萜烯类化合物和苯乙醇的含量。萜烯类化合物是一类具有特殊芳香气味的化合物,且阈值很低,容易被感知,可以提高葡萄酒香气品质。苯乙醇是葡萄中苯丙酸代谢的衍生物,它拥有玫瑰般的清甜香气[24-25]。Cioch-Skoneczny等[26]研究了不同酵母组合发酵,以改善冷气候条件下葡萄酒香气,结果发现Z.bailii749产苯乙醇能力很低,它与S.cerevisiaeMH020215不同比例混合发酵能明显提升苯乙醇含量。在本试验中,JDCD01菌株发酵液中苯乙醇含量最高,达到22.47 mg·L-1;其次为混菌发酵,最低的是EC1118纯种发酵。混菌发酵和JDCD01纯种发酵,苯乙醇的含量分别是EC1118的1.28倍和1.48倍。由此可见,混菌发酵和JDCD01纯种发酵有利于突出玫瑰清甜香气特征。
综上所述,JDCD01的耐受性指标如下:酒精16%,葡萄糖400 g·L-1,果糖400 g·L-1,KCl 2.6 mol·L-1,SO2500 mg·L-1,pH 2.5~4.5,温度12~48 ℃,适应葡萄酒酿造环境。在混菌发酵过程中,JDCD01能优先利用果糖,减少混菌发酵过程中对糖源的竞争,使菌株能够充分发挥各自的性能。不管是纯种发酵还是顺序接种发酵,JDCD01均提高了葡萄酒中苯乙醇、乙酸乙酯、乙酸异戊酯、乙酸苯乙酯等香气成分的含量,丰富了葡萄酒的香气。
