薄壁空洞型肺结核和肺癌CT诊断与鉴别诊断
2023-12-03老桂红
老桂红 李 萌
1.广东省第一荣军医院放射科 (广东 广州 510220)
2.广州医科大学第二附属医院放射科 (广东 广州 510260)
肺癌是目前发病率最高的恶性肿瘤之一,其中薄壁囊腔型肺癌是一种不典型的肺癌,已得到广泛的临床关注和认识[1]。薄壁空洞型肺结核为结核病灶长期慢性进展,炎性物质吸收、排出导致空洞壁变薄或病灶内坏死液化物质排出后所致[2]。γ干扰素释放试验(interferon-γrelease assay,IGRA)利用结核分枝杆菌抗原体外刺激特异性T细胞免疫应答,对检测结核分枝杆菌具有较高的灵敏度和特异度[3]。白细胞介素-6(Interleukin-6,IL-6)是炎症反应的促发因子,在炎症-免疫应答过程中具有重要作用,也参与肿瘤细胞的增殖,促进肿瘤生长[4-5]。薄壁囊腔型肺癌和薄壁空洞性肺结核患者的电子计算机断层扫描(computed tomography,CT)征象、IGRA及IL-6均有一定的重叠,两者鉴别诊断较困难;在CT上因病灶较小使患者术前更难确诊,而病灶实性成分较少、囊壁厚度较薄也使得穿刺活检更加困难,且会增加气胸等风险,为肺癌的诊断增加难度。因此,本研究旨在探讨CT多征象联合IGRA及IL-6对于薄壁空洞型肺结核与肺癌的诊断与鉴别诊断价值,现报道如下。
1 资料与方法
1.1 一般资料回顾性分析2016年2月至2020年2月经病理或临床证实的41例薄壁囊腔型肺癌(肺癌组)和32例薄壁空洞性肺结核(结核组)的CT影像资料及临床资料。其中肺癌组男性22例,女性19例,年龄31-87岁,平均(56.8±6.5)岁。结核组男性18例,女性14例,年龄19-65岁,平均(40.1±6.5)岁。
纳入标准:肺癌组患者均经手术后病理证实,结核组经手术后病理证实或经痰涂片标准或临床诊断证实[血沉升高,结核杆菌T细胞斑点实验(T-SPOT.TB)阳性,诊断性治疗病灶缩小];除外病灶内部为空泡性病变(即含气腔隙长经>5mm)的患者;病灶内部具有空气密度影且为薄壁(壁厚<4mm)者;均经CT、IGRA及IL-6检测且CT图像质量符合诊断标准;临床资料完整且可靠。排除标准:CT或临床相关检查前已行手术治疗或放化疗者;合并有其他器官或系统疾病者;合并严重心脏病,肝肾功能障碍;患者配合不佳,依从性不佳者。
1.2 CT检查方法CT检查设备为Philips Ingenuity Core 128 CT进行扫描,检查前训练患者呼吸,避免呼吸运动伪影,在吸气后进行扫描。扫描范围包括肺尖至肺底,双侧包括腋窝及胸壁。扫描参数:层厚、层间距均为3mm,管电压120kv,管电流120mA,FOV:350mm×350mm,螺距1。增强对比剂采用碘海醇(300mgI/mL),经肘静脉注射,流率3mL/s,注射对比剂后25s、70s分别行动脉期和静脉期扫描。将扫描后图像传输至后处理工作站重建和测量,重建层厚0.625mm,重建间隔0.625mm。利用多平面重建(MPR)、最大密度投影(MIP)、容积重建(VR)等后处理技术对图像进行重建并观察。
1.3 影像分析按Mascalchi等[6]分类标准将含气腔隙与结节的形态学关系分为4型,结节或肿块位于腔外(Ⅰ型),结节或肿块位于腔内(Ⅱ型),含气腔隙呈环形增厚改变(Ⅲ型),多发含气腔隙与结节混合(Ⅳ型)。对单个囊腔或空洞,测量病灶壁最厚处;对多个囊腔或空洞,测量多个壁最厚处取平均值。综合分析病灶位置、病灶大小(最大径)、含气腔隙大小(最大径)、壁厚度、形态学分型、病灶整体形态(圆形/类圆形、不规则)、病灶边缘形态(分叶、短毛刺、长毛刺、尖角征、棘状突起)、病灶与肺界面(清晰光滑、清晰毛糙、模糊)、含气腔隙数量、含气腔隙内壁光整度及内部结构(血管穿行、内部分隔)、邻近结构(胸膜牵拉凹陷征、卫星灶)、磨玻璃征、蜂窝征等情况。上述均由2名具有丰富影像诊断经验的医师进行,意见不一致时讨论达成一致意见。
1.4 IGRA及IL-6水平检测患者入院后抽取肘静脉血7mL,加入肝素抗凝。按照结核分枝杆菌特异性细胞免疫反映检测试剂盒说明书对IGRA进行检测及结果判读。采用化学发光法检测血清IL-6水平。
1.5 统计学方法采用SPSS 22.0统计分析软件。计量资料采用()表示。计数资料以频数和百分率表示。利用t检验、χ2检验或Fisher精确概率法对比分析两组患者病变的CT征象、IGRA及IL-6。采取ROC曲线法及Logistic回归预测模型,探讨CT多征象、IGRA、IL-6及其联合应用对于肺癌病灶鉴别诊断的评估效能。P<0.05为差异有统计学意义。
2 结果
2.1 结核组和肺癌组临床资料及CT计量资料分析结核组与肺癌组在发生性别、病灶大小及含气腔隙大小上差别不大,无统计学意义(P>0.05),而在发病年龄、空洞壁厚较大差异,具有统计学意义(P<0.05)。见表1。
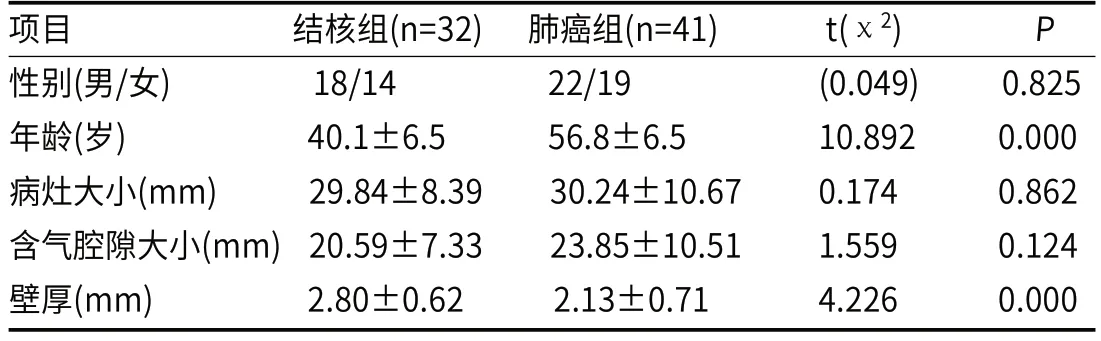
表1 结核组与肺癌组临床资料及CT计量资料对比
2.2 结核组和肺癌组CT征象分析结核组病灶的CT特点主要位于上叶尖后段及下叶背段,长毛刺、尖角征、单腔、腔内壁光整、卫星灶等发生率明显高于肺癌组,差异均有统计学意义(P<0.05)。肺癌组病灶的CT特点是病灶边缘分叶、短毛刺、多腔、腔内壁不光整、内部分隔及血管穿行、磨玻璃征、蜂窝征等的比例高于结核组,差异均有统计学意义(P<0.05)。其余结核组和肺癌组的CT征象均无统计学意义(P>0.05)。见表2,图1-2。

图1 薄壁囊腔型肺癌患者CT征象;男,59岁,薄壁囊腔型肺癌,检查发现肺部占位,肿瘤标志物正常,病灶位于右肺上叶后段,病灶大小为9.62mm×11.54mm,边缘模糊,可见短毛刺征,含气腔隙内壁不光整,囊壁厚薄不均,边缘见小壁结节,大小约3.10mm×3.61mm。图2 薄壁空洞性肺结核患者CT征象;男,62岁,薄壁空洞性肺结核,既往肺结核病史,病灶位于右肺下叶背段,大小为32.14mm×21.45mm,可见长毛刺,含气腔隙内壁光整,周围可见少许卫星灶,邻近胸膜牵拉凹陷,壁厚薄不均,最厚处为3.31mm。
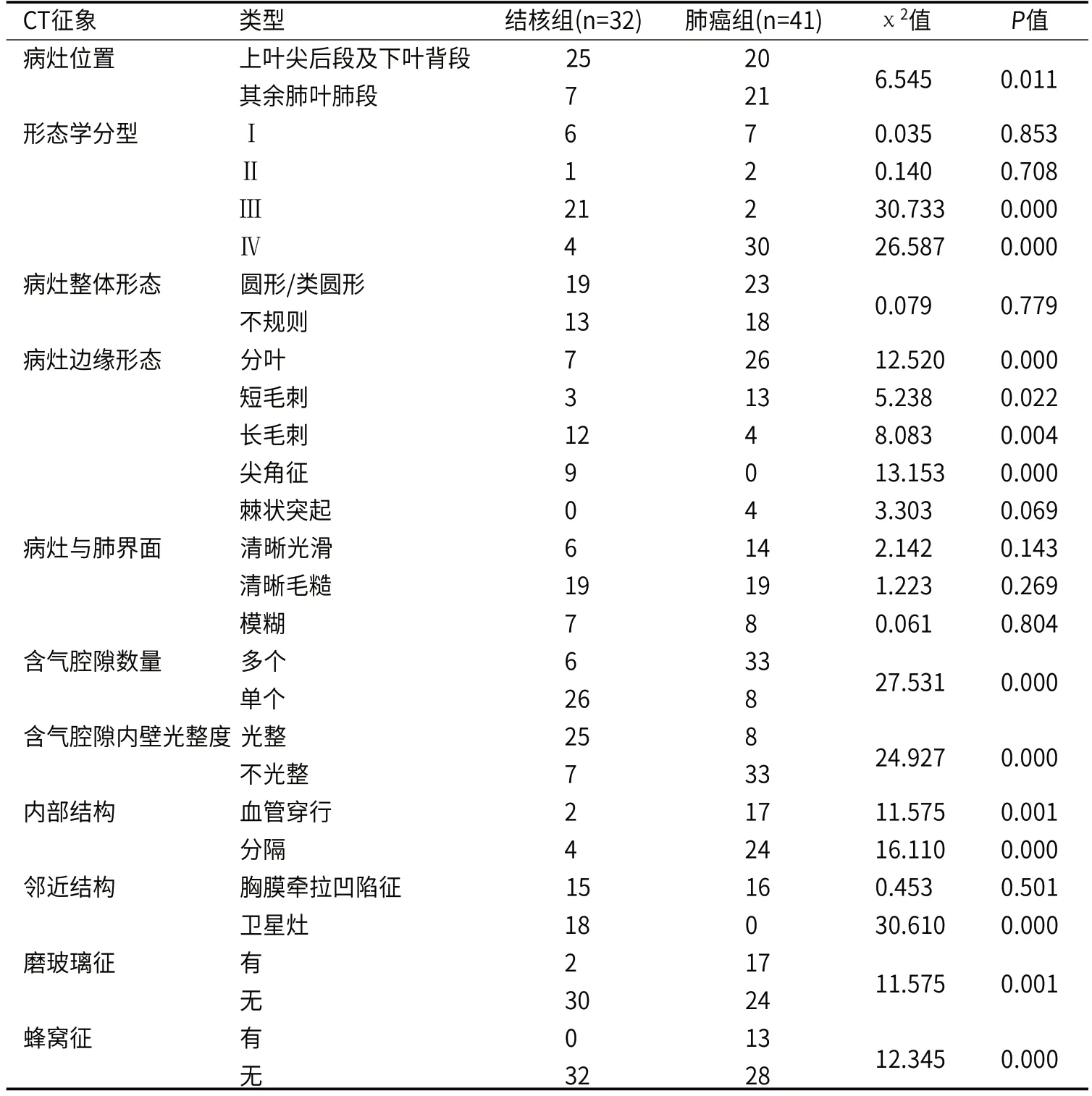
表2 结核组和肺癌组CT征象分析(n)
2.3 结核组和肺癌组IGRA阳性率及IL-6水平比较结核组IGRA阳性率、IL-6水平均高于肺癌组,差异均有统计学意义(P<0.05),见表3。
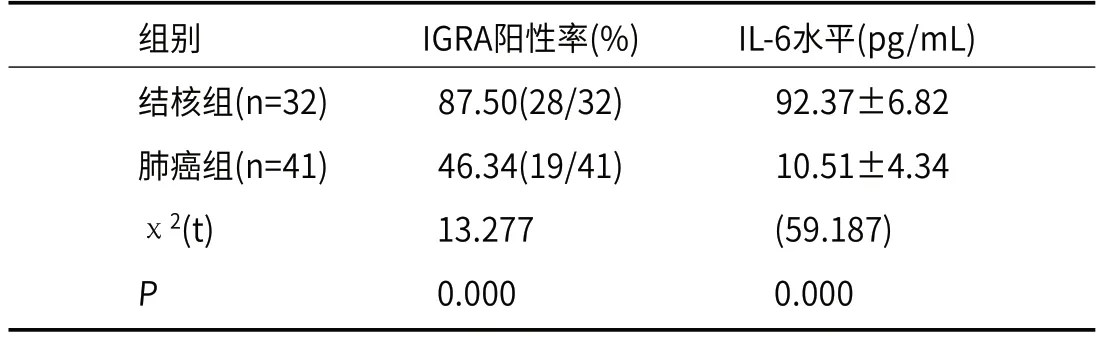
表3 结核组和肺癌组IGRA阳性率及IL-6水平比较
2.4 CT多征象结合IGRA及IL-6水平单独或联合对薄壁空洞型肺结核与肺癌的诊断与鉴别诊断价值进一步探讨CT多征象、IGRA及IL-6单独或联合对薄壁空洞型肺结核与肺癌的诊断与鉴别诊断价值:以肺癌组为阳性样本(n=41),以结核组为阴性样本(n=32),建立ROC预测诊断模型及联合应用回归预测模型。(1)CT多征象单独应用时,各征象指标中与肺癌有显著关联意义的分项指标约14个,根据各患者的征象,给出是否薄壁囊腔型肺癌的诊断;结果显示,其诊断灵敏度、特异度分别为1.000(41例肺癌均被诊断)、0.719(23例结核被排除肺癌)。(2)IGRA单独应用时,本研究全部阳性或阴性的诊断结果显示,其诊断灵敏度、特异度分别为0.610(25肺癌被诊断)、0.688(22结核被排除肺癌)。(3)IL-6单独应用时,其诊断灵敏度、特异度分别为为0.634(26例肺癌被诊断)、0.625(20例结核被排除肺癌)。(4)建立Logistic回归预测/诊断鉴别模型,应变量为患者的鉴别诊断情况(赋值1=肺癌,0=结核)。自变量分别为:CT多征象指标(归并为二分类,按临床确诊结果赋值:阳性/肺癌=1,阴性/结核=0),IGRA(二分类,1=阳性,0=阴性),IL-6指标以实值输入。经回归得:Log(P/1-P)(联合虚拟指标/概率)=-0.147 +1.446×CT多征象-0.612×IGRA-1.115×IL-6,以此作为联合应用的诊断参量,进行ROC分析。结果显示,联合诊断的灵敏度和特异度分别为1.000(41例肺癌均被诊断)、0.875(28例结核被排除肺癌)。见表4,表5,图3。
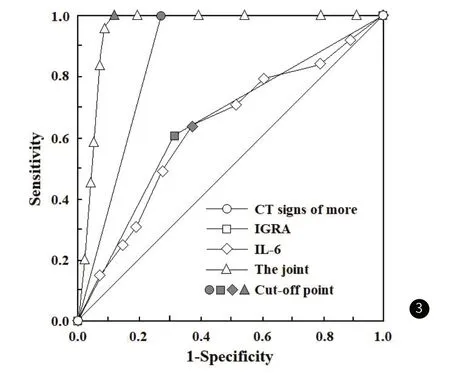
图3 CT多征象结合IGRA及IL-6水平对薄壁空洞性肺结核与肺癌鉴别诊断的ROC分析曲线

表4 CT多征象、IGRA及IL-6对薄壁空洞型肺结核与肺癌的鉴别诊断之回归模型
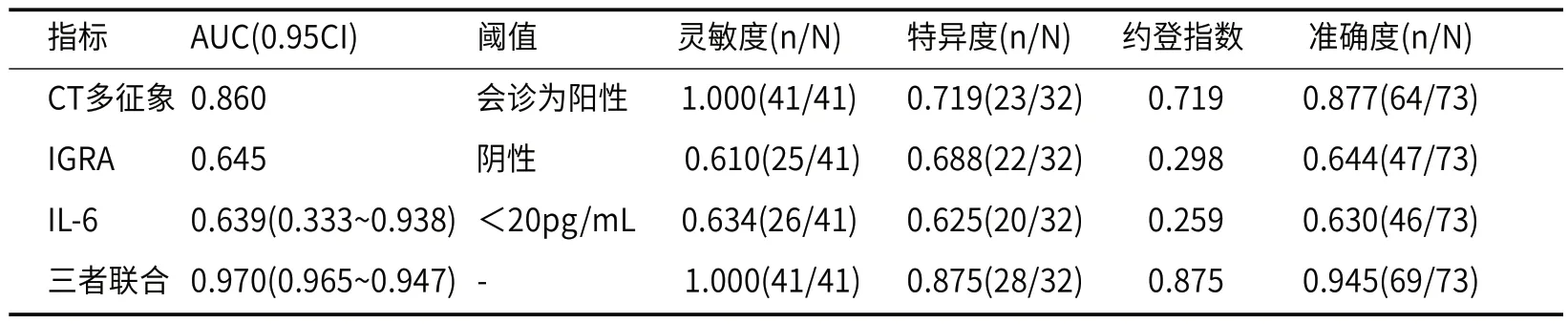
表5 CT多征象、IGRA及IL-6对薄壁空洞型肺结核与肺癌的鉴别诊断的ROC分析结果
3 讨论
薄壁空洞型肺结核与薄壁囊腔型肺癌在CT上均表现为含气透亮影,两者形成病理基础不同[7-8];肺癌的早期CT征象不典型,只有在薄壁囊腔型肺癌生长到一定阶段具有典型征象时在CT上才能确诊;肺结核病灶合并有卫星灶、年龄相对较小时诊断相对较容易。本研究中结核组与肺癌组性别比例差异无统计学意义(P>0.05),结核组平均年龄比肺癌组偏小(P<0.05),提示年龄对于二者的鉴别诊断有一定参考价值。
本研究显示,肺癌组的病灶边缘分叶、短毛刺、多个含气腔隙、含气腔隙内壁不光整、内部分隔及血管穿行、磨玻璃征、蜂窝征的比例均高于结核组,差异均有统计学意义(P<0.05),提示肺癌的CT征象与肿瘤的病理基础、生长方式有关。病灶边缘分叶改变为肺癌的典型征象,主要原因为肿瘤同时向各个方向生长,但因不同方向有外界阻挡、内部组织学生长不均等造成病灶呈分叶状改变[9-10]。毛刺征为病灶边缘向周围组织延伸,肺癌者瘤细胞沿血管支气管向周围浸润并同时有炎症和结缔组织增生,故为短毛刺征改变;结核性毛刺征多为周围炎性浸润所致,故为长毛刺改变。含气腔隙内壁不光整可能与肿瘤坏死组织、部分纤维组织或肿瘤组织构成,囊腔内脱落细胞有关[11]。内部分隔的出现为未完全被肿瘤细胞破坏的肺泡间隔组织或纤维血管组织[12]。而薄壁囊腔型肺癌的囊腔多以分隔为主,因此其形态学上以Ⅳ型为主。内部血管穿行主要与肿瘤组织内弹性纤维收缩使囊腔壁不完整,周围正常组织和血管局部经缺损处进入所致[13]。磨玻璃征出现在含气囊腔周围,主要原因为肺癌沿着肺泡壁生长致使肺泡腔闭塞,肺泡腔内气体残留成为空泡,因活瓣关系使气体逐渐增多成为含气囊腔,而结核性磨玻璃密度影多为病灶周围渗出所致[14-15]。在CT征象上,因多个含气腔隙、含气腔隙内壁不光整、内部分隔及血管穿行等使得薄壁囊腔型肺癌呈蜂窝状改变[16]。本研究中结核组病灶位于上叶尖后段及下叶背段、长毛刺、尖角征、单个含气腔隙、含气腔隙内壁光整、卫星灶的比例均高于肺癌组,差异均有统计学意义(P<0.05)。结核好发于上叶尖后段及下叶背段,因此薄壁空洞型肺结核亦好发于此部位,且病灶周围多可见卫星灶。结核性含气囊腔为病灶内坏死物质液化后排出所致,局部有变态反应,组织液化坏死较为彻底,因此病灶内基本无分隔,形态学分型以Ⅲ型较多见。含气腔隙内壁为干酪样坏死物质,坏死物质多较均匀,因此内壁光整,少数病灶干酪样坏死物质不均匀时则内壁不光整。因此,CT多征象分析可在一定程度上诊断与鉴别诊断薄壁空洞型肺结核与肺癌。即CT征象中的形态学分型、蜂窝征、磨玻璃征、分叶征、毛刺征、尖角征、含气腔隙数量、内壁光整度、卫星灶均可有助于诊断与鉴别诊断薄壁空洞型肺结核与薄壁囊腔型肺癌[17-18]。
IGRA在肺结核和肺癌患者均可有阳性表达,但一般在肺癌患者中其阳性表达率低于肺结核患者。武艳霞[19]的研究显示IGRA对诊断肺结核具有较高敏感性和特异性,但在肺癌的患者中其鉴别诊断价值不高。无论结核是否处于活动期,其淋巴细胞均为致敏状态,因此IGRA无法判断结核是否为活动期。黄毅等[20]研究发现IGRA对结核病诊断的敏感性很高,但是其特异性较低,且在肺癌的患者中IGRA检测阳性率也很高;分析其原因可能为肺癌患者免疫力低下更易合并结核感染,此外,机体在初次感染结核后产生的记忆性T淋巴细胞与适应性免疫应答有关,而肿瘤形成中机体会产生抗肿瘤免疫,其由T淋巴细胞介导[21]。肺癌患者血清IL-6水平低于肺结核组,可能与IL-6为典型的炎症因子有关,结核感染时其血清水平显著升高,但IL-6亦可促进肺癌患者肿瘤细胞增殖,促进肿瘤生长,因此肿瘤患者血清IL-6也会升高[22]。闫凌丽等[23]研究发现检测胸腔积液及血清中IL-6的水平可鉴别诊断肺癌和肺结核。许敏殷等人[24]的研究显示,IGRA及IL-6联合应用对活动性肺结核具有较高的辅助诊断价值,其联合诊断的敏感性、特异性均高于IGRA及IL-6单一应用。本研究中,结核组IGRA阳性率为87.50%,肺癌组IGRA阳性率为46.34%,两组IGRA阳性率比较差异有统计学意义(P<0.05);结核组IL-6水平均高于肺癌组,差异均有统计学意义(P<0.05);提示IGRA及IL-6在薄壁空洞型肺结核与薄壁囊腔型肺癌中均有表达,且结核组高于肺癌组,对于两者的鉴别诊断具有一定价值。为进一步提高其诊断效能,本研究采用CT多征象联合IGRA及IL-6进行研究,结果显示,CT多征象联合IGRA及IL-6对薄壁空洞型肺结核与薄壁囊腔型肺癌的诊断与鉴别诊断的准确度、灵敏度及特异度均优于单独应用CT多征象或IGRA或IL-6,提示CT多征象联合IGRA及IL-6三者联合应用可明显提高薄壁空洞型肺结核与肺癌的鉴别诊断,对于临床治疗前的决策可起到关键作用,可为患者的治疗提供可靠依据。
综上所述,薄壁空洞型肺结核和肺癌的CT征象具有一定特征,且IGRA及IL-6水平均有不同程度表达,但两者又有一定的差异,CT多征象联合IGRA及IL-6可显著提高薄壁空洞性肺结核和肺癌的诊断与鉴别诊断,有利于临床制定治疗方案。
