增强CT影像组学诺模图术前预测胃癌周围神经侵犯的应用价值
2023-12-06杨萌萌
杨萌萌 杨 玲
苏州大学附属第一医院放射科 (江苏 苏州 215000)
胃癌是一种常见的消化道恶性肿瘤,也是肿瘤相关死亡的主要原因之一[1]。影响胃癌预后及生存期的主要因素包括肿瘤TNM分期、切缘阳性、淋巴血管侵犯、周围神经侵犯(perineural invasion,PNI)等[2]。近年来,胃癌PNI与预后的相关性越来越得到专家学者的重视,PNI被认为是除了淋巴结转移、血行转移、腹膜转移之外的一种潜在转移方式[3]。PNI发生的机制与肿瘤细胞分泌的神经生长因子(nerve growth factor,NGF)有关,NGF能够刺激神经沿其浓度梯度延伸,使肿瘤细胞浸润神经,同时肿瘤内的神经数目增多,又可以分泌多种因子进一步促进肿瘤细胞的生长扩散[4]。
PNI与预后的相关性研究在胰腺癌、头颈部癌及结直肠癌中已经比较完善[5-6],大量文献报道,PNI是影响结直肠癌、胰腺癌患者预后的独立危险因素。有研究指出,PNI也与胃癌的预后和早期复发有关,PNI阴性患者的预后明显好于PNI阳性患者,且早期胃癌发生PNI者,预后更差[7]。因此,在术前预测胃癌PNI对于评估患者的预后、预测早期复发、制定个性化的诊疗方案具有重要价值。影像组学(radiomics)通过高通量提取医学图像特征,将医学图像转化为可挖掘的定量数据,进而实现客观、定量分析疾病的生物学特征[8-9]。影像组学在胃癌鉴别诊断、淋巴结转移、疗效预测等方面已经进行了广泛的研究[10-12],但是在周围神经侵犯方面的研究较少。本研究旨在探讨增强CT影像组学模型及诺模图(nomogram)在术前预测胃癌PNI的可行性和准确性,从而对高危复发患者进行分层,提高胃癌患者的术前管理水平。
1 资料和方法
1.1 一般资料收集本院2015年6月至2022年6月术后病理明确的311例胃癌患者。
纳入标准如下:接受胃癌根治性切除术,术后病理明确PNI状态;术前两周内接受腹部增强CT检查,图像清晰;在CT检查前和手术前均未接受过化疗、放疗等抗癌治疗;有详细临床病史和手术记录。排除标准如下:CT检查前或术前接受过抗癌治疗;CT检查时胃部扩张不良或图像质量差;病灶体积过小,无法准确勾画感兴趣区;病理或临床资料缺失。将样本按7:3的比例随机分配为训练组和测试组,训练组217例,测试组94例。
由两位病理科医师对组织切片进行反复检查分析,记录周围神经侵犯状态、肿瘤位置、浸润深度、大体分型、组织分型及分级、淋巴脉管浸润、淋巴结转移等。通过查阅电子病历记录患者的年龄、性别以及实验室检查指标CA199、CA72-4、和CEA。
1.2 CT图像采集与分析患者在CT检查前禁食6小时以上达到空腹状态以排除食物残渣对粘膜病变显示的干扰,并口服阴性充盈剂(温水或甘露醇溶液)扩张胃腔。CT扫描范围包括自膈顶至盆底的整个腹盆腔。通过肘前静脉注射非离子造影剂碘普罗胺(1.5mL/kg,3mL/s)。扫描设备包括飞利浦Briliance 256层螺旋CT和德国西门子Somaton Sensation 64排CT。扫描参数如下:管电压=120KV,自动管电流,准直厚度=1.25mm,图像矩阵=512×512,层厚=5.00mm,重建层厚=1.00mm。CT图像由两位放射科医师在未告知病理的情况下评估T分期及淋巴结转移风险。胃癌临床分期参照美国癌症联合委员会(American Joint Committee on Cancer,AJCC)第八版指南[13]建议的CT征象。
1.3 影像组学分析
1.3.1 肿瘤病灶分割 将动脉期和静脉期CT图像上传至ITK-SNAP软件,由一位具有5年工作经验的放射科医生在横断面图像上逐层手动分割出肿瘤的感兴趣区(region of interest,ROI),由软件自动生成三维感兴趣体积(volume of interest,VOI)(图1AD)。在样本中随机选取50例患者,由另一位有10年经验的放射科医生逐层手动勾画病灶ROI,以评价影像组学特征的组间一致性。间隔一个月后,由5年经验的放射科医生再次勾画随机选取的50例患者的ROI,以评估影像组学特征的组内一致性。保留组内和组间一致性系数(intraclass and interclass correlation coefficients,ICCs)≥0.8的特征进行下一步分析。
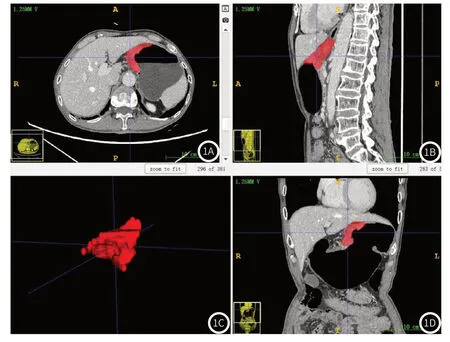
图1A-图1D ITK-SNAP病灶ROI勾画示例图。
1.3.2 特征提取与筛选 在FeAture Explorer Pro(FAE,V 0.5.2)软件中提取影像组学特征并进行量化,利用Z-score方法将提取的特征转化为均值为0,标准差为1的特征值。采用主成分分析法(principal component analysis,PCA)和方差分析(analysis of variance,ANOVA)筛选出与PNI显著相关的12个特征。
1.3.3 建立预测模型及诺模图 通过逻辑回归(logistic regression,LR)和支持向量机(support vector machine,SVM)构建影像组学模型,并输出相应的影像组学评分(rad-score)。采用10次5折交叉验证来训练预测模型的稳定性。对患者年龄、性别、肿瘤部位等临床特征进行单因素和多因素logistic回归分析,筛选出PNI的独立危险因素并构建临床预测模型。将有统计学差异(P<0.05)的临床特征纳入影像组学模型进一步构建联合模型。采用受试者工作特性(receiver operating characteristic,ROC)曲线评价各预测模型的诊断性能,计算曲线下面积(area under curve,AUC)、敏感性、特异性和准确度。选择预测性能最佳的影像组学标签和临床特征进行多因素logistic回归分析,运用R软件包(3.5.2版:http://www.Rproject.org)绘制临床-影像组学诺模图。
1.4 统计分析本研究使用SPSS软件(25.0)和R软件包(3.5.2)进行统计学分析。两组间定性数据比较采用卡方检验或Fisher精确值。使用ROC曲线评价各预测模型的效能。对训练组和测试组的ROC曲线进行Delong检验以判断是否存在过拟合。采用Hosmer-Lemeshow检验评估诺模图的拟合度。利用决策曲线分析(decision curve analysis,DCA)比较不同模型的净收益。所有统计均为双侧检验,P<0.05提示差异有统计学意义。
2 结果
2.1 临床病理资料在训练组中,PNI阳性与阴性患者的肿瘤部位、分化程度、临床T分期、CT评估淋巴结转移、淋巴脉管侵犯存在统计学差异(P<0.05),而测试组中,PNI阳性与阴性患者只有肿瘤部位、淋巴脉管侵犯存在统计学差异,余临床特征均未见统计学差异(表1)。肿瘤部位、CT分期、CT评估淋巴结转移以及淋巴脉管侵犯是胃癌PNI的独立危险因素(表2)。
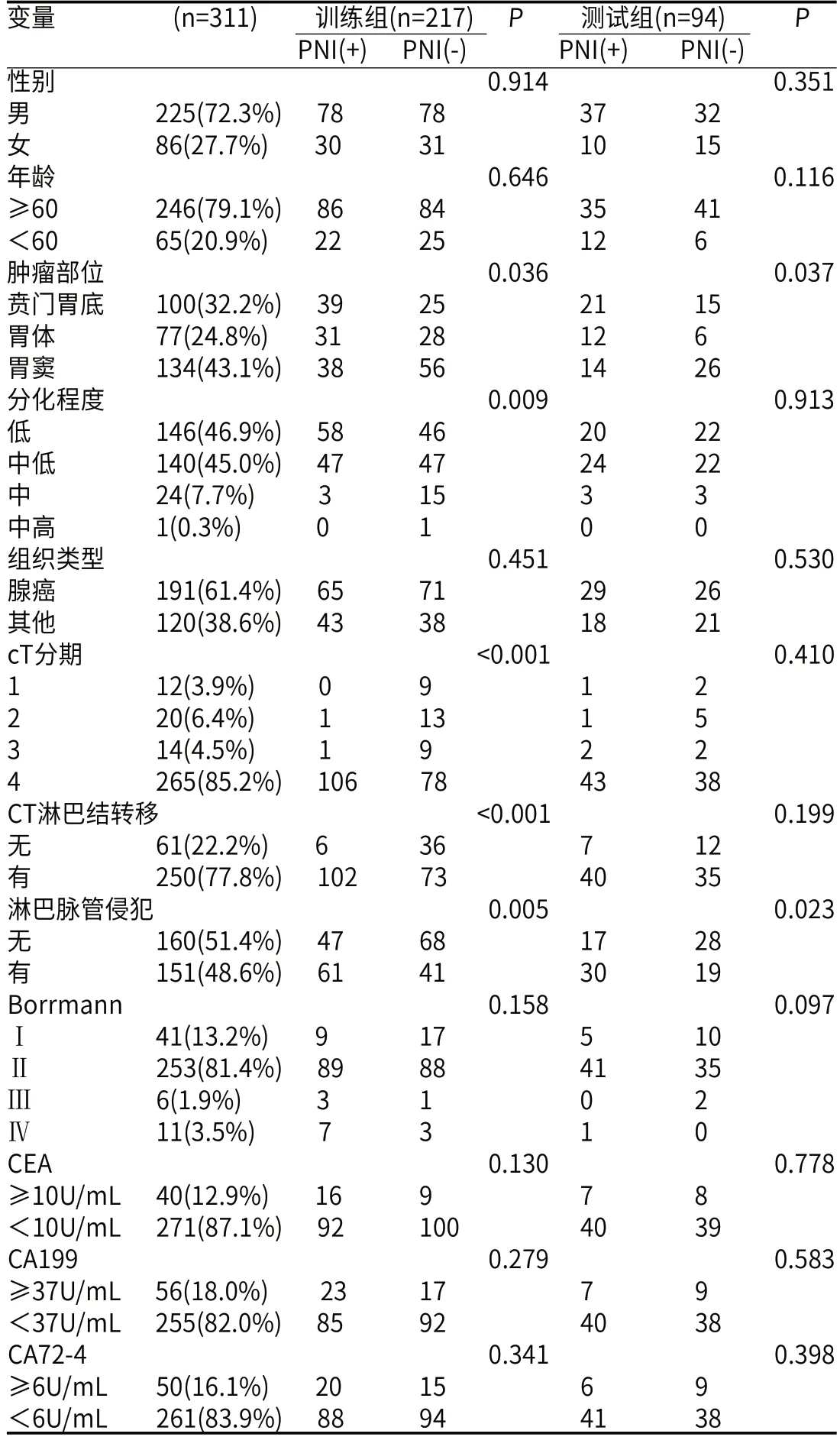
表1 训练组与测试组患者临床病理资料比较
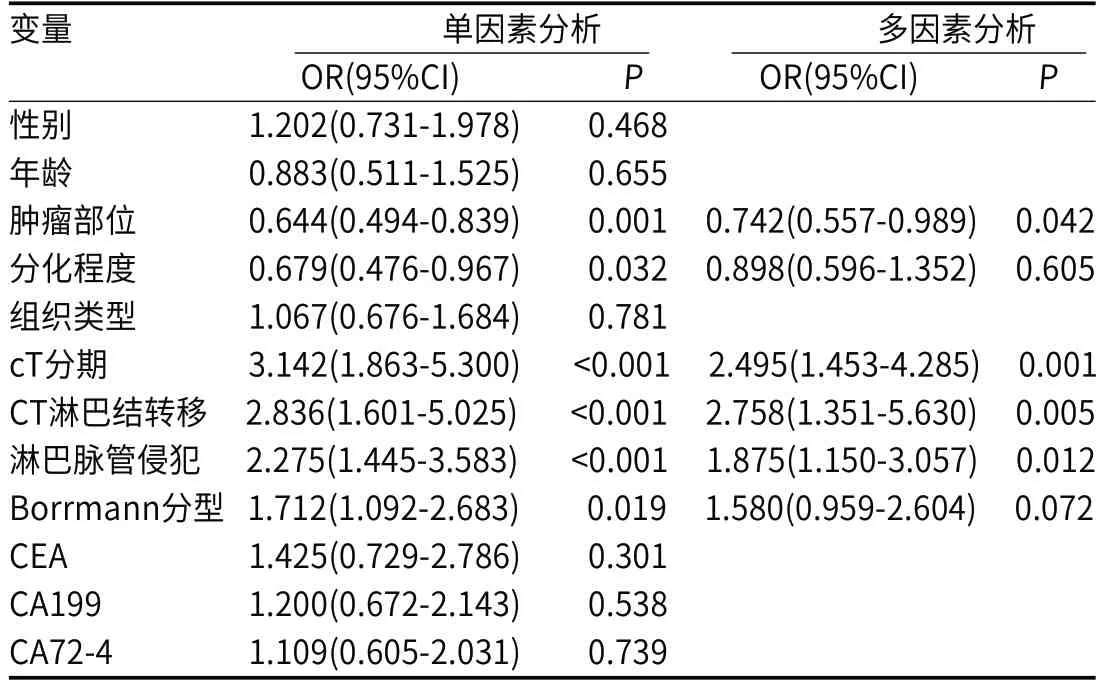
表2 临床特征单因素与多因素分析结果
2.2 影像组学特征从动脉期和静脉期图像中分别提取出1780个影像组学特征,组内及组间一致性分析保留了375个ICCs≥0.8的特征,通过PCA和ANOVA从动脉期和静脉期分别筛选出12个与PNI显著相关的最优特征(表3)。

表3 动脉期及静脉期最佳特征及其特征系数
2.3 影像组学模型及诺模图性能基于肿瘤部位、临床T分期以及CT评估淋巴结状态构建的临床模型在训练组和测试组的AUC为0.712(95%CI:0.643-0.781)、0.655(95%CI:0.544-0.766)。静脉期SVM影像组学模型效能较高,在训练组和测试组的AUC为0.809(95%CI:0.753-0.865)、0.755(95%CI:0.656-0.854)。联合模型预测PNI的效能高于单纯影像组学模型,SVM联合模型在训练组和测试组的AUC为0.881(95%CI:0.836-0.926)、0.815(95%CI:0.729-0.902),敏感性为0.807、0.798,特异性为0.817、0.830,准确度为0.812、0.794。训练组与测试组模型性能见表4、表5。ROC曲线见图2、图3。
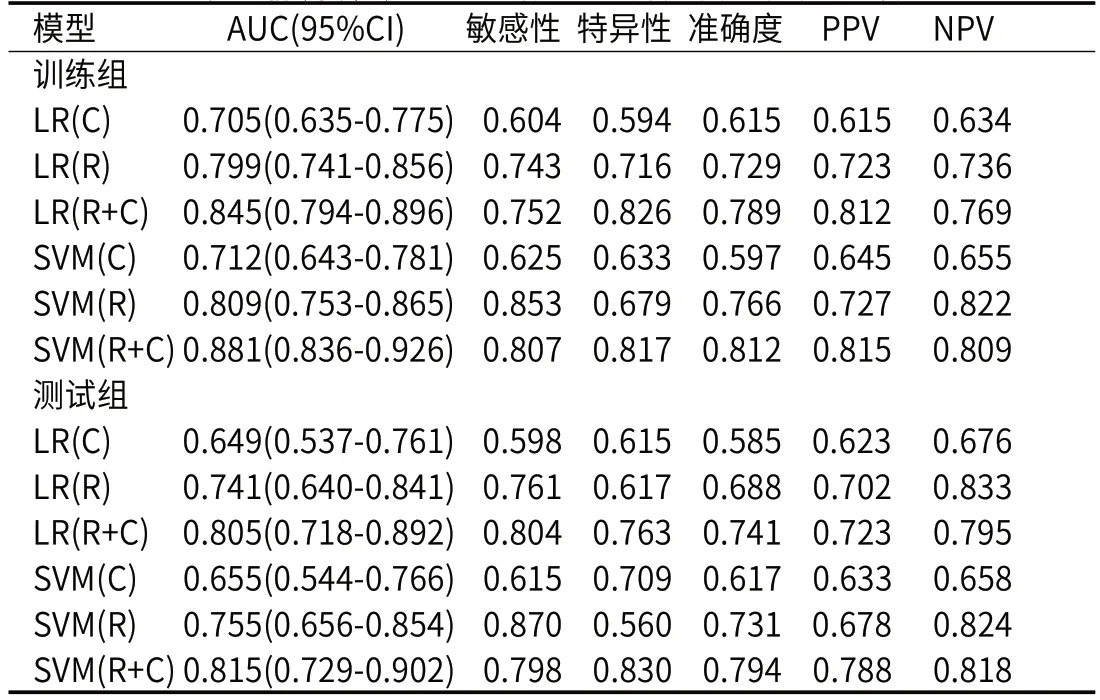
表4 静脉期训练组和测试组预测模型性能比较
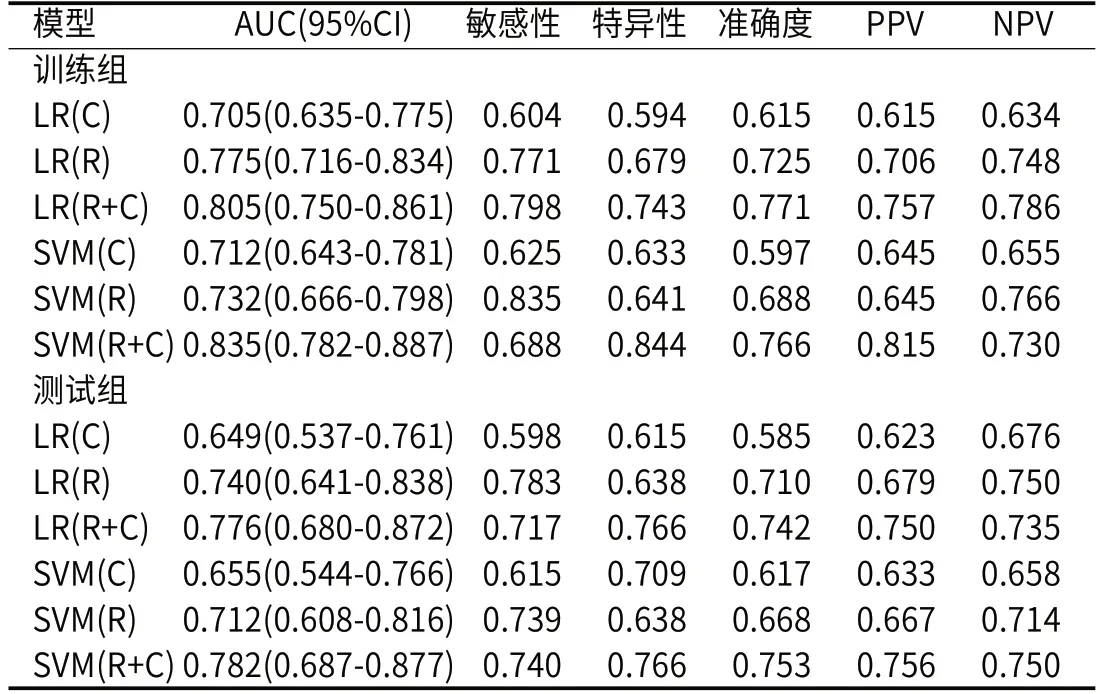
表5 动脉期训练组和测试组预测模型性能比较
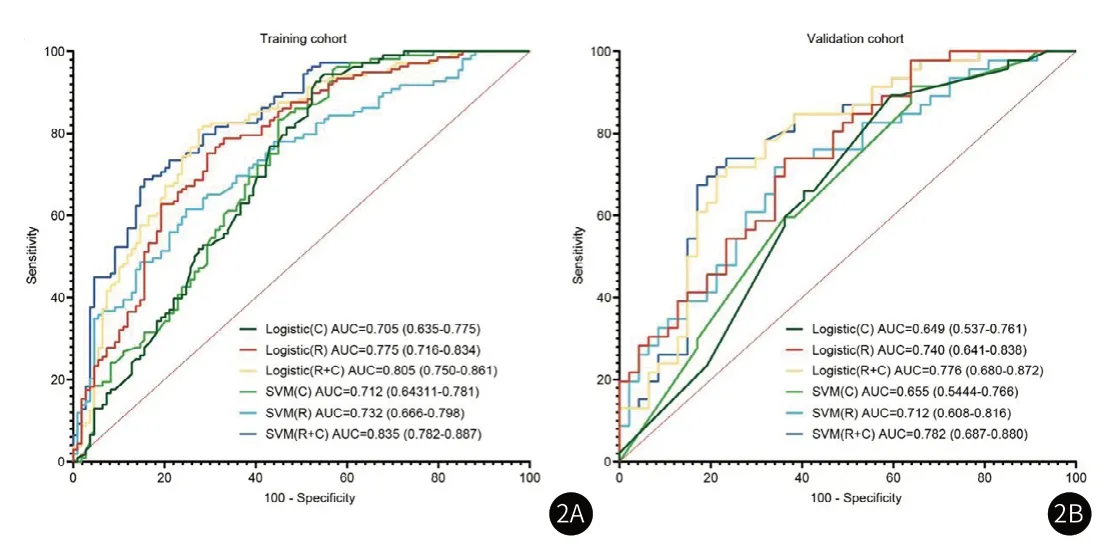

图2A-图2B 动脉期预测模型训练组和测试组ROC曲线。图4 临床-影像组学诺模图。图3A-图3B 静脉期预测模型训练组和测试组ROC曲线。图5 诺模图、影像组学模型、临床模型术前预测 PNI的DCA曲线,横坐标为阈值概率,纵坐标为净效益。
对训练组和测试组模型的ROC曲线两两之间进行了Delong检验,LR分类器和SVM分类器构建的同类模型ROC曲线未见统计学差异(P>0.05)。临床模型与影像组学模型比较、临床模型与联合模型比较,其差异有统计学意义(P=0.035,P=0.018),而影像组学模型和联合模型比较,未见统计学差异(P=0.425)。
将静脉期Radscore和临床特征进行多因素Logistic回归分析,结果显示,Radscore、cT分期和CT评估淋巴结转移是PNI的独立危险因素,据此建立用于个体化预测PNI风险的诺模图(图4)。Hosmer-Lemeshow拟合优度检验显示诺模图拟合程度良好(P=0.522)。
通过DCA曲线(图5)评估不同预测模型的净收益率,结果显示,在一定的阈值范围内,诺模图比影像组学模型和临床模型具有更高的净收益,在指导胃癌PNI患者制定治疗策略时的临床应用价值更高。
3 讨论
胃癌的预后与TNM分期、生物学行为、分化程度、组织类型及治疗措施有关,其中PNI是胃癌复发和预后不良的生物标志物之一[14]。据相关文献报道,胃癌PNI发生率为6.8%-75.6%,本研究纳入的311例胃癌的PNI发生率为49.8%,与以往研究相符[15]。美国国家综合癌症网络(NCCN)相关指南明确指出,PNI是导致胃癌术后复发的高危因素,建议将其作为术后辅助治疗的指征之一[16]。日本胃癌治疗指南建议将PNI、淋巴血管侵犯等复发高风险因素作为新辅助化疗的适应症[17]。因此,利用生物标志物识别具有高复发风险的胃癌对于患者分层和改善治疗决策至关重要。有学者建议将PNI纳入到胃癌的TNM分期中[18],或将进一步提高患者分层的精确性,有助于制定个性化治疗方案,使患者得到最大程度的生存获益。
胃癌PNI与T分期和淋巴结转移显著相关,肿瘤浸润程度越深,侵袭力越强,发生PNI的风险越高[19]。这可能是因为随着胃癌浸润程度越深、范围越广,就越有可能接触到腹腔神经丛,从而增加发生PNI的风险。本研究多因素分析显示临床T分期和CT评估淋巴结转移是胃癌PNI的独立危险因素,与既往研究一致。Hwang等研究发现,胃癌PNI与淋巴血管侵犯密切相关[20],淋巴脉管侵犯常常与PNI同时发生,反映了肿瘤向外侵袭生长的趋势,与本研究的结果一致。另外,本研究结果显示PNI与肿瘤部位也具有相关性,这可能与胃神经分布有关。胃由交感神经和迷走神经共同支配[21],胃食管交接处及胃体小弯处的神经分布密度较高,因而位于贲门、胃体部的肿瘤发生神经侵犯的风险也更高。
常规的影像学方法CT或MRI难以识别出PNI、血管侵犯等微小的侵袭性特征。既往有学者利用临床特征和增强CT图像特征对胃癌PNI进行术前预测,刘书豪等[22]分析550例进展期胃癌患者的临床资料和增强CT图像中的肿瘤分期、淋巴结转移等数据,构建了预测进展期胃癌PNI的临床列线图模型,内部验证和外部验证的AUC分别为0.935和0.828。该临床模型优于本研究纳入肿瘤部位、临床T分期和CT评估淋巴结转移而构建的临床模型,后者在训练组和测试组中的AUC分别为0.712和0.655。这可能与本研究的临床模型纳入PNI的独立预测因子较少有关。刘祥[23]等通过测量增强CT图像上肿瘤CT值和脾脏静脉期CT值,计算出增强各期相平均值与平扫CT值的差、静脉期肿瘤与脾脏CT值的差以及对比增强比,对以上参数进行分析并筛选出与PNI有关的参数构建ROC曲线,其AUC值最大可达0.772。
影像组学将二维图像转换成可分析的定量数据,并利用人工智能或机器学习算法,将大量高维度的数据转换成鉴别诊断或预测预后的影像组学模型,在疾病诊断和医学研究中的优势愈发明显[24]。Aytül等[25]使用Mazda软件在肿瘤最大横断面图像勾画ROI并提取纹理特征,利用机器学习算法构建模型预测胃腺癌的PNI发生风险,平均 AUC为0.482-0.754。Zheng[26]等通过提取胃癌门静脉期影像组学特征,构建影像组学模型和影像组学-临床联合模型用于术前预测胃癌PNI,其测试集中的最佳 AUC 为0.82(95%CI:0.69-0.94)。本研究使用基于3D的分割方法分别勾画了增强CT动脉期和静脉期的肿瘤原发灶ROI,利用影像组学技术提取大量原发病灶的影像组学特征,并结合临床指标分别构建临床模型、影像组学模型及联合模型,用于术前预测胃癌PNI。
结果表明,影像组学模型的预测效能明显优于临床模型,而结合了影像组学特征和临床指标的联合模型在术前预测PNI的效果最好,训练组和测试组的AUC分别达到了0.881(95%CI:0.836-0.926) 和 0.815(95%CI:0.729-0.902)。静脉期的影像组学模型和联合模型的预测性能均高于动脉期模型,这可能是因为动脉期往往反映大血管的强化情况,而静脉期更侧重反映组织或肿瘤微血管的强化情况,且大多数胃癌在静脉期强化更明显。另外,本研究将联合模型转化为可视化诺模图,通过计算得分可获得胃癌发生PNI的风险概率,对于临床应用更为简便直观。
本研究存在一些局限性:(1)本研究是一项单中心、回顾性研究,收集的样本量有限,进一步扩大样本量以及外部验证是非常必要的;(2)尽管在提取影像组学特征之前对图像进行了标准化预处理,但仍然不能排除不同仪器、采集参数产生的影响;(3)本研究只回顾性分析PNI阳性和阴性患者的临床病理资料,并未对这些患者的术后生存或复发情况进行随访,因此未能显示PNI与预后或复发的相关性。
综上所述,增强CT影像组学模型和诺模图对术前预测胃癌PNI具有重要的应用价值,该结果有助于进一步细化胃癌患者危险分层,为制定个体化治疗方案、预测复发风险提供重要参考。
