超高压耦合热处理过程对鳙鱼鱼糜凝胶特性及水分迁移的影响
2023-12-03邹怡茜陈海强潘卓官周爱梅
邹怡茜,陈海强,2,潘卓官,周爱梅,
(1.华南农业大学食品学院,广东广州 510642;2.阳江职业技术学院,广东阳江 529500)
鳙鱼也称大头鱼,是我国主要的淡水鱼之一,其头部重量约占体重的三分之一,富含不饱和脂肪酸,氨基酸组成均衡合理,是一种低脂肪、高蛋白质的优质食物[1]。然而,消费者习惯食用肉质鲜美、口感好的鱼肉,偏爱吃鲜美的鳙鱼头,不爱购买土腥味较重、口感差的鳙鱼鱼身,造成鳙鱼鱼身低值化[2]。将鳙鱼鱼肉加工制成鱼糜及鱼糜制品是利用低值化鳙鱼鱼身资源的有效途径[3]。近年来,随着鱼糜制品需求量的上升以及海水鱼鱼糜产量的下降,将产量较大的淡水鱼鳙鱼制成鱼糜制品是鳙鱼深加工的重要途径,可为淡水鱼高值化利用提供借鉴。
凝胶化是鱼糜制品生产和品质控制的关键工艺,只有经过充分凝胶化的鱼糜制品才有较好的弹性和良好的口感。蛋白质凝胶化是蛋白质变性和聚集形成网络结构的过程,不同方法诱导鱼糜蛋白形成凝胶网络的机制可能不同[4]。鱼糜凝胶化的传统方法常采用二段热处理方法,但是,采用传统二段热处理加工鱼糜,因热量由外向内传递,存在加热速度慢、物料温度梯度大、加热时间长的问题,易引起凝胶劣化。因此,近年来国内外学者在鱼糜加工的研究上,开始广泛采用超高压、微波、欧姆加热等新型技术来替代传统热处理[5]。超高压是非热加工技术,可改善鱼糜中生物大分子的结构及分子间和分子内的相互作用,增强鱼糜凝胶形成能力[6-7],但在鱼糜凝胶特性的改善方面,普遍需要较高压力处理,才能获得凝胶特性显著优于二段热处理的鱼糜凝胶,这不利于超高压技术在鱼糜制品上的推广应用。本课题组前期研究发现,超高压耦合热处理能改善鱼糜凝胶蛋白分子间的交联,显著改善鱼糜凝胶特性[8],可降低压力和保压时间的需求,然而超高压耦合热处理过程中鱼糜凝胶特性的改善机制尚不清楚,还需进一步探讨。此外,水分是鱼糜中含量最高的成分,水分的存在状态和含量随着鱼糜凝胶加工过程的变化而改变,并对凝胶性能的改善起着重要的作用[9]。目前,超高压耦合传统二段热处理不同过程的淡水鱼鱼糜凝胶特性变化机制的报道鲜见,因此探讨超高压耦合热处理过程中淡水鱼鱼糜凝胶特性、凝胶蛋白理化特性及水分迁移的变化规律,有助于更全面阐明鱼糜凝胶特性改善机制。
本研究旨在探讨超高压耦合热处理过程对鳙鱼鱼糜凝胶的凝胶强度、持水性、质构和白度的影响,并通过分析鳙鱼鱼糜凝胶的十二烷基硫酸钠—聚丙烯酰胺凝胶电泳(SDS-PAGE)图谱、分子间作用力、活性巯基、表面疏水性、水分迁移和微观结构,深入了解超高压耦合热加工对鱼糜凝胶特性的作用机制,为超高压耦合热处理在鱼糜制品开发中的应用提供理论参考,也为鳙鱼的鱼糜加工提供理论依据。
1 材料与方法
1.1 材料与仪器
新鲜鳙鱼 购于广州市长湴菜市场;食盐、蔗糖和山梨糖醇 市售食品级;无水乙醇 国药集团化学试剂有限公司;β-巯基乙醇 上海麦克林生化科技有限公司;戊二醛 天津欧博凯化工有限公司;脲广东光华科技股份有限公司;DTNB 上海麦克林生化科技有限公司;十二烷基硫酸钠 福晨(天津)化学试剂有限公司;Tris 上海源叶生物科技有限公司;试剂 均为市售分析纯。
UHPF-600 MPa 超高压设备 中国包头科发高压科技有限责任公司;DS-1 高速组织捣拌机 上海标本模型厂;DM-JRJJ 灌肠器 中国德明旗舰店;CT3 质构仪 美国博勒飞公司;CR-10 色差仪 日本日立公司;Avanti J-E 落地式离心机 美国贝克曼库尔特有限公司;Vertex 70 傅立叶变换红外光谱仪德国布鲁克公司;EVO MA15 扫描电子显微镜德国卡尔蔡司公司;MesoMR23-040V-I 低场核磁共振仪 苏州纽迈分析仪器有限公司;FJ200-SH 数显高速分散均质机 上海标本模型厂。
1.2 实验方法
1.2.1 样品的制备 鱼糜的制备:新鲜鳙鱼经去鳞、去头、去内脏、清洗、采肉、绞肉、漂洗(用5 倍冰水漂洗2 次/10 min,0.15% NaCl 漂洗1 次/10 min)、脱水后加抗冻剂(4%蔗糖、4%山梨糖醇)制成鱼糜。
鱼糜凝胶的制备:参照周爱梅等[10]的方法并略修改。使用高速组织捣拌机将适当切碎的鳙鱼鱼糜斩拌1 min,然后添加质量分数2.5%(w/w)的食盐,加冰将鱼糜水分含量调节至79%左右后再斩拌4 min,进而将鱼糜填充至直径30 mm 的肠衣中,制成15 cm 左右的鱼肠。鱼肠经以下不同处理,其中包括不经任何处理的样品(记为0.1P,对照组),样品分别经单独压力处理(300 MPa/5 min,记为300P)、压力处理后一段热处理(300 MPa/5 min+40 ℃/30 min,记为300PS)以及压力处理后二段热处理(300 MPa/5 min+40 ℃/30 min+90 ℃/20 min,记为300PSH)。热处理后的所有样品迅速放入冰中,冷却后置于4 ℃冰箱冷藏12 h,进行分析测定。
1.2.2 凝胶强度的测定 鱼糜凝胶平衡至室温后切成高25 mm 的圆柱体,使用CT3 质构仪进行测定[11]。选用直径为5 mm 的P/5 探头,测定参数:目标值15 mm,测试速度1.0 mm/s,触发力4.0 g,循环次数1 次。测定鱼糜凝胶的破断力(g)、凹陷深度(mm),二者乘积为凝胶强度(g·cm)。
1.2.3 持水性的测定 参考Pan 等[12]的方法稍作修改。把鱼糜凝胶样品切成小块(0.5 cm×0.5 cm×2 cm),使用滤纸包裹两层后置于50 mL 离心管内,10000×g下4 ℃离心10 min,持水性计算公式为:
式中,CG 为鱼糜凝胶离心前的重量,g;CG′为鱼糜凝胶离心后的重量,g。
1.2.4 白度的测定 采用色差仪CR-10 对切成厚3 mm 的鱼糜凝胶圆片进行测定,记录L*值(亮度)、a*值(红度)、b*值(黄度)[13],白度计算公式为:
1.2.5 质构的测定 参考Maqsood 等[14]的方法略作修改。样品于室温下平衡2 h 后,切成高20 mm圆柱体,采用CT3 质构仪测定鱼糜凝胶样品的质构特性,选用TA/5 圆柱探头,预测试速度2 mm/s,测试速度1.5 mm/s,探头上升速度为1.5 mm/s,形变量为50%,触发力为25 g,循环次数为2 次。
1.2.6 SDS-PAGE 分析 参考Chen 等[8]的方法测定鱼糜凝胶的SDS-PAGE。称取3 g 切碎后的鱼糜凝胶样品于27 mL 5%十二烷基硫酸钠溶液,混合后12000 r/min 均质2 min,在85 ℃水浴抽提1 h 使蛋白充分溶出,冷却后5000×g/4 ℃离心20 min,取上清液。利用SDS-PAGE 测定蛋白质分子片段的变化。
1.2.7 傅里叶红外(FT-IR)分析 将冷冻干燥的鱼糜凝胶与溴化钾按质量比1:50 研磨均匀,采用傅里叶变换红外光谱仪在400~4000 cm-1范围内以4 cm-1分辨率进行扫描[15]。利用蛋白质的酰胺I 区(1600~1700 cm-1)定量分析β-折叠、α-螺旋、无规卷曲和β-转角的含量。
1.2.8 分子间作用力的测定 参考Gómez-Guillén等[16]的方法。准确称取2 g 剪碎后的鱼糜凝胶样品,分别添加10 mL SA(0.05 mol/L NaCl)溶液、SB(0.6 mol/L NaCl)溶液、SC(0.6 mol/L NaCl+1.5 mol/L 尿素)溶液、SD(0.6 mol/L NaCl+8 mol/L尿素)溶液和SE(0.6 mol/L NaCl+8 mol/L 尿素+1.5 mol/Lβ-巯基乙醇)溶液,在10000 r/min 下均质2 min,4 ℃条件下振荡1 h,将混合物于20000 r/min冷冻离心10 min,采用考马斯亮蓝法测定上清液中蛋白质的浓度。分子间作用力以组间上清液蛋白质浓度差表示,SB 与SA 之差表示离子键;SC 与SB之差表示氢键;SD 与SC 之差表示疏水相互作用;SE与SD 之差表示二硫键。
1.2.9 活性巯基和表面疏水性的测定 取3 g 鱼糜凝胶样品与磷酸盐缓冲液(27 mL,100 mmol/L,pH7.6)的混合物在12000 r/min 下均质2 min,然后在10000×g 下冷冻离心15 min。收集上清液测定鱼糜凝胶的活性巯基(R-SH)和表面疏水性,具体参考Chen 等[11]的方法。
1.2.10 水分迁移的分析 将鱼糜凝胶样品切成直径2.0 cm、高3.0 cm 的圆柱体,用保鲜膜包住后放入核磁管中,采用磁场强度为0.5 T 的低场核磁共振(LF-NMR)分析仪测定鱼糜凝胶的水分迁移率和分布,具体参考Wang 等[17]的方法进行测量分析。
1.2.11 微观结构的观察 参考Chen 等[8]的方法稍作修改。将鱼糜凝胶切成4 mm×4 mm×2 mm 的薄片,在室温下用2.5%(v/v)戊二醛固定12 h 后,在0.1 mol/L 磷酸盐缓冲液(pH7.0)中浸泡10 min,依次用浓度为30%、50%、70%、80%、90%和100%的乙醇溶液对样品进行梯度脱水10 min,冷冻干燥后的样品进行喷金处理,在扫描电镜(SEM)下观察(放大倍数10000 倍)。
1.3 数据处理
使用SPSS 19.0 软件和Origin-pro 9.1 软件对结果进行处理及制图,用Omnic 和Peak Fit 软件计算蛋白质二级结构的含量,利用TB tools 软件进行聚类热图分析。差异显著性为P<0.05。
2 结果与讨论
2.1 不同处理过程对鳙鱼鱼糜凝胶破断力、凹陷深度、凝胶强度的影响
凝胶强度是评价鱼糜制品质量的重要参数,由破断力与破断距离乘积得到。由图1(A)和图1(B)可知,随着超高压耦合热处理过程的进行,鳙鱼鱼糜凝胶的凝胶强度和破断力显著提升(P<0.05),而凹陷深度则呈下降的趋势。相对于0.1P 样品,300P 样品的凝胶强度显著增加(P<0.05),凝胶强度由72.86 g·cm增加到224.18 g·cm;相对于300P 样品,300PS 样品的凝胶强度也呈现显著增加(P<0.05)的趋势,凝胶强度由224.18 g·cm 到367.61 g·cm。300PSH 样品的凝胶强度最大,为420.95 g·cm,相对于0.1P 样品增加了477.75%。不同处理过程对鳙鱼鱼糜的凝胶强度的改善都有贡献,并且以超高压耦合热处理阶段对鱼糜凝胶强度的改善效果最好。鱼糜凝胶强度的变化与凝胶网络微观结构等因素的变化密切相关。Liang 等[6]研究表明,超高压可以显著提高鳙鱼鱼糜的凝胶强度,凝胶强度高的鱼糜凝胶的网络结构细密有序,而凝胶强度低的鱼糜凝胶的网络结构松散且空隙大。压力处理可增强鱼糜后续的热凝胶化,这与Tan 等[18]的研究结果一致,300PSH 凝胶强度的增加可能是热处理诱导凝胶蛋白展开,产生了新的蛋白质相互作用力。

图1 超高压耦合热处理过程对鳙鱼鱼糜凝胶破断力、凹陷深度(A)、凝胶强度(B)、持水性(C)和白度(D)的影响Fig.1 Effects of ultra-high pressure coupled heat treatment on the breaking force,deformation (A),gel strength (B),water holding capacity (C) and whiteness (D) of bighead carp surimi gel
2.2 不同处理过程对鳙鱼鱼糜凝胶持水性的影响
持水性是蛋白质凝胶网络结构内截留水分的定量指标,可以反映蛋白质凝胶网络的空间结构[19]。超高压耦合热处理不同过程对鳙鱼鱼糜凝胶持水性的影响如图1(C)所示,超高压及超高压耦合热处理能显著提高鳙鱼鱼糜凝胶的持水性(P<0.05),300P、300PS、300PSH 鱼糜凝胶样品的持水性分别较0.1P样品显著提高13.34%、17.50%、9.00%(P<0.05)。在不同处理过程中,300PS 处理阶段样品的持水性最好,这与前人[11,20]的研究结果类似,超高压耦合热处理显著提高鱼糜凝胶的持水性。Cando 等[21]研究发现,超高压处理诱导鱼糜凝胶蛋白展开,疏水相互作用的增强使蛋白质与水结合更稳定,从而提高凝胶与水结合的能力。加压后的后续热处理可诱导形成持水能力强的有序鱼糜凝胶[20],均匀有序的凝胶网络结构能加强对水分的束缚,从而提高凝胶强度和持水性[22]。因此,超高压耦合热处理有利于鱼糜凝胶水分的保持。
2.3 不同处理过程对鳙鱼鱼糜凝胶白度的影响
由图1(D)可知,随着超高压耦合热处理的进行,鳙鱼鱼糜凝胶的白度呈上升的趋势,各阶段鱼糜凝胶的白度具有显著性差异(P<0.05)。相较于0.1P 样品,300P、300PS 和300PSH 三个处理阶段分别使鱼糜凝胶的白度增加了17.02%、25.99%、43.38%,表明超高压及后续的加热处理都对鳙鱼鱼糜凝胶的白度有贡献,且相较于超高压处理(300P),热处理(300PS 和300PSH)对白度的贡献更大。这可能是因为超高压处理诱导鱼糜已形成凝胶,形成致密的微观结构,这会影响光散射,导致白度值的变化[11]。此外,加热导致肌红蛋白变性,而影响鱼糜凝胶色度[23]。300P、300PS 和300PSH 三个处理过程对鱼糜凝胶白度改善的贡献度分别为39.23%、20.68%和40.09%,与压力处理相比(300P),后续的热处理对鱼糜白度贡献占比为60.77%,表明热处理相对于超高压处理会引起鱼糜凝胶更剧烈的变化(例如变性、色素氧化),因此使鱼糜凝胶的白度值进一步增大[6],300PSH样品的白度值(83.60)最大。谷氨酰胺转氨酶(Transglutaminase,TGase)的存在也会影响超高压处理的鱼糜凝胶微观结构。鱼糜凝胶的内源性TGase经超高压处理后保持较高的活性,随后的热处理促进内源性TGase 诱导的交联,有助于鱼糜凝胶形成稳定有序、保水的三维网络结构,而水分子往往会截留在较小的孔隙中,细密紧凑的网络能有效地保持凝胶体系中的水分,使鱼糜凝胶的水分状态变化,进而影响鱼糜凝胶的折光性和透明度,提高鱼糜凝胶的白度[11,23-24]。综上,超高压耦合热处理不同阶段对鱼糜凝胶白度的提高均有贡献。
2.4 不同处理过程对鳙鱼鱼糜凝胶质构的影响
在质构指标中,硬度和弹性一般被用来描述凝胶的质量,内聚性是分解内部结构的能力,胶着性是咀嚼半固体食品至可吞咽状态时所需的能量,而咀嚼性是咀嚼样本到能够吞下它所消耗的能量[20,25],质构指标一定程度上可反映鱼糜凝胶的组织结构性质。由表1 可知,与0.1P 样品相比,超高压及超高压耦合热处理可以显著提高鳙鱼鱼糜凝胶的质构特性(P<0.05)。0.1P 样品的各项质构参数均较低,经压力处理后,300P 样品的硬度、内聚性、弹性、胶着性和咀嚼性均显著得到提高(P<0.05),后续的热处理则进一步提高了鳙鱼鱼糜凝胶的硬度、胶着性和咀嚼性,其中300PSH 样品的硬度、弹性、胶着性和咀嚼性获得最大值,分别较0.1P 样品提高了765.04%、9.21%、930.76%、1021.86%,而超高压耦合热处理对鳙鱼鱼糜凝胶内聚性、弹性的影响相对较小。300PSH 样品的质构特性远优于300P 样品,其中300P、300PS和300PSH 三个处理过程对鱼糜凝胶硬度改善的贡献度分别为27.74%、18.76%和53.51%,说明热处理对凝胶质构的影响大于超高压处理。Buamard 等[20]报告也指出,超高压耦合热处理可显著提高沙丁鱼鱼糜凝胶的硬度、内聚性、胶着性和咀嚼性。由此可以认为,超高压和热处理均可改善鱼糜凝胶的质构。
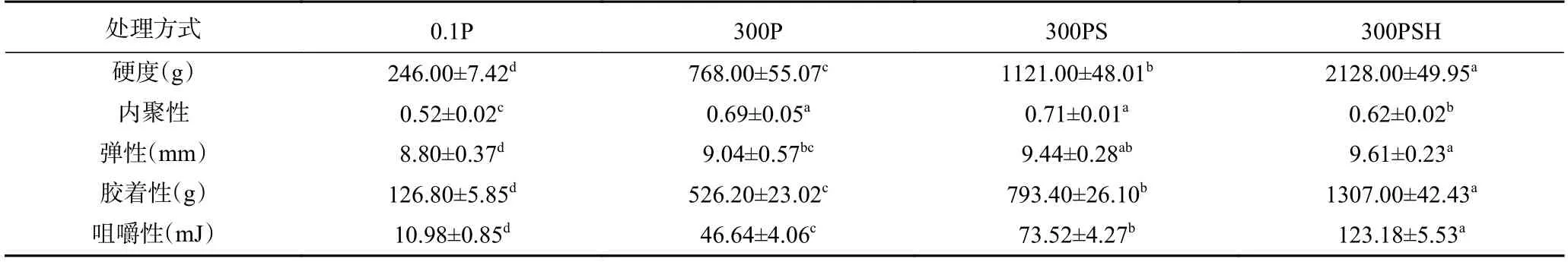
表1 超高压耦合热处理不同过程对鳙鱼鱼糜凝胶质构的影响Table 1 Effects of different ultra-high pressure coupled heat treatment processes on the gel texture of bighead carp surimi gel
2.5 不同处理过程对鳙鱼鱼糜凝胶SDS-PAGE 的影响
肌球蛋白是肉类食品中最重要的蛋白质,具有形成三维凝胶网络的能力,其物理化学性质的改变会影响凝胶的功能性[26]。图2 显示,超高压耦合热处理的不同处理阶段对肌球蛋白重链(MHC,220 kDa)和肌球蛋白轻链(MLC)条带密度影响较明显,说明肌球蛋白参与了凝胶的形成。随着热处理的进行,样品MHC 条带密度下降,其中300PSH 样品的MHC条带最浅。结果表明,超高压耦合热处理过程可使鱼糜样品内部较多的肌球蛋白发生分子内或者分子间交联或聚集,而这种交联的大分子聚集体无法穿透电泳凝胶,导致MHC 的条带密度下降,MHC 带强度减弱伴随着机械性能的增加[11,27]。这可能是超高压处理后,内源性TGase 仍保持较高活性,内源性TGase诱导MHC 通过ε-(γ-谷氨酰)-赖氨酸键发生共价交联[28]。超高压有利于蛋白质溶解和展开,通过蛋白质聚集的方式来诱导凝胶化[29]。压力和热处理都会导致二硫键的形成[6],后续的热处理可能通过二硫键促进蛋白分子内及分子间的交联,进一步促进凝胶中发生分子构象变化较大的蛋白质聚集,使得300PS 和300PSH 样品的MHC 条带强度减弱。超高压耦合热处理导致MHC 条带密度的下降,这与前人的研究结果相似[11,20,30-31]。鱼糜凝胶性能的改善与鱼糜凝胶蛋白的变性和聚集有关,大分子聚集体的形成有助于弹性凝胶体的形成[6]。超高压耦合热处理使鱼糜肌球蛋白发生变性,从而改善鱼糜凝胶特性。

图2 鱼糜凝胶的SDS-PAGEFig.2 SDS-PAGE of surimi gel
2.6 不同处理过程对鱼糜凝胶蛋白质二级结构的影响
蛋白质的二级结构在较强的高压(300~700 MPa)下发生变化,包括通过多肽链的羰基氧(-CO)和氨基氢(NH-)之间的分子内氢键稳定的α-螺旋结构、由分子间氢键组织的β-折叠结构、通常分布在蛋白质分子的表面的β-转角结构和无规卷曲结构[32]。由表2 可知,鳙鱼鱼糜凝胶蛋白的二级结构主要是β-转角,其次是β-折叠。随着超高压耦合热处理不同阶段的进行,300P 和300PS 组的α-螺旋结构减少明显(P<0.05),较0.1P 样品分别降低了1.72%、4.18%。β-折叠结构整体呈现增加的趋势,其中300PSH 组的β-折叠含量获得最大值,较0.1P 样品增加了8.87%,这与凝胶强度的变化一致,说明β-折叠对凝胶强度的提高具有贡献。超高压处理有利于诱导β-折叠结构的增加,这与前人研究结果相似[29,33]。300P 的β-折叠含量较0.1P 样品增加了3.25%,说明超高压可诱导较弱的分子内氢键并增强分子间氢键[25]。超高压处理可导致聚合物链之间分子间距的缩短,破坏维持蛋白质稳定的化学键的相互作用,暴露埋藏在疏水区域的氨基酸侧链,使蛋白质分子重新展开、弱非共价键破坏以及新键形成[24]。后续的热处理使β-折叠含量的增加,Liu 等[34]研究表明,鲢鱼肌球蛋白凝胶的α-螺旋会随着热处理的温度升高而降低,转变为β-折叠,这种转变在凝胶化中起重要作用。Bouraoui等[35]在太平洋鳕鱼鱼糜的热凝胶过程也观察到类似的现象(α-螺旋减少与β-折叠的增加)。综上,超高压耦合热处理过程伴随着鱼糜凝胶的β-折叠含量的增加。

表2 超高压耦合热处理不同过程对鳙鱼鱼糜凝胶二级结构的影响Table 2 Effects of different ultra-high pressure coupled heat treatment processes on the secondary structure of bighead carp surimi gel
2.7 不同处理过程对鱼糜凝胶分子间作用力的影响
离子键、氢键、疏水相互作用和二硫键等分子力对鱼糜凝胶网络的维持起重要作用。由图3(A)可知,氢键是0.1P 样品的主要分子间作用力,疏水相互作用在300P、300PS、300PSH 凝胶中占主导地位。在超高压耦合热处理不同过程中,随着处理过程的推进,鱼糜凝胶的离子键呈现显著下降的趋势(P<0.05),说明超高压和热处理均显著影响离子键的数量。鱼糜凝胶的氢键呈先下降后上升的趋势,疏水相互作用呈整体上升的趋势,这可能是加热会破坏支持α-螺旋和β-转角结构的链内氢键,同时增强在β-折叠和天然无序(非周期性)结构中的疏水相互作用[29]。疏水相互作用与凝胶强度的变化大致相同,推测疏水相互作用对凝胶网络结构的形成发挥重要的作用。二硫键对蛋白质特定的分子结构起相关作用,超高压耦合热处理过程中,鱼糜凝胶的二硫键呈整体上升的趋势,这与凝胶强度、白度的变化趋势一致,表明超高压和热处理都会导致二硫键的形成。高比例的疏水相互作用往往导致形成牢固的网络结构,而二硫键的形成有利于凝胶形成有序的网络结构[32]。300P 样品的二硫键增加可能是由于加压作用使巯基的间距减小,促进凝胶形成二硫键[31]。此外,300P、300PS 和300PSH 凝胶的二硫键呈现逐渐增加的趋势,这可能是鱼糜蛋白质α-螺旋结构的展开,β-折叠结构的增加,有利于暴露更多的活性巯基,从而导致巯基氧化为分子间或分子内新的二硫键。Lu 等[22]研究表明,鳙鱼肌原纤维蛋白凝胶蛋白分子之间的离子键和氢键在加热后含量显著下降,加热使蛋白质结构适度展开,导致疏水基团暴露,并且热处理有助于鱼糜凝胶中二硫键的形成。此外,疏水相互作用和二硫键含量的变化与凝胶强度的变化相似,说明二者是稳定鱼糜凝胶结构的主导作用力,300PSH 组的断裂力和凝胶强度达到最高水平,这可能是较高的疏水相互作用和分子间二硫键导致的。
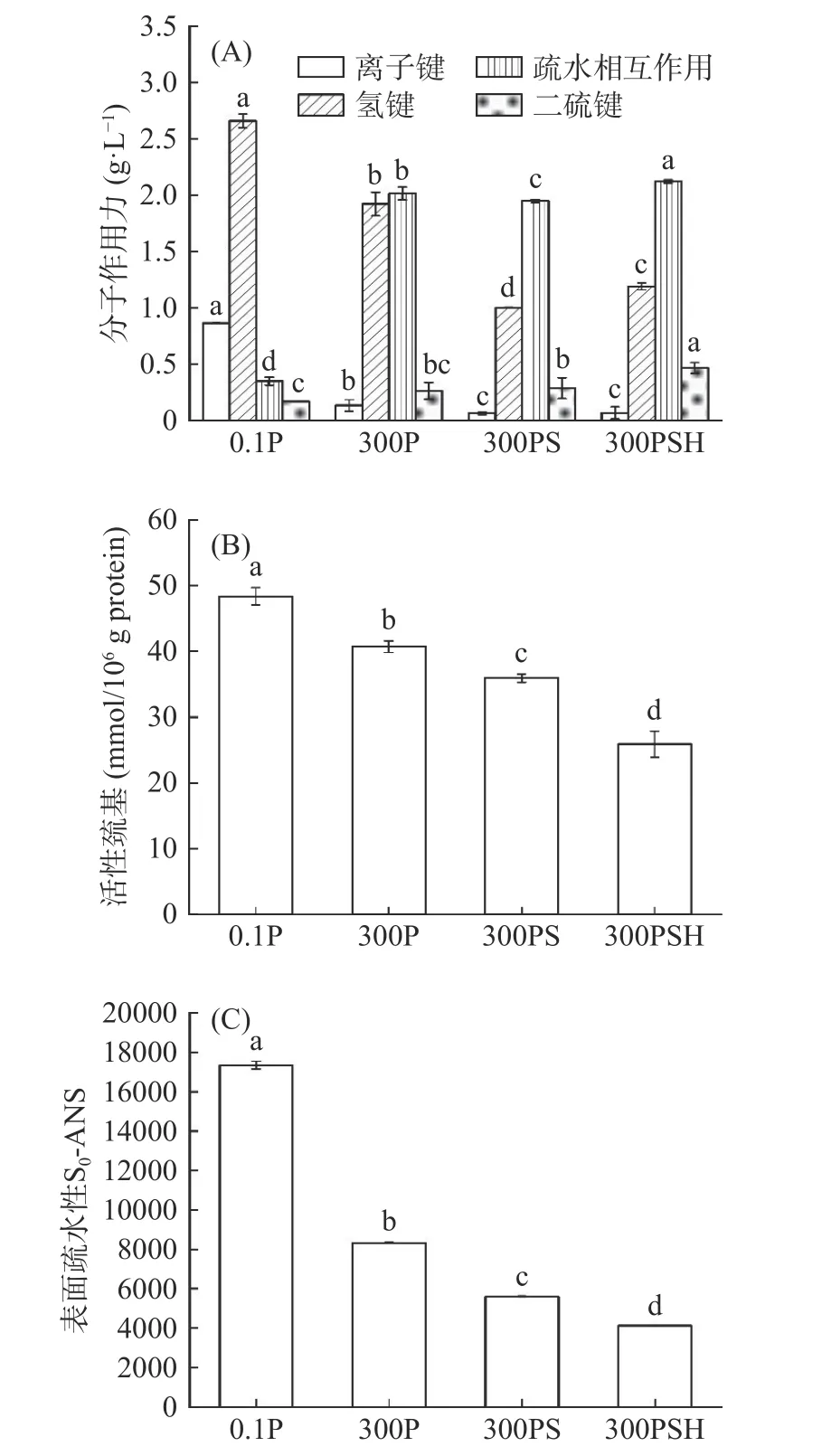
图3 超高压耦合热处理不同过程对鱼糜凝胶分子间作用力(A)、活性巯基(B)和表面疏水性(C)的影响Fig.3 Effects of different ultra-high pressure coupled heat treatment processes on the intermolecular forces (A),active sulfhydryl group (B) and surface hydrophobicity (C)of surimi gel
2.8 不同处理过程对鱼糜凝胶活性巯基和表面疏水性的影响
巯基(SH)含量和表面疏水性(S0-ANS)的变化可以反映蛋白质分子的三级和四级结构的变化程度[36]。由图3(B)可知,随着处理过程的推进,鳙鱼鱼糜凝胶的活性巯基的含量呈现显著下降的趋势(P<0.05),这与二硫键含量的变化相反。300P 样品的活性巯基下降,可能是由于鱼糜凝胶蛋白在超高压的作用下发生了变性,蛋白构象的变化导致内部巯基基团暴露,而表面活性巯基基团易脱氢形成二硫键[11]。与300P 样品相比,300PS 与300PSH 样品的活性巯基显著下降,可能是热处理诱导活性巯基向二硫键转变,导致压力耦合热处理的鱼糜凝胶中巯基的含量比单独压力处理降低更明显,这与前人的发现相似[21,29]。此外,超高压耦合热处理可能使鱼糜凝胶蛋白变性后重新聚集,活性巯基可能会迅速重排并嵌入新的聚集体中[24],活性巯基含量下降。
表面疏水性与分布在蛋白质表面的疏水性氨基酸残基数量有关,并显著影响肌球蛋白的聚集。由图3(C)可以看出,与0.1P 样品相比,300P、300PS、300PSH 样品的表面疏水性(S0-ANS)显著下降(P<0.05),且呈依次下降的趋势,以300PSH 组的S0-ANS最小。研究表明,超高压会导致蛋白质构象的变化,使凝胶蛋白内部的疏水基团暴露,凝胶蛋白在超高压作用下进一步折叠,使暴露的疏水基团通过疏水相互作用更多地埋藏在蛋白质内部,300P 样品的S0-ANS 减少[19,37]。在超高压和加热处理过程中暴露的疏水残基可能相互靠近并形成聚集体[32],使鱼糜凝胶的表面疏水性随着超高压处理、一段热处理、二段热处理的推进逐渐减少。
2.9 不同处理过程对鳙鱼鱼糜水分迁移的影响
凝胶中不同状态水分子相对含量或迁移率发生变化为水分迁移,水分迁移对凝胶特性的改善起重要作用,可用低场核磁共振表征样品中的水分分布及迁移率变化[8]。质子横向弛豫时间(T2)可以反映水分与凝胶结合的程度。弛豫时间越大,表明水与大分子的结合越松散,水分子的流动性越大;反之,弛豫时间越小,表明水与大分子的结合越紧密,水分子受到的束缚力越强、流动性越弱。其中弛豫时间T21、T22和T23分别表示鱼糜凝胶中的结合水、不易流动水和自由水受到的束缚力,三种状态水对应的单位质量峰面积为A21、A22和A23[33],两者揭示了三组水分状态的变化。结合水主要与离子基团结合,不易流动水是截留在凝胶三维网络结构中的水,自由水是存于鱼糜凝胶结构外的流动性较大的水[34,36]。
通过图4 可知,鳙鱼鱼糜不同过程中都检出结合水和不易流动水的弛豫峰,但只有300PSH 检出自由水的弛豫峰,不同鳙鱼鱼糜凝胶样品的水分形态和水分分布存在一定差异(表3)。与0.1P 样品对比,300P 样品的T21和T22显著增加,说明超高压处理可导致结合水和不易流动水受到的束缚力减弱。随着热处理过程的进行,T21和T22逐渐减小,其中300PSH 的T22显著降低(P<0.05),表明热处理增强了鱼糜凝胶对不易流动水的束缚,不易流动水的流动性减弱。未检测到0.1P、300P 和300PS 样品的T23,可能是由于样品未形成刚性的网络结构,仍然以偏粘性状态存在,而粘性糊状体系中水分子的流动性很弱[12]。

表3 超高压耦合热处理不同过程对鳙鱼鱼糜凝胶水分迁移率和水分分布的影响Table 3 Effects of different ultra-high pressure coupled heat treatment processes on water mobility and water distribution of bighead carp surimi gel
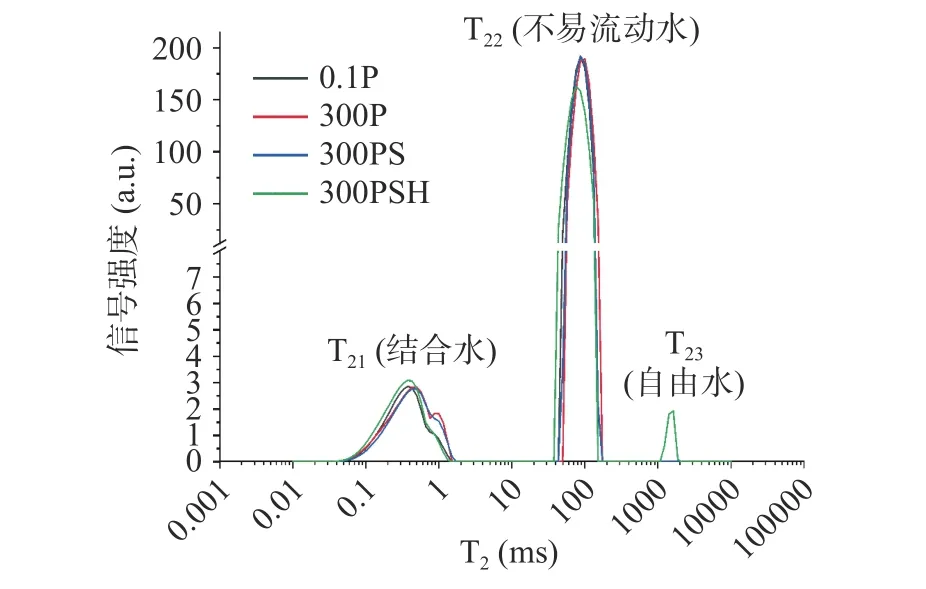
图4 超高压耦合热处理不同过程对鳙鱼鱼糜凝胶T2 弛豫时间的分布的影响Fig.4 Effects of different ultra-high pressure coupled heat treatment processes on the distribution of T2 relaxation time of bighead carp surimi gel
单位质量峰面积可用于量化水的相对含量。由表3 和图4 可知,相较于0.1P 样品,300P 和300PS样品的A21和A22均变化不显著(P>0.05),300PSH样品的A21显著增加、A22显著减少(P<0.05),且300PSH 样品测出A23,说明超高压耦合热处理有助于鱼糜凝胶中的不易流动水向结合水和自由水迁移。300PSH 样品自由水的出现,可能是由于高温处理在一定程度上破坏了蛋白质之间的交联性,导致凝胶网络结构的部分断裂,进而导致部分水从凝胶网络结构的内部转移到外部,造成不易流动水朝自由水迁移。秦影等[13]研究也表明,超高压处理的大黄鱼鱼糜未检测到自由水组分,而热处理的鱼糜可检测出自由水,这与本研究结果类似。
2.10 不同处理过程对鳙鱼鱼糜凝胶微观结构的影响
蛋白质凝胶可被视为一种高水分的三维聚合物网络,可捕获或固定水分子[25]。采用SEM 观察鱼糜凝胶的微观结构,不同处理过程鱼糜凝胶的扫描电镜图如图5 所示。由图5 可见,未处理(0.1P)的鱼糜结构聚集成团,孔洞粗大、结构松散且分布不均匀。与0.1P 样品相比,经压力处理后的鱼糜凝胶(300P)结构更紧实,表面更光滑平整;随着加热处理的进行,300PS 的凝胶结构进一步交联,凝胶孔洞增多,形成较均匀有序的凝胶结构;而300PSH 组的鱼糜凝胶蛋白充分变性并交联,形成密实均匀有序的结构。超高压遵循Le Chatelier 原理,鱼糜经压力处理后,其化学反应平衡、分子构象改变等都将朝着体积减小的方向进行,并且超高压诱导蛋白质展开暴露反应基团,促进疏水相互作用,因此300P 鱼糜凝胶结构变得更紧实[32]。Li 等[24]认为适度的超高压处理诱导凝胶网络通过蛋白质间的相互作用而紧密交联,凝胶空隙变小。超高压耦合热处理后,300PS 与300PSH 的凝胶结构进一步改善,可能是热处理诱导鱼糜凝胶蛋白二硫键的适度交联以及疏水相互作用的增强,进而形成稳定的凝胶结构[22],此外,鱼糜热凝胶化与蛋白质的展开和聚集的速度密切相关,热处理阶段可能诱使鱼糜凝胶蛋白质展开速度快于聚集速度,则凝胶形成相对均匀有序的结构[25],均匀有序的凝胶网络结构能加强对水分的束缚,从而提高凝胶强度和持水性。

图5 超高压耦合热处理不同过程鳙鱼鱼糜凝胶的扫描电镜图Fig.5 Scanning electron microscopy of bighead carp surimi gel in different processes of ultra-high pressure coupled heat treatment
2.11 相关性分析
对鱼糜凝胶特性、蛋白质结构及水分分布的指标进行聚类热图和Pearson 相关性分析,以4 水平24 个指标为变量,结果如图6 所示。由图6 可知,鱼糜凝胶的凝胶强度和质构特性与A21、持水性、二硫键、β-折叠为一大聚类,表明这些指标具有较大的相关性。通过表4 可以看出,超高压耦合热处理不同过程中,鳙鱼鱼糜凝胶的凝胶强度与β-折叠极显著相关(P<0.01),与破断力、弹性、胶着性、咀嚼性、白度、A21显著正相关(P<0.05),与硬度、二硫键具有较强的正相关性(相关系数>0.8)。其中鱼糜凝胶的A21的变化趋势与凝胶强度结果一致,二者的相关系数为0.957,表明凝胶网络结构中结合水含量的增加,有助于提高鱼糜凝胶强度。凝胶强度与A22、氢键、活性巯基、表面疏水性呈现显著负相关性(P<0.05),与凹陷深度、离子键、β-转角具有较大的负相关性(|相关系数|>0.8)。综上,鱼糜凝胶特性的变化受凝胶蛋白理化特性以及水分迁移的影响。推测超高压耦合热处理过程使鱼糜凝胶蛋白展开,引起β-折叠含量的增加,促进鱼糜凝胶蛋白及水分子与活性基团的相互作用,通过形成均匀有序的凝胶网络结构增强对水分的束缚,最终改善鱼糜凝胶的质构特性与持水性。
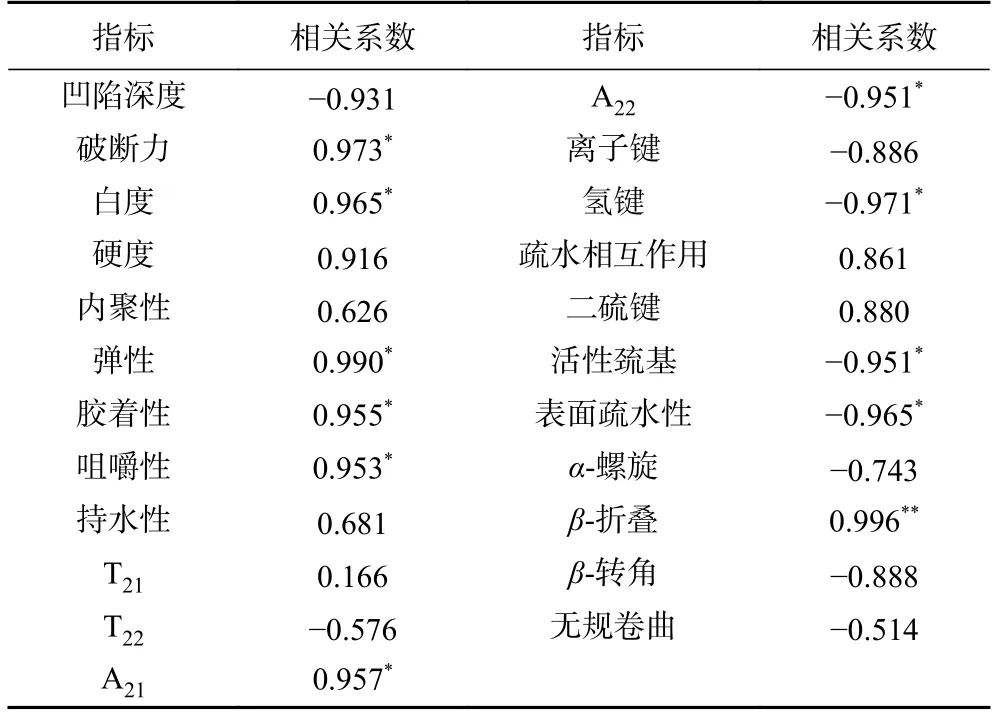
表4 超高压耦合热处理不同过程鳙鱼鱼糜凝胶的凝胶强度和其他指标的相关性分析Table 4 Correlation analysis of gel strength and other indexes of bighead carp surimi gel in different processes of ultra-high pressure coupled heat treatment

图6 超高压耦合热处理不同过程鳙鱼凝胶特性与各指标之间的聚类热图Fig.6 Heat map clustering of bighead carp gel characteristics and indexes in different processes of ultra-high pressure coupled heat treatment
3 结论
超高压耦合热处理不同过程(300 MPa/5 min、300 MPa/5 min+40 ℃/30 min、300 MPa/5 min+40 ℃/30 min+90 ℃/20 min)对鳙鱼鱼糜凝胶性能的改善均具有贡献作用,其中超高压结合二段热处理诱导鱼糜凝胶化的效果最佳。研究结果表明,超高压耦合热处理过程中鳙鱼鱼糜凝胶特性变化的机制为:超高压耦合热处理过程修饰了鱼糜凝胶蛋白质的二级结构,促使α-螺旋结构向β-折叠转变,β-折叠含量增加,暴露活性基团,并通过二硫键的形成、疏水相互作用以及氢键等凝胶蛋白分子间作用力促进蛋白质与蛋白质、蛋白质与水的相互作用以及MHC 的交联,形成致密有序的三维网络结构可截留更多的不易流动水,其中超高压处理使鱼糜凝胶中不易流动水向结合水迁移,热处理过程增强了凝胶对结合水和不易流动水束缚,进而显著提升鱼糜凝胶的凝胶强度、质构特性、白度、持水性。并且相关性分析表明鳙鱼鱼糜凝胶质构特性的改善与鱼糜凝胶蛋白结构的改变、水分存在状态显著相关。本研究初步阐明超高压耦合热处理过程的鱼糜凝胶特性改善机制,而在分子水平或更微观层面的超高压耦合热处理过程鱼糜凝胶特性改善的作用机制,有待进一步探讨。
