CH4/H2O/H2辅助热催化CO2转化机制
2023-12-02马丹妮颜天天GUENELOUGOUBachirou潘如明
马丹妮, 颜天天, 张 烁, GUENE LOUGOU Bachirou,张 昊, 潘如明, 帅 永,*
(1. 哈尔滨工业大学 能源科学与工程学院, 黑龙江 哈尔滨 150001;2. 哈尔滨工业大学 电气工程及自动化学院, 黑龙江 哈尔滨 150001)
0 引 言
目前人类活动所消耗的一次能源以化石燃料为主,燃料燃烧产生的碳排放约占全球碳排放的90%。多数工业催化反应(如Haber-Bosch工艺和Fischer-Tropsch合成)是由热能驱动,对化石燃料需求巨大,生产过程中产生的大量二氧化碳对环境存在严重影响,极大地限制了相关过程的可持续性。为实现碳中和目标,研究者们提出了相关的方法、技术和路径,以便更有效、快速地减少二氧化碳排放。捕获和就地转化二氧化碳是应对碳中和挑战最有效的策略[1-2],包括燃煤电厂、黑色和有色金属冶金工艺、水泥生产等在内的二氧化碳排放源,都涉及热驱动的化学反应。为满足这些生产的高能源需求,研究者们寻求绿色和可持续方法,如采用太阳能热效应驱动催化过程。利用太阳能热催化转换二氧化碳生产清洁燃料的可再生系统开发是新能源产业的一个关键研究重点,目前已有大量工作围绕未来可持续碳基能源的太阳能热化学储能技术。
太阳能热催化过程是一个新兴的研究领域,在温和条件下通过各种催化反应高效转化太阳能的方式具有巨大的潜力[3-5]。在适当的反应条件下,二氧化碳可以高效地转化为绿色燃料或化工产品[6-7]。然而,要同时实现高太阳能转换效率和良好的循环稳定性仍存在挑战。研究者在提高传热效率和多电子传输过程的动力学和热力学方面进一步研究和创新思路,在阻止电子-空穴重组、加速光热能量转换过程提出了高效解决方案,其研究重点集中于先进反应装置设计以及光、热电子输运特性的强化等方面[8-11]。相关研究表明,在其他活性气体(H2O、CH4和H2)的帮助下,CO2可直接或间接地被热还原为C1+和C2+[2,12-13]。如图1所示,以CO2、H2O和H2为主要原料,通过太阳能驱动的Sabatier反应和逆向水煤气转换(RWGS)反应,可以生成合成天然气(SNG)和CO等产品。合成天然气因其高能量密度和基础设施强兼容性特点而在化工工艺中占据了独特地位,一氧化碳则是生产甲醇和长链碳氢化合物的重要原料[14]。目前已开发了多种热催化工艺以促进二氧化碳转化,其特点是在热激活时具有不同的反应性、选择性和稳定性。根据反应条件,热催化二氧化碳转化反应介质可能存在复杂的耦合现象,包括热解、焦化、碳化、气化、燃烧、分解、煅烧、热氧化、热还原、热裂化以及各种氧化还原或催化剂材料的烧结等。热催化二氧化碳还原反应在热力学和动力学上都是可行的,通常具有反应速度快和产品选择性强的特点[4,15-16],但面对仍然存在的关键挑战和技术瓶颈,需更多的研究投入相关领域以实现更高效率的二氧化碳转化。目前研究者们对二氧化碳热催化转化反应的机制和动力学相关研究的不足,限制了对反应方案、反应物转化、反应工况优化、中间产物、主要产物选择性以及各种影响因素下反应速率变化的深入了解。
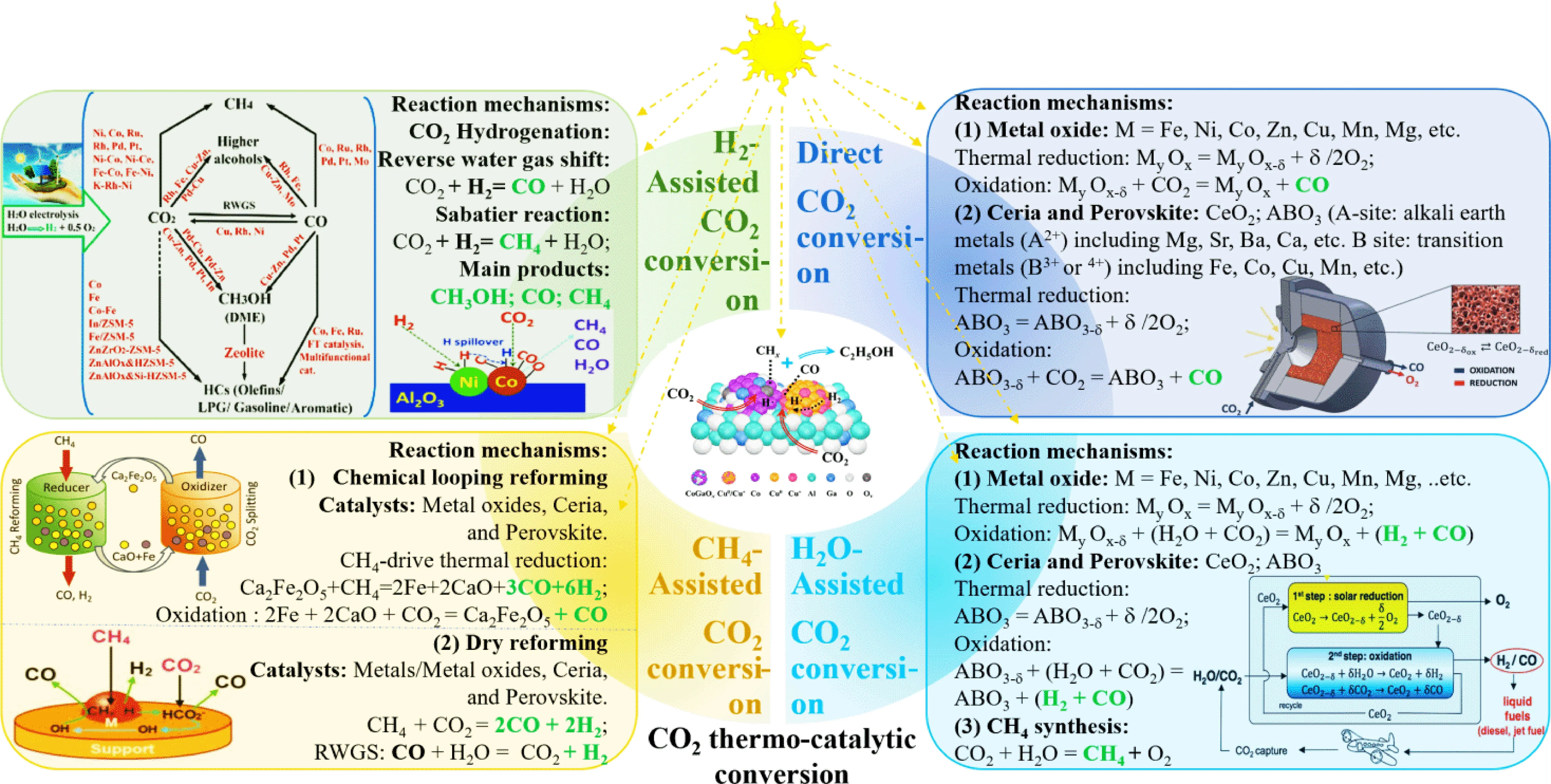
图1 热催化CO2转化机制Fig. 1 CO2 thermo-catalytic conversion mechanisms
已有大量的基础研究集中于多种形式耦合的实验方法,致力于设计热催化反应和装置以及制备纳米复合催化材料[17-19],其最终目标是寻求一种高效的二氧化碳捕获和转化、燃料生产和高密度化学能源储存的方法,这在可持续的碳中和能源和环境发展方面表现出了巨大的潜力。鉴于其对实现碳中和目标和日常生活可持续发展的贡献,无疑需要一门学科来缩小温室气体(主要为CO2和CH4)排放和转化为工业化学原料之间的差距。为满足这种需要,热催化过程已成为一个跨学科的科学技术领域,研究热诱导催化剂活化和热驱动化学反应的相关过程。本文主要介绍CH4/H2O/H2辅助热催化二氧化碳转化机制,列举创新反应过程和相关反应器设计,重点阐述与太阳能热化学CO2转化有关的科学问题和关键限制因素,明确了将热化学系统升级为更合理和高效CO2转化方法的手段。综合该领域的主要研究进展,进一步讨论对二氧化碳催化转化的研究观点,并评估该方法对可持续能源和环境发展的应用潜力。
1 CH4辅助还原CO2
研究者将二氧化碳与其他ΔG0负值较小的活性气体(如CH4(ΔG0=-50.7 kJ·mol-1)和H2(ΔG0=0 kJ·mol-1))相结合,使二氧化碳更容易转化为燃料。目前,热化学技术的挑战在于如何在无外加能源的条件下利用太阳辐射能量流将CO2、CH4和H2O的混合物直接转化为高价值产品,其原理如图2所示。
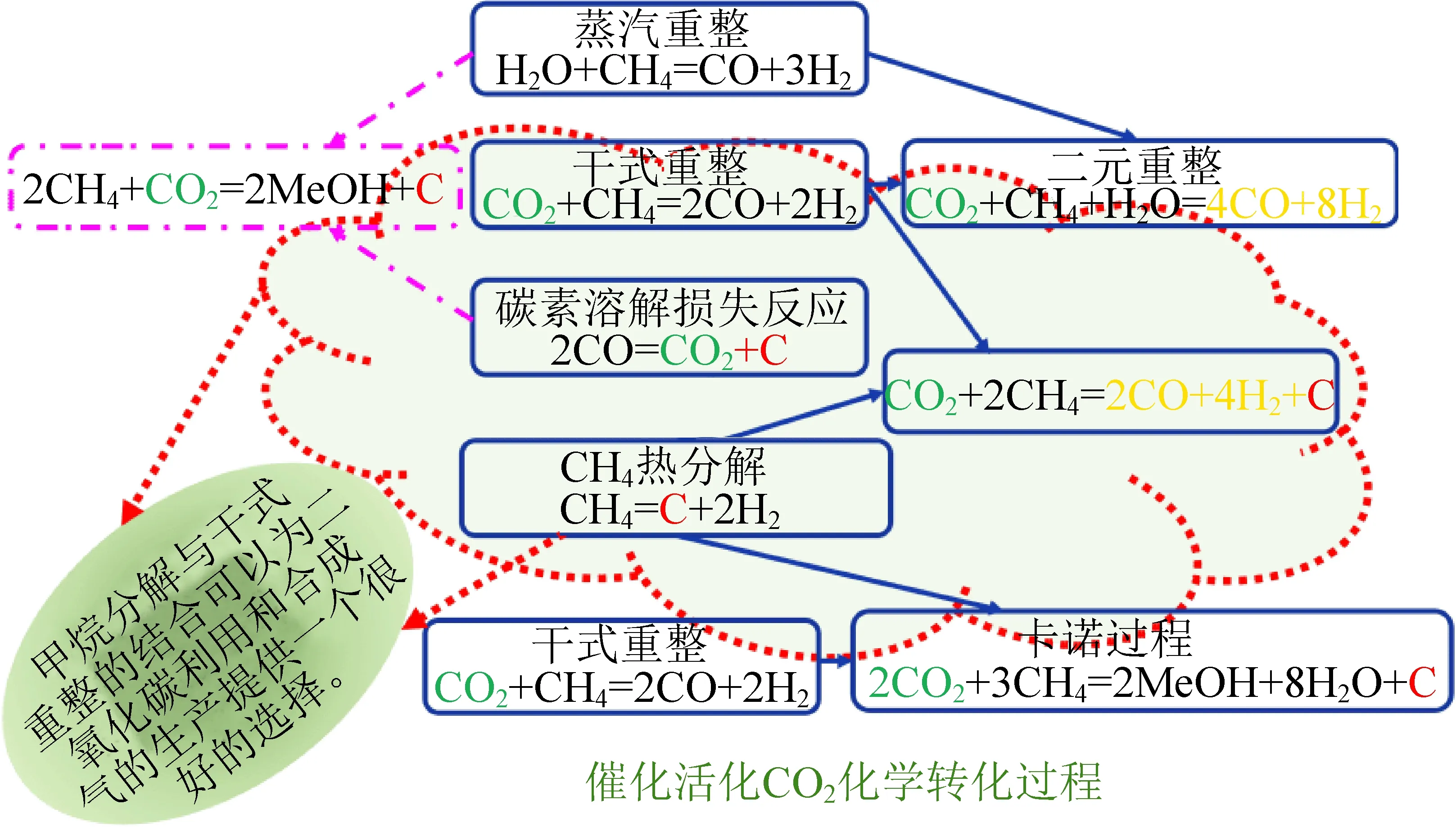
图2 CH4分解与CO2再利用相结合Fig. 2 CH4 decomposition combined with CO2 reuse
如图3(a)所示,ARCENEGUI等[1]开发了Ca-循环重整系统,通过CaO-Ni进行大气二氧化碳的原位转化,最大合成气产量为10.4 mmol/gsorb.-cat.,能耗为22%,远低于传统的DMR系统[20]。研究学者还开发了一种提高二氧化碳转化率的CO复杂反应,称为超干重整。在1 023 K时,由CaO/Al2O3材料、用于CH4转化的Ni/MgAl2O4催化剂和与二氧化碳发生再氧化的Fe2O3/MgAl2O4氧化还原催化剂组成的原位固定二氧化碳的系统生成了7.5 mmol/kgFe产物[6]。这一过程有利于研究学者对原料筛选和提高二氧化碳化学转化率及选择性的功能性催化系统设计。ZHU等[21]提到,接近1.0的较高镁/铝比率的催化剂表现出较高的催化剂活性、材料稳定性和炭沉积抑制。与Ca-循环重整系统不同,考虑到烧结是影响反应动力学的因素,在超干重整中使用Al2O3载体以保护活性材料在整个循环反应中不发生烧结。CH4辅助的二氧化碳化学转化受到研究学者关注,通过提高整体的二氧化碳转化效率,提升CO合成产量[2,22-23]。如图3(b)所示[24-26],在反应系统中加入CH4可降低热化学过程中产生的高温,该过程产生的合成气(H2+CO)可以转化为CH3OH或进一步转化为C2+,两步热化学循环重整更好地描述了CH4辅助的高效CO2利用的用法[27-28],气相反应和相关参数见表1。
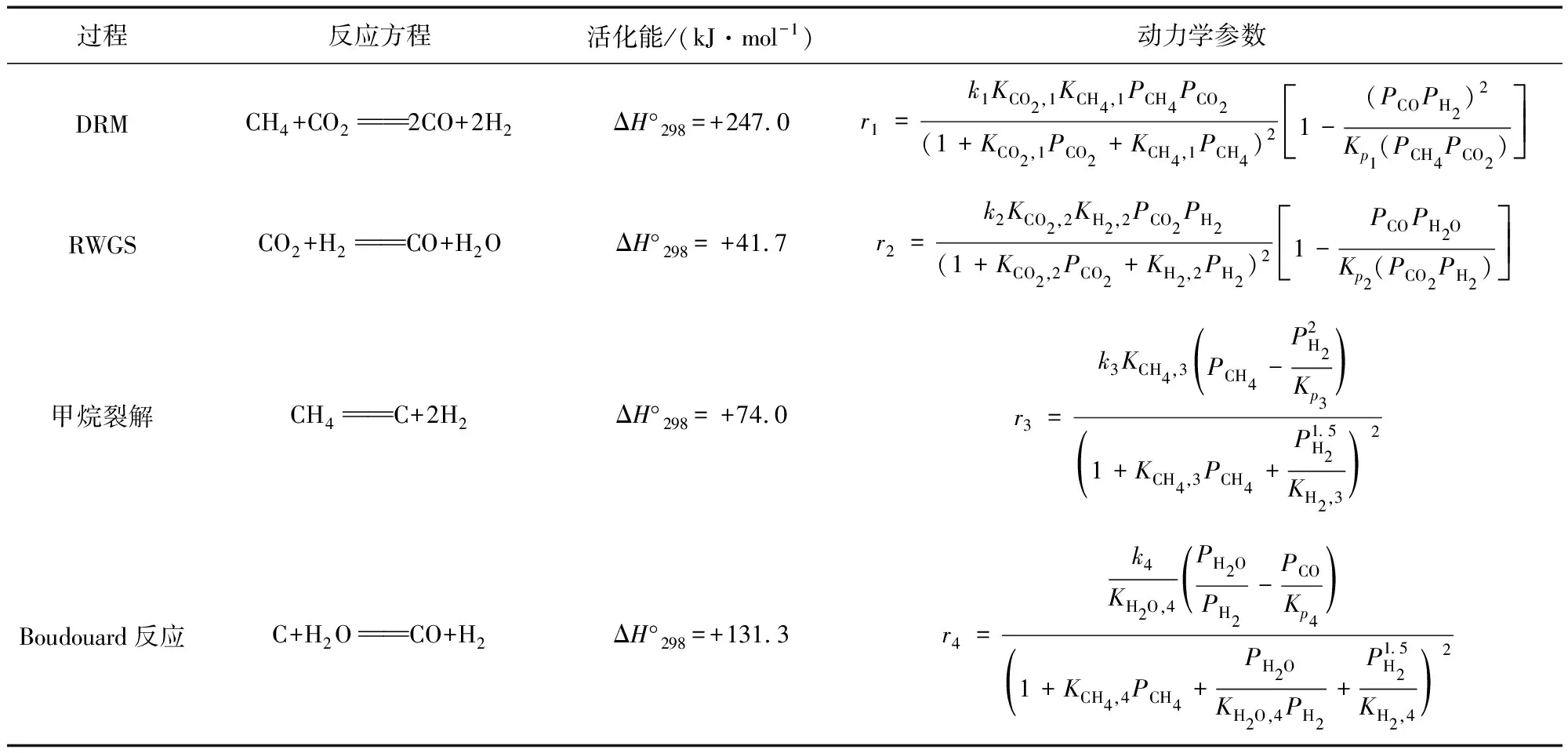
表1 热化学循环重整二氧化碳利用过程中的气相反应和反应速率参数[29-30]
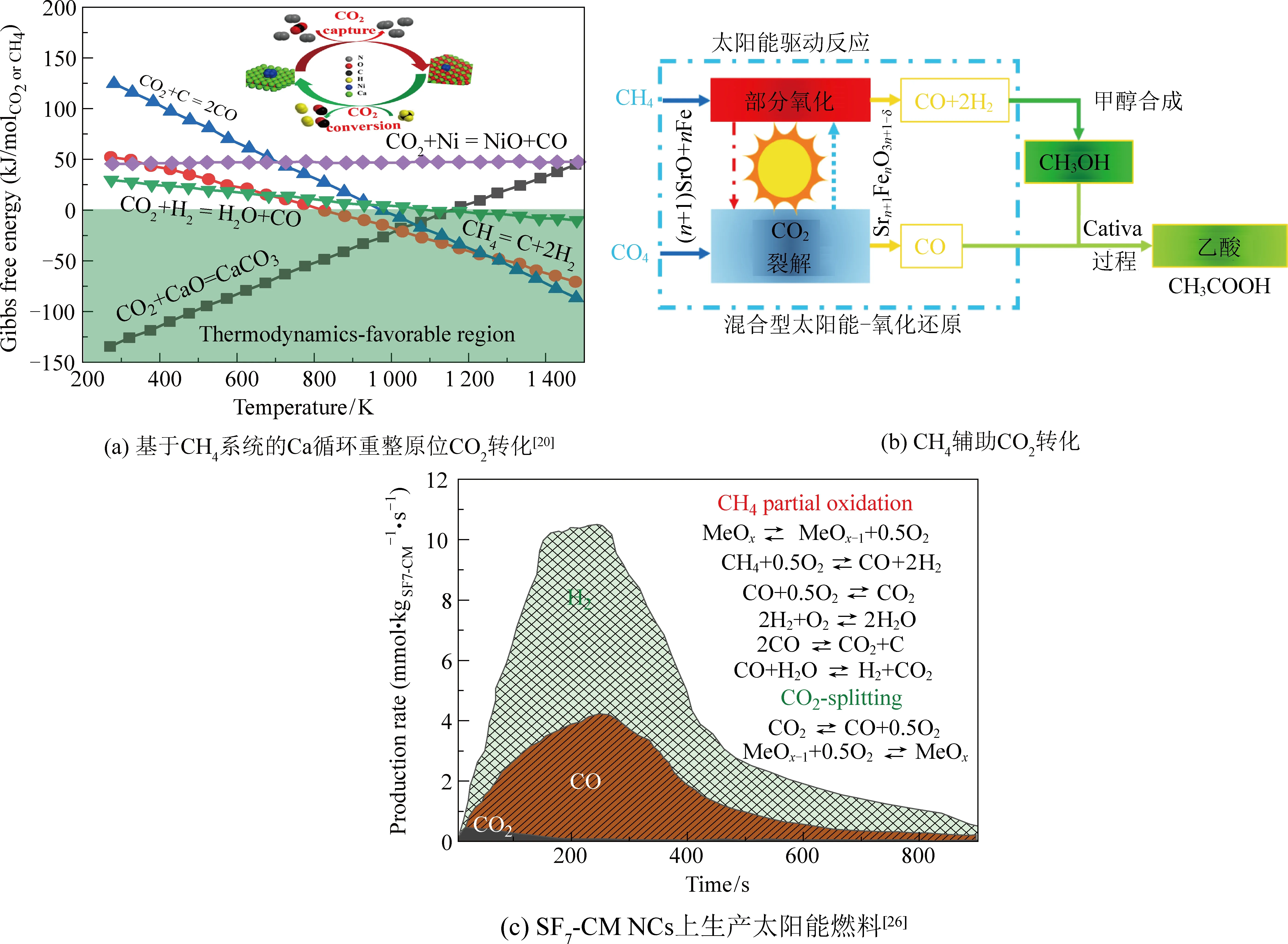
图3 CH4/H2O/H2辅助的CO2化学转化Fig. 3 CH4/H2O/H2-assisted CO2 chemical transformation
然而,PO2是提高合成气产量的控制因素,也是热还原和氧化中CO2裂解的控制因素。如图3(c)所示,ZHANG等[26]开发了一个利用Sr3Fe2O7-δ-Ca0.5Mn0.5O纳米复合材料的干重整氧化系统,该系统可以克服热力学限制,在900 ℃下分别产生约8.03、4.14、0.51 mmol·kgSF7-CM-1·s-1的H2、CO、CO2。
相关理论研究深入解析了影响CH4辅助还原CO2的相关因素[31-35]。最近报道的热点问题与CH4转化率的负面影响有关,随着进口流速和CH4/CO2相对于热传输的比例增加,固相的热导率和材料孔隙率增加,整体化学转化率以及CO2化学能量的储存效率得到了一定提升[34,36-38]。CH4辅助CO2相关技术的工业化挑战主要是催化剂表面的焦炭沉积物易阻塞活性位点。整体而言,它是一种可靠的温室气体控制与负排放技术。密集的炭沉积可以通过使用额外的CO2供氧[33,39]或通过在Ni/ZrO2催化剂中适当掺入K、Na、Cs和Mn[40]的方法去除。Ni-Fe双金属的协同作用可以提高Ni催化剂分解CH4活性[41],进而产生总量为29、9.6 mol·kgcatal.-1的H2和CO[32]。THEOFANIDIS等[42]基于Mars-van Krevelen反应机理的相关研究表明,铁/镍摩尔比为0.7的贫铁矿可以在较低的失活率下获得较高的CH4和CO2转化协同活性。与CH4相比,Ce-La-O反应位点的催化剂活性可能具有较低的CO2活化能,在某些条件下能够表现出较高的CO2转化率。在Ce0.70La0.20Ni0.10O2-δ上进行的CH4辅助CO2催化转化的动力学分析表明,在923~1 023 K时使用幂律模型计算CH4和CO2的活化能分别为91.5、70.2 kJ·mol-1,通过Langmuir-Hinshelwood动力学模型估计CH4和CO2的活化能为136.9和100.6 kJ·mol-1[33]。催化剂组成的原材料对于原位CO2转化和选择性仍是一项挑战。热化学循环过程中可以通过控制PCH4和PCO2以及氧化物催化系统中的氧分压,从而调整H2/CO的比例与合成气的质量[33]。
2 H2O辅助还原CO2
相较于CO2裂解而言,CO2和H2O共同裂解的显著优势是燃料生产率的提高[3],但与氧化完成的O2相比,NiFe2O4-δ经过CO2或H2O裂解的再氧化受到晶格O交换速率的限制[24]。SCHEFF等[54]还指出,虽然La0.65Sr0.35MnO3在1 773 K时具有更大的还原性,并没有完成与CO2或H2O的再氧化,但再氧化在1 173 K和1 273 K时比CeO2产生了更多的燃料。在La0.5Sr0.5MnO3+δ中增加少量Sr可使1 650 ℃等温CO2和H2O裂解的理论太阳能转燃料效率提高约28%[55]。如图4所示,使用较高的Sr含量并将Co0.7Fe0.3O3替换成La0.3Sr0.7-Co0.7Fe0.3O3,会在500 ℃形成Co4+、Fe4+,在700 ℃形成Co3+、Fe3+,这更有利于H2O裂解,而在900 ℃形成Co2+、Fe2+时变得更加明显[56]。较低的氧化动力学通常与氧化物催化剂的化学组成有关,热物理特性表现为较低或较高的O2扩散系数[8,57]。
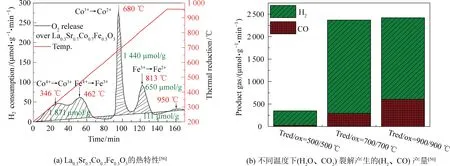
图4 催化剂的化学组成对H2O辅助还原CO2产量的影响Fig. 4 Effect of chemical composition of catalyst on the yield of H2O-assisted CO2 catalytic splitting
如图5所示,为了通过H2O和CO2裂解提高太阳能燃料的生产能力,开发了由复合氧化还原催化剂包覆CeO2的工程材料La0.5Sr0.5Mn0.9Mg0.1O3。与纯CeO2相比,其CO和H2产量更高但产率相对较低,并且再氧化过程仍然不够完全[58]。La0.5Sr0.5Mn0.9Mg0.1O3具有更好的氧交换能力,可以达到269 μmol/g,高于CeO2在热还原时释放的55 μmol/g。这些材料在将CO2和H2O裂解成387 μmol/g的CO和234 μmol/g的H2时具有更佳的氧化热力学优势,这是因为CeO2层的氧化动力学更快。使用La0.6Sr0.4Cr0.8Co0.2O3-δ通过与H2O的氧化获得0.08%的较低重量变化,产生50 μmol/g的H2和157 μmol/g的CO,在800~1 200 ℃时则观察到0.25%的较高重量变化[10]。材料表现出的O2扩散系数越高,其在氧化热力学方面就越有利。同时,随着反应温度的变化,其再氧化过程就越快。不同氧缺陷材料的氧化还原性能可能导致H2O和CO2催化分解产生过多的H原子和C。由于H2和CO在较低的温度下不稳定,这些中间产品可以通过化学重组转化为其他产品,例如CH4。利用这一特性,LIU等[59]合成了含O空穴的NiFe2O4-δ,它能有效地将CO2和H2O转化为CH4而无需外部H2的供应,在低于500 ℃的温度下得到了357.6 μmol/g的CH4产量。CO2和H2O的共同裂解更有优势,可以提供一种长期的替代燃料生产类型,同时允许单独的H2O和CO2转换,因而具有更高的太阳能-燃料转换效率和产品质量[60-63]。更高的CO2进口摩尔分数(高达1.0)可以促进再氧化,而将H2O摩尔分数提高到0.5以上,也会通过引起更高的能量损耗来增加氧化程度[10,58,64-65]。MCDANIEL等[8]研究表明,在1 000~1 350 ℃氧化还原温度下使用(Mn,Sr)掺杂LaAlO3获得的H2产量是CeO2和其他先进材料的9倍,同时CO产量可提升5倍。(Mn,Sr)掺杂的LaAlO3是迄今为止报道的唯一能在1 000~1 350 ℃的多个循环中持续进行H2O和CO2裂解的氧化还原材料。所生产的燃料中的H2/CO比率与氧化物催化剂的反应性以及CO2和H2O裂解中的热力学氧化限制密切相关。
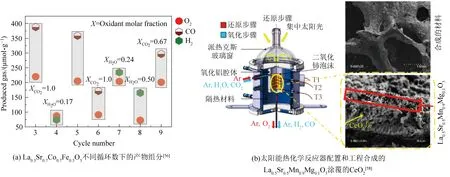
图5 反应条件对H2O辅助还原CO2产量的影响Fig. 5 Effect of reaction conditions on the yield of H2O-assisted CO2 catalytic splitting
如图6所示,通过控制氧化剂摩尔分数和与多孔材料结构特性相关的系统热性能[66-69]可超越H2O结合CO2裂解生产太阳能燃料的效率[64-65,70-72]。

图6 用实时集中太阳辐射加热的太阳能反应器的热化学特性[70,75-79]Fig. 6 Thermochemical properties of solar reactors heated by real-time concentrated solar radiation[70,75-79]
根据图7描述的热化学换热机制,热化学CO2再利用这一研究领域仍然面临着一些挑战。通过多尺度计算模型[73]和实验技术[23]更容易理解内在的反应机制和传输现象,表现出更高水平化学能量转换的材料可以在反应介质中保持其孔隙率,同时具有更高的热稳定性和更优的热回收特性。由于CeO2具有裂解CO2和H2O的氧化还原活性,其最高的CO和H2生产率为340 μmol/(g·min)和480 μmol/(g·min)[62],铈基氧载体仍然是工业规模合成市售太阳能燃料的参考氧化还原材料[9,27,74]。
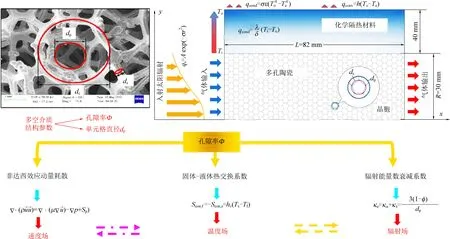
图7 泡沫填充的多孔陶瓷接收器的太阳能热转换机理描述Fig. 7 Solar thermal conversion mechanism of foam-filled porous ceramic receivers
3 氢辅助还原CO2
H2作为一种活性气体受到热化学领域研究学者的关注,因为它有望在相对较低的温度下加速热还原或直接将CO2化学转化为当前市场所需的低价产品[2,14,22,80],如甲醛(CH2O)[81]、甲醇(MeOH)[82-83]、轻烯烃[84-86]和CH4[12,14,87]。ROH等[81]开发了一个低成本和环境友好型工艺,可在250 ℃和70 bar的条件下,以Cu/ZnO/Al2O3为催化剂将CO2氢化(CO2+H2)成MeOH,在210 ℃和1 bar的反应条件下,O2在V2O5/TiO2/SiO2催化剂表面反应会直接形成CH2O,其低温CO2利用效率比传统工艺高93%。如图8(a)所示,将反应温度提高到300 ℃会导致Cu/ZnO/Al2O3催化剂的活性下降[88-89]。在75 mL/min的气体流量(20%CO2、60%H2和20%N2)、300 ℃和20 bar的条件下,ZnO在低温CO2+H2化学转化中的催化剂活性达到75.1%[90],在320 ℃和50 bar的条件下,H2∶CO2比例为3∶1时,可以通过添加ZrO2作为ZnO2纳米颗粒的载体提高催化剂活性。通过使用先进的催化剂,包括Cu/CuO-、ZrO2-和ZnO基混合氧化物固溶体,低温CO2与H2利用的有效性已得到证明[89,91-93]。然而,该系统依赖于H2,导致最终燃料中的H2成本约占总成本的95%[81]。

图8 低温下CO2氢化过程Fig. 8 CO2 hydrogenation at low temperature
基于H2的CO2化学转化的可靠性归功于多能源互补系统,如基于低碳足迹和无碳电力降低产品成本的附加太阳能H2生产系统[94]。这需要开发可再生混合系统,包括高温直接太阳能/电催化H2O裂解和/或CH4湿重整,然后由富含H2的下游供应CO2转化为具备市场竞争力的燃料[95-99],如图8(c)所示。异质催化剂成为有效的CO2到C1+或C2+燃料转化的适当催化剂,依靠H2和太阳能辐射能量流或其他动力供应,如电转气过程。这存在低成本、高催化剂稳定性和可靠性的技术经济前景。逆水煤气变换(RWGS)[86,100]反应机理的发展引起了人们的极大兴趣[101],RWGS提高了CO2转化为CO或CH4的转化率,并根据反应条件形成额外的H2O,如图8(d)所示。催化剂的活性和附加值产品,如CH4随反应温度变化的选择性,是与活性催化剂表面碳沉积抑制功能共同促进CO产量相关的基本挑战[102]。
Ni/Ga2O3催化剂[100]可以通过短暂存在的*HOCO分子提升RWGS对CO选择性,由于Ni催化剂在350~450 ℃时的高催化活性,会产生大量的*HCOO中间产物。La和Ce的催化活性使得La0.15Ce0.85O1.925表面的Ni催化剂极大提高了CH4的选择性,因为La3+和Ce4+缓解了CO解离和甲烷化而产生O空穴的速率[53]。Ni-Ce生物催化剂活性和Ni-O空穴-Ce位点是需要考虑的主要因素,通过暴露介质中的Ni位点来提高RWGS中还原CO2和CH4的选择性[103]。催化剂活性和高选择性可能影响最终产品的产量和质量。CO2和H2活性位点的可用性以及CO2的热催化转化性能与催化剂的制备方法有着紧密的联系。HERACLEOUS等[104]报告指出,溶胶-凝胶自燃和开发Me/MexOy改性的沸石双功能催化系统[105],如ZrZnOx/H-ZSM-5[106]可能对通过CO2加氢合成甲醇反应体系更有利。基于H2/CO2/N2=6/2/1的原料气以及350 ℃、30 bar、速率为24 000 mL·h-1·g-1的反应条件下,重量比为1∶1的ZrZnOx/H-ZSM-5催化剂上得到了1.5 mol·kg-1·h-1C3+产物。二氧化碳加氢可以很容易地集成到二氧化碳捕集技术中,从而在Ni/Na-γ-Al2O3[107]上将大气浓度中400 ppm的二氧化碳进行催化转化,并获得160 μmol·gcat-1的CH4产量,以及71.6%的CH3OH的产物。在紫外-可见光下,CO2到CH4和CO的形成都是可能的途径[108],ZnO/CuO-NaAlSiO4上的H2O光催化分解产生62.33 μmol·g-1·h-1的H2,进一步加速了CO2光还原为907 μmol·g-1·h-1的HCOOH[109]。本文总结了低温下氢辅助还原CO2反应条件及产物组分,见表2,结果表明添加氢辅助能够生成除CO外的其他高热值燃料,并且催化剂种类及反应条件会极大的影响产物种类。因此,设计高性能的功能性催化剂以及能够进行这种复杂过程的热化学、电化学或光化学反应器仍是一项重要挑战。

表2 低温CO2氢化催化剂及产物
4 总结与展望
清洁燃料([H2+CO]、CH4、MeOH和C2+)产量的显著提升,证明了技术经济可行性和面向工业化的有效技术准备。本文对H2、CH4、H2O辅助CO2还原以及DRM转化过程予以分析,证明了提升CO2转化效率的常见方式。就阿伦尼乌斯动力学模型而言,在合成活性材料时减小活化能可有效提升燃料产量。此外,氧化动力学在后期一般分为基于反应级数的反应速率和扩散驱动的反应过程。将二氧化碳原料与其他活性气体(如CH4和H2O)相结合,可在较温和的操作条件下提供具有较大转化动力学和更多的热力学有利条件,以促进包括(H2+CO)、CH3OH和CH3COOH等长链可燃原料的合成,并且通过适宜的纳米复合材料掺杂设计策略,能够克服一定的热力学限制以极大的提升合成气产量。
中间原子产物H和C的过度形成主要与氧缺陷材料的氧化还原活性有关。基于Mars-van Krevelen反应机制,摩尔比为0.7的Ni-Fe和Fe/Ni协同催化剂活性对焦炭沉积和合成气产量有重大影响。K、Na、Cs和Mn是Ni/ZrO2催化剂的适当掺杂物,可用于提高焦炭DRM合成的选择性。在1 650 ℃下,La0.5Sr0.5MnO3+δ上的等温催化CO2和H2O分解活性表现出迄今为止的最高理论太阳能燃料转化效率(28%)。通过更改催化剂材料元素构成可以降低反应所需温度,并且实现不同温度下不同产物的高产率。
二氧化碳加氢反应体系可能是一种有前途的方式,可在非常低的温度下进行,并具有更高的燃料(甲醛、MeOH、轻烯烃和CH4)产量。然而,H2供应占最终可用燃料总成本的95%,这依赖于多能源互补的H2生成技术的发展,如太阳能驱动H2O分馏和蒸汽CH4重整。因此,有效的利用辅助气可以提升太阳能燃料转化过程中的系统效率。然而,如何设计开发在不同反应条件下都具备较强的热力学与动力学性能的催化剂材料仍有待研究,辅助气参与化学反应的机理仍有待厘清,系统流程工艺仍有待简化。解决上述瓶颈问题进而推动太阳能热化学催化裂解燃料制备技术大规模工业化应用对达成“双碳”目标有着重要的战略意义。
