小鼠蓝斑内投射至脊髓背角的去甲肾上腺素能神经元的突触前神经元在全脑的分布情况
2023-12-01王欣瑶张浚睿李云鹏口颌系统重建与再生全国重点实验室国家口腔疾病临床医学研究中心陕西省口腔疾病临床医学研究中心空军军医大学口腔医院颌面外科陕西西安700空军军医大学口腔医院护理处陕西西安700空军军医大学唐都医院麻醉科陕西西安7008
王欣瑶,薛 茹,彭 莉,张浚睿,李云鹏,刘 蕊,张 谅 (口颌系统重建与再生全国重点实验室,国家口腔疾病临床医学研究中心,陕西省口腔疾病临床医学研究中心,空军军医大学口腔医院颌面外科,陕西 西安 700;空军军医大学口腔医院护理处,陕西 西安 700;空军军医大学唐都医院麻醉科,陕西 西安 7008)
蓝斑(locus coeruleus,LC)位于脑桥吻侧背部,毗邻第四脑室,是中枢神经系统内合成去甲肾上腺素(norepinephrine,NE)的主要部位[1]。LC内的大多数NE能神经元是大的多极着色细胞,胞体为圆形或椭圆形,直径在35~45 μm之间,有多个长树突和轴突[2-3]。既往研究表明,LC向大脑的丘脑、杏仁核、海马和前额叶皮质等部位发出广泛的上行投射,此外还向脊髓发出下行投射,因此LC参与了一系列的行为调节过程,比如睡眠/觉醒状态,记忆与认知等[4-5]。近来还有研究发现,LC内的NE能神经元在疼痛和应激的共病过程中发挥着重要的作用[6]。
脊髓背角(spinal dorsal horn,SDH)是感觉信息整合的初级中枢。来自外周的躯体感觉信息被传递到SDH,经由SDH的神经环路加工处理后再传递到laminaⅠ层的投射神经元。而LC-SDH NE能通路作为最重要的疼痛抑制通路之一[7-8],参与了包括神经病理性痛在内的疼痛调控过程[9]。LC向SDH发出下行投射纤维,释放NE从而抑制疼痛信号向中枢神经系统的传递。但该通路对生理性疼痛无明显抑制作用,但在病理条件下,向SDH释放的NE增加,可显著抑制病理性疼痛的传递[10]。例如,电刺激LC可有效缓解神经病理性痛,而鞘内α2受体拮抗剂可逆转这一作用[11]。α2受体激动剂可乐定能减轻神经病理性痛患者的疼痛程度,并通过激活LC神经元增强LC-SDH下行通路[12]。值得注意的是,HIRSCHBERG等[9]发现,在神经病理性痛大鼠中,LC上行和下行通路的激活会产生相反的效果,而激活LC-SDH下行通路可以减轻疼痛并诱导条件位置偏好,这说明LC-SDH下行通路可能参与到了疼痛以及疼痛与情绪共病的过程中。而关于LC-SDH通路的上游核团研究较少。
本研究利用TH-Cre转基因小鼠(标记LC内NE能神经元),在其LC处注射辅助病毒,两周后在SDH处注射狂犬病毒(rabies virus,RV),从而研究LC-SDH通路的上游核团在全脑的分布情况,进而初步了解机体调节LC-SDH通路功能的潜在机制。
1 材料与方法
1.1 材料
实验动物:TH-Cre雄性小鼠3只,体质量22~25 g。小鼠在25 ℃左右的恒温环境下饲养,且能够自由获得所需的清洁食物和水,饲养环境遵循12 h昼/12 h夜规律。所有实验流程均得到空军军医大学实验动物福利与伦理委员会批准后进行(许可证号:SCXK2019-001)。
实验仪器:逆行跨单突触RV系统(BC-0064,BC-0304和BC-RV-EnvA844,布林凯斯,深圳);脑立体定位仪(69110,瑞沃德,深圳);CM1950型恒冷切片机(徕卡,德国);玻璃微电极注射泵(R-480,瑞沃德,深圳);FV1000型激光共聚焦显微镜(奥林巴斯,日本)。
1.2 方法
1.2.1 病毒准备 逆行跨单突触RV系统包括重组RV和二联辅助病毒。重组RV为RV-EnvA-△G-mCherry,二联辅助病毒为rAAV-EF1α-DIO-EYFP-T2A-TVA和rAAV-EF1α-DIO-N2cG。二联辅助病毒按照1∶1均匀混合。
1.2.2 麻醉 将70 g/L水合氯醛(40 mg/kg)注射入小鼠腹膜腔进行麻醉,待小鼠充分麻醉后进行下一步操作。
1.2.3 脑立体定位仪 将麻醉后的小鼠固定至脑立体定位仪上,调整定位仪使小鼠颅骨呈水平状态。将玻璃微电极注射泵固定于脑立体定位仪的夹持器上。根据LC的三维坐标(前囟点往后5.42 mm,中线偏右0.88 mm,深度4.00 mm)钻开小鼠颅骨,吸取二联辅助病毒100 nL后,将玻璃电极缓慢插入到LC所在深度。以10 nL/min的速度注射,注射完成后留针10 min。第14日后再用同样的方法将100 nL重组RV注射到SDH处。7 d后将小鼠灌注取脑。
1.2.4 灌注与取材 将70 g/L水合氯醛(60 mg/kg)注射入小鼠腹膜腔进行麻醉后,暴露出小鼠的心脏。将灌注针插入至小鼠左心室后用50 mL的0.01 mol/L PBS进行冲血,待血冲净后,再用150 mL的40 g/L多聚甲醛磷酸缓冲液进行灌注。灌注完成后,将小鼠大脑取出后置于混有30%蔗糖的0.1 mol/L磷酸缓冲液中48 h。
1.2.5 包埋与切片 从吻侧向尾侧进行切片,切片厚度为30 μm,将切片按照顺序置于盛有0.01 mol/L PBS的六孔板中。之后将切片用0.01 mol/L PBS漂洗3次,每次10 min。取一套脑片,在避光环境下,将脑片按照从吻侧到尾侧的顺序依次裱于载玻片上,用荧光分片剂进行封片后观察突触前神经元在全脑的分布情况。
1.2.6 信息采集 将切片在FV1000型激光共聚焦显微镜下进行观察,并将图像利用FluoView Software(FV10-ASW 1.7,奥林巴斯,日本)进行采集和保存。

2 结果
2.1 逆行跨单突触RV注射区
将二联辅助病毒注射至TH-Cre小鼠的LC处(图1A),可见LC内的NE能神经元表达绿色荧光。因为二联的两种辅助病毒均为Cre依赖的腺病毒,所以表达绿色荧光的均为NE能神经元(图1B)。且两种辅助病毒均为2/9型腺病毒,其感染神经元胞体后能延轴突顺行标记出神经末梢,故在SDH处有其标记的神经末梢。2周后将重组RV注射入SDH处,RV能与被SDH标记的神经末梢结合,之后逆行到LC处。故在LC处看到表达红色荧光的神经元均为投射到SDH的神经元(图1C)。在LC处红色和绿色双标的神经元才具有逆行跨单突触的能力,即为起始神经元(图1D)。此外,在LC附近区域可看到表达红色荧光的神经元,这些神经元与LC内的NE能神经元形成了微环路,提示这些神经元可能参与了对LC内NE能神经元的局部调控。
2.2 LC内投射到SDH的NE能神经元的突触前神经元在全脑的分布情况
将二联辅助病毒注射至TH-Cre小鼠的LC处两周后,将重组RV注射至小鼠的SDH,可在全脑的不同层面观察到RV阳性的带红色荧光的阳性神经元在各个核团的分布情况,说明这些核团与LC-SDH通路形成突触联系,即这些阳性神经元是投射到SDH的LC内的NE能神经元的突触前神经元。通过激光共聚焦显微镜可以观察到在次级运动皮层(secondary motor cortex,M2)、杏仁中央核(central nucleus of the amygdala,CeA)、中脑导水管周围灰质外侧区(lateral periaqueductal gray,lPAG)、中脑导水管腹外侧区(ventrolateral periaqueductal gray,vlPAG)、中缝背核(dorsal raphe,DR)和巨细胞网状核(gigantocellular reticular nucleus,Gi)等核团内存在密集分布的RV阳性的带红色荧光的神经元(图2)。
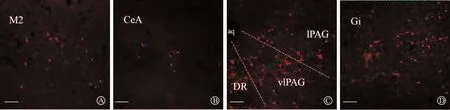
A:M2中RV阳性神经元;B:CeA中RV阳性神经元;C:lPAG,vlPAG和DR中RV阳性神经元;D:Gi中RV阳性神经元。标尺为100 μm,n=3。M2:次级运动皮层;CeA:杏仁中央核;lPAG:中脑导水管周围灰质外侧区;vlPAG:中脑导水管腹外侧区;DR:中缝背核;Gi:巨细胞网状核;RV:狂犬病毒。图2 RV阳性神经元在全脑的分布情况
2.3 LC内投射到SDH的NE能神经元的突触前神经元在全脑各核团分布的形态及分布特点
利用逆行跨单突触RV系统,可以在脑内的M2、CeA、lPAG、vlPAG、DR和Gi等核团内存在密集分布的RV阳性的带红色荧光的神经元,从形态上观察这些神经元发现,在M2和CeA内分布的RV阳性神经元以圆形为主(图2A~B),而在lPAG、vlPAG、DR和Gi等核团内分布的RV阳性神经元以多极状为主(图2C~D)。从分布特点上看,RV阳性神经元主要分布在导水管灰质(lPAG和vlPAG)以及Gi,而较少分布在CeA(图3)。

A:全脑各核团RV阳性神经元的数量;B:RV阳性神经元在全脑各核团的分布百分比。M2:次级运动皮层;CeA:杏仁中央核;lPAG:中脑导水管周围灰质外侧区;vlPAG:中脑导水管腹外侧区;DR:中缝背核;Gi:巨细胞网状核;RV:狂犬病毒。图3 RV阳性神经元在全脑各核团的分布统计情况
3 讨论
本实验通过在TH-Cre小鼠的LC处注入逆行跨单突触RV系统的二联辅助病毒,再向该小鼠的SDH处注入重组RV,研究LC内投射到SDH的NE能神经元的突触前神经元在全脑的分布情况,发现脑内的M2、CeA、lPAG、vlPAG、DR和Gi等核团内观察到RV阳性的神经元,说明这些核团与LC-SDH通路构成了三级通路。
RV由于其只能感染神经元,而无法感染胶质细胞的特点,使其成为研究神经通路的有力工具[13]。包膜糖蛋白位于RV表面,是RV具备逆向跨突触能力的必需蛋白。而本研究中使用的糖蛋白缺失毒株则因为没有包膜糖蛋白而无法逆向跨突触,只能在本级神经元中表达复制,但是若在本级神经元中给予外源性糖蛋白,则该毒株就具备了逆向跨突触的能力[13],但由于上级神经元中无外源性糖蛋白,所以该毒株只能逆向跨单突触而无法跨多突触,所以该系统可以对突触前神经元进行研究。此外,由于使用了Cre-Loxp系统对二联辅助病毒进行了改造,使其只能在特定类型神经元进行表达,进而通过使用表达Cre重组酶的转基因动物,可以实现二联辅助病毒只能感染特定类型神经元。二联辅助病毒感染特定类型神经元后,可以使得该类型神经元表达TVA和外源性糖蛋白。两周后当辅助病毒在转基因小鼠脑内LC表达到足够丰度时,向该小鼠SDH注入糖蛋白缺失RV毒株,由于LC向SDH投射的神经元末梢表达TVA,此时RV能特异性感染末梢表达TVA的神经元,并向上逆行到LC处,且被感染的该级神经元也同时表达外源性糖蛋白,所以可以帮助RV逆行跨单突触。在本研究可以观察到LC-SDH通路的上游核团,从而观察分析出了一系列三级传导通路。
NE能下行镇痛系统起源于脑干内分泌NE的核团,主要为LC。LC内的神经元主要为NE能神经元,NE能神经元发出下行投射纤维到SDH处,从而释放NE抑制痛觉信息的上传[14]。该通路对生理性疼痛无明显抑制作用,但在病理条件下,LC向SDH释放的NE增加,可显著抑制病理性疼痛的上传[10]。既往大量的研究观察到,LC参与到了急性应激、炎症、神经损伤以及疼痛的负反馈抑制过程中[15-17]。因此,对LC进行损毁或者其他方法抑制其神经元活性可以加重急性疼痛,说明当LC-NE系统被破坏时机体对疼痛的敏感性增强[18-21]。不仅是急性疼痛,LC-SDH通路还参与到了慢性疼痛比如神经病理性痛的过程中,有研究表明,神经病理性痛会引起LC内NE能神经元活性的下降[22],而激活LC-SDH通路可以缓解神经病理性痛[23]。不仅如此,治疗神经病理性痛的一线药物加巴喷丁和普瑞巴林,其治疗神经病理性痛的机制可能都与LC-SDH下行镇痛通路有关[24-25]。所以可见LC-SDH下行镇痛通路是治疗多种类型疼痛的潜在靶点。而本研究发现脑内M2、CeA、lPAG、vlPAG、DR和Gi等核团是LC-SDH下行镇痛通路的上游核团。既往有研究发现初级运动皮层可以发出下行投射参与机体镇痛过程[26],但对于M2是否参与镇痛过程尚不清楚,本研究为M2与疼痛的潜在联系提供了启示。作为边缘系统的组成部分,有研究证实杏仁核尤其是CeA接收单纯伤害性信息[27],并参与疼痛的感知与调节[28-29]。还有研究观察到杏仁核参与到了情绪、情绪评价、情绪的学习和记忆以及情感紊乱如焦虑和抑郁的过程[30-34]。本研究观察到CeA与LC-SDH下行镇痛通路形成了三级通路,说明CeA可能通过该通路参与了疼痛以及疼痛与情绪共病过程的调节。导水管周围灰质是哺乳动物下行痛觉信息调控系统的重要组成部分,本研究观察到导水管周围灰质与LC-SDH下行镇痛通路形成了三级通路,提示了导水管周围灰质可能通过该通路参与到了痛觉信息的调控过程。而DR和Gi与疼痛的关系尚不清楚,本研究为这两个核团与疼痛的潜在关系提供了启发。
