急性呼吸窘迫综合征患者血清α1-抗胰凝乳蛋白酶和α1-抗胰蛋白酶表达水平及临床意义
2023-12-01余海波
余海波,孟 莉,彭 飞,沈 杨
(1.四川绵阳四〇四医院急诊医学科,四川绵阳 621000;2.成都市第七人民医院急诊医学科,成都 610000;3.达州市中西医结合医院急诊医学科,四川达州 635000;4.绵阳富临医院儿科,四川绵阳 621000)
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是常见的一种由多种肺内外因素引发的严重肺部功能障碍性疾病,发病迅速,进展极快,临床常伴有急性呼吸衰竭、顽固性低氧血症等症状[1-2]。据报道,重症监护室(intensive care unit,ICU)中ARDS轻症发生率高达78.5%,重症发生率高达51.3%,国外病死率高达38.5%,国内病死率高达21.3%,一旦发病会给患者的生命与健康造成严重威胁[3-4],故探讨影响和评估ARDS患者预后的因素并据此为患者提供针对性治疗非常必要。α1-抗胰凝乳蛋白酶(alpha-1-antichymotrypsin,AACT)是一种在心、肾、脾、肺等多种组织中广泛表达的促炎因子,在重度哮喘患者中的表达水平明显上升[5-6]。α1-抗胰蛋白酶(alpha-1-antitrypsin,AAT)是一种具有抑制中性粒细胞弹性蛋白酶、抗炎、免疫调节等作用的丝氨酸蛋白酶抑制剂,可参与多种炎症性疾病的发展[7]。王雪婷等[8]发现,AAT在ARDS大鼠机械通气肺损伤中可发挥治疗作用。然而,AACT和AAT在ARDS患者中的表达情况如何以及二者与患者预后是否相关却未见报道。鉴于此,本研究特对84例ARDS患者血清AACT和AAT表达情况及二者与患者预后之间的关系进行了分析,以期为ARDS患者预后改善提供指导。
1 材料与方法
1.1 研究对象 选取2019年1月~2022年12月四川绵阳四〇四医院收治的84例ARDS患者作为疾病组,男性52例,女性32例;年龄24~79(55.25±10.74)岁;体质量指数(body mass index,BMI)18.76~28.57(23.32±3.19)kg/m2。自患者入院第二天起进行为期30天的随访观察,时间截止至2023年1月,随访结束时统计患者的生存情况。依据随访结果将ARDS患者分为生存组(n=51)和死亡组(n=33)。另选取同时期在四川绵阳四〇四医院进行体检的84例健康人作为对照组,男性53例,女性31例;年龄23~81(55.75±10.91)岁;BMI 18.64~28.51(23.28±3.22)kg/m2。二组患者性别、年龄、BMI对比差异均无统计学意义(χ2/t=0.025,0.299,0.081,P>0.05)。本研究经四川绵阳四〇四医院伦理委员会审核、批准。
纳入标准:①均符合《急性肺损伤/ARDS诊断与治疗指南2006》[9]中ARDS的诊断标准;②入住ICU的时间不少于3天;③年龄大于18岁;④对本研究知情同意。排除标准:①其他类型的急性肺疾病、肺动脉栓塞患者;②慢阻肺、肺心病、支气管哮喘等严重慢性肺部疾病患者;③并发自身免疫系统、血液系统疾病;④并发恶性肿瘤患者;⑤并发心、肝、肾等其他重要脏器严重疾病者;⑥有长期糖皮质激素使用史的患者;⑦近三个月内进行过重大外科手术。
1.2 仪器与试剂 AACT,AAT酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)试剂盒(南京万木春生物科技有限公司),DENIEY DRAGON Wellscan MK3型酶标仪(芬兰Thermo)
1.3 方法
1.3.1 样本采集:抽取患者肘静脉血5ml,室温放置2h后3 000r/min离心15min,分离血清,-80℃超低温储存备用。
1.3.2 AACT,AAT表达检测:采用ELISA试剂盒测定血清AACT,AAT的表达水平,采用DENIEY DRAGON Wellscan MK3型酶标仪分析血清AACT与AAT含量,具体操作严格按照试剂说明进行。
1.3.3 一般资料收集:包括吸烟史、饮酒史、并发高血压、高血糖、心脏病、下呼吸道感染、使用血管活性物质、免疫抑制药物情况、发病至治疗时长、初始呼气末正压、氧合指数(oxygenation index,OI)、急性生理与慢性健康评分II(acute physiological and chronic health evaluation II,APACHE II)、有创机械通气时间和血清降钙素原(pro calcitonin,PCT)。
1.4 统计学分析 以SPSS25.0软件分析本研究中统计学数据。计量数据均满足正态分布,以均数±标准差(±s)表示,独立样本t检验比较两组间差异;计数资料以n(%)表示,χ2检验比较组间差异;采用Kaplan-Meier生存曲线分析ARDS患者血清AACT,AAT表达水平与30天生存率的关系;COX回归分析导致ARDS患者30天死亡的影响因素;受试者工作特征(receiver operating characteristic,ROC)曲线分析血清AACT,AAT对ARDS患者预后不良的预测效能。P<0.05为差异有统计学意义。
2 结果
2.1 生存组与死亡组ARDS患者一般资料对比 见表1。死亡组患者年龄≥60岁、并发下呼吸道感染、使用血管活性物质、免疫抑制药物患者占比及发病至治疗时长、APACHE II评分、血清PCT,AACT,AAT水平均高于生存组患者,差异有统计学意义(均P<0.05);OI,有创机械通气时间均低于生存组患者,差异有统计学意义(均P<0.05)。但两组的性别、BMI,吸烟史、饮酒史、并发高血压、高血糖、心脏病患者的占比、初始呼气末正压对比,差异均无统计学意义(均P>0.05)。
表1 生存组与死亡组ARDS患者一般资料对比[±s,n(%)]
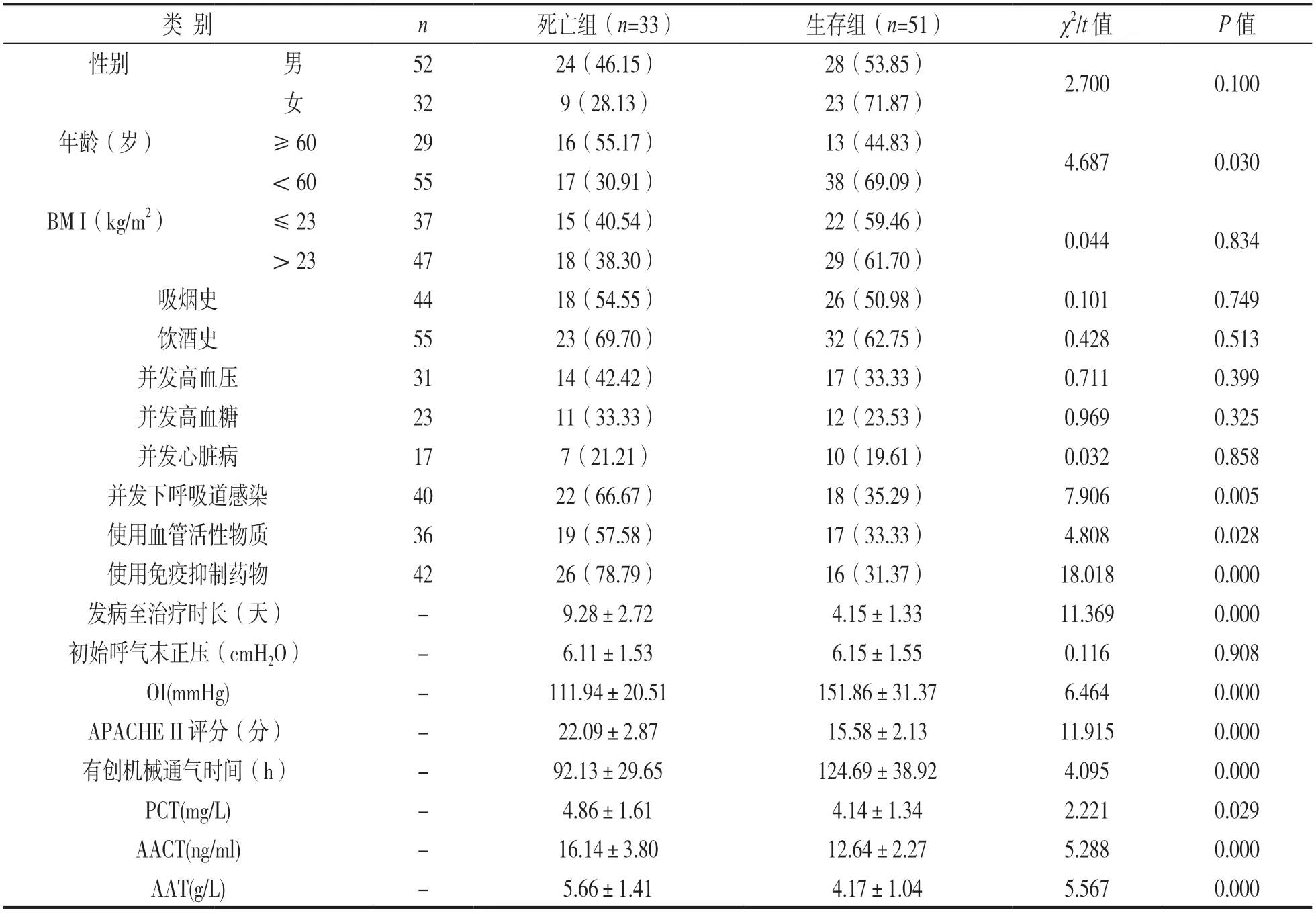
表1 生存组与死亡组ARDS患者一般资料对比[±s,n(%)]
类 别n死亡组(n=33)生存组(n=51)χ2/t值P值性别男5224(46.15)28(53.85)2.7000.100女329(28.13)23(71.87)年龄(岁)≥602916(55.17)13(44.83)4.6870.030<605517(30.91)38(69.09)BM I(kg/m2)≤233715(40.54)22(59.46)0.0440.834>234718(38.30)29(61.70)吸烟史4418(54.55)26(50.98)0.1010.749饮酒史5523(69.70)32(62.75)0.4280.513并发高血压3114(42.42)17(33.33)0.7110.399并发高血糖2311(33.33)12(23.53)0.9690.325并发心脏病177(21.21)10(19.61)0.0320.858并发下呼吸道感染4022(66.67)18(35.29)7.9060.005使用血管活性物质3619(57.58)17(33.33)4.8080.028使用免疫抑制药物4226(78.79)16(31.37)18.0180.000发病至治疗时长(天)-9.28±2.724.15±1.3311.3690.000初始呼气末正压(cmH2O)-6.11±1.536.15±1.550.1160.908 OI(mmHg)-111.94±20.51151.86±31.376.4640.000 APACHE II评分(分)-22.09±2.8715.58±2.1311.9150.000有创机械通气时间(h)-92.13±29.65124.69±38.924.0950.000 PCT(mg/L)-4.86±1.614.14±1.342.2210.029 AACT(ng/ml)-16.14±3.8012.64±2.275.2880.000 AAT(g/L)-5.66±1.414.17±1.045.5670.000
2.2 疾病组与对照组血清AACT,AAT表达水平比较 疾病组血清AACT(14.02±2.87 ng/ml),AAT(4.76±1.19 g/L)表达水平均高于对照组(9.56±2.11 ng/ml,2.92±0.24 g/L),差异有统计学意义(t= 11.475,13.892,均P<0.05)。
2.3 ARDS患者血清AACT,AAT表达与患者30天生存情况的关系分析 见图1。以血清AACT,AAT水平均数为界值,将ARDS患者分为AACT高表达组(≥14.02ng/ml,n=45)与AACT低表达组(<14.02ng/ml,n=39)、AAT高表达组(≥4.76g/L,n=41)与AAT低表达组(<4.76g/L,n=43)。其中,AACT与ATT高表达组生存率[40.00%(18/45),39.02%(16/41)]均低于AACT与ATT低表达组生存率[84.62%(33/39),81.40%(35/43)],差异具有统计学意义(χ2=17.436,15.797,均P<0.001)。
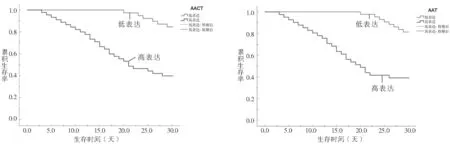
图1 血清AACT,AAT表达与ARDS患者30天生存情况的关系
2.4 COX回归分析ARDS患者30天死亡的危险因素 见表2。84例ARDS患者随访30天生存51例,死亡33例,死亡率为39.29%(33/84)。以年龄(<60岁=0,≥60岁=1)、并发下呼吸道感染(否=0,是=1)、使用血管活性物质(否=0,是=1)、使用免疫抑制药物(否=0,是=1)、发病至治疗时长(实测值)、OI(实测值)、APACHE II评分(实测值)、有创机械通气时间(实测值)、PCT(实测值)、AACT(实测值)和AAT(实测值)为自变量,以ARDS患者30天生存情况为因变量(生存=0,死亡=1),进行COX回归分析。单因素COX分析显示,患者年龄、并发下呼吸道感染、使用血管活性物质、免疫抑制药物、发病至治疗时长、OI,APACHE II评分、有创机械通气时间、血清PCT,AACT,AAT水平均为ARDS患者30天死亡的影响因素(均P<0.05);多因素COX回归分析结果表明,并发下呼吸道感染、使用血管活性物质、免疫抑制药物、发病至治疗时长、APACHE II评分、血清AACT,AAT水平均为ARDS患者30天死亡的危险因素,OI,有创机械通气时间为保护因素(均P<0.05)。

表2 COX回归分析ARDS患者30天生存情况的影响因素
2.5 血清AACT,AAT表达水平对ARDS患者预后的预测效能 见表3,图2。ROC分析结果显示,血清AACT,AAT水平联合预测ARDS患者预后不良的ROC曲线下面积(area under curve,AUC)高于单独预测的AUC,差异具有统计学意义(Z=2.456,2.466,均P<0.05)。

图2 血清AACT,AAT水平预测ARDS患者预后的ROC曲线
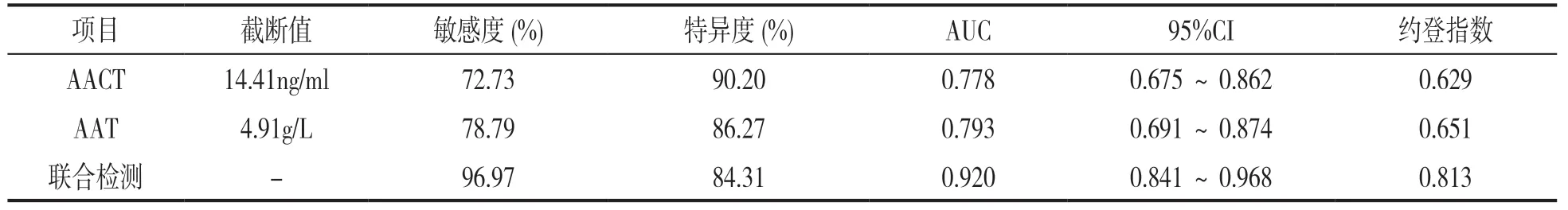
表3 血清AACT,AAT水平对ARDS患者预后不良的预测
3 讨论
急性呼吸窘迫综合征(ARDS)是指急性弥漫性肺损伤及肺损伤进展导致的急性呼吸功能不全或呼吸衰竭,主要病理特征为肺部的顺应性与容量下降,具有极高的发病率和致死率,严重危害患者的生命与健康。ARDS的发病原因繁多复杂,发病机制目前尚未明确,但有研究认为全身性炎症是ARDS病发的根本原因。全身炎症主要是由严重创伤、感染等因素引起,其可介导多种炎性介质的过度释放,对肺部造成一定程度的损伤,导致肺功能下降,进一步诱发ARDS[10-11]。故筛选与ARDS发病和预后相关的血清炎性指标对疾病的诊治和预后改善具有重大意义。
α1-抗胰凝乳蛋白酶(AACT)和α1-抗胰蛋白酶(AAT)均是常见的蛋白酶抑制因子,具有类似的作用,均可通过中和胰糜蛋白酶、弹力酶等酶的活性参与到炎性反应中;AACT与AAT在急性炎症发生时分泌量增加,可通过抑制蛋白分解保护蛋白完整性,缓解炎症反应引起的组织损伤。既往研究表明,AACT是一种由14q32.1基因位点编码、由408~445个氨基酸构成的分子量约为55~66kd的蛋白类物质,可通过与靶酶结合破坏靶酶水解作用,发挥抑制弹性蛋白酶、颗粒酶等多种生物酶活性的作用,其表达与急性炎症反应密切相关[12]。有研究表示,AACT可通过调控组织蛋白酶G与糜蛋白酶的活性参与到肺组织炎症过程中。组织蛋白酶G与糜蛋白酶可有效促进白细胞介素-1β等促炎因子的分解,降低促炎因子水平,发挥抗炎效果,而AACT可靶向抑制组织蛋白酶G与糜蛋白酶的活性,抑制其抗炎作用,发挥出促炎功效[13]。KIM等[14]表示AACT的表达与分泌可影响血脑屏障转导的炎症反应,AACT可通过调控炎性标志物GlycA的表达参与到感染、损伤等因素引发的慢性炎症性疾病中。LJUNGGREN等[15]表示牙周炎患者血浆中AACT的表达水平明显上调。SHAHINIAN等[16]表示,AACT是一种由白细胞衍生的促炎细胞因子,属于丝氨酸蛋白酶抑制剂,其水平会因组织损伤或炎症刺激而快速升高,进而介导蛋白过度水解导致的组织损伤。结合本研究发现ARDS患者血清AACT水平高于健康人员,且AACT高表达患者的生存率低于低表达患者,推测ARDS患者的AACT因为炎性刺激和肺部损伤而大量表达,同时其高表达通过抑制抗炎因子活性与促进促炎因子表达的途径参与到ARDS患者的全身性炎症反应中,增加肺损伤,发挥促炎功效。两种作用互相促进致使ARDS患者血清AACT水平明显升高,病情加重,预后变差。
有研究表示,AAT是一种典型的抗蛋白酶,是维持抗蛋白酶-蛋白酶平衡中一种重要的急性时相蛋白,具有抗炎、抗细胞凋亡、抗氧化应激、缓解上皮与内皮损伤的作用,可参与全身免疫炎性反应[17-18]。董新颖等[19]表示,慢阻肺患者痰中中性粒细胞弹性蛋白酶(neutrophil elastase,NE)水平会明显上升,AAT通过抑制NE发挥抗炎、抗感染的作用,慢阻肺患者的血清AAT水平较健康人升高。王利公等[20]表明,血清AAT与NE水平正相关,炎症状态下NE含量升高会刺激肝脏合成分泌更多AAT以维持机体抗蛋白酶-蛋白酶平衡系统。王雪婷等[8]表示,AAT可改善肺泡毛细血管通透性进而提升肺部的换气功能,缓解肺部炎症反应,抑制ARDS大鼠的肺部损伤。张力等[21]表示,AAT是主要由肝脏细胞合成的胰蛋白酶抑制剂,其可抑制血浆蛋白酶过度活化导致的组织损伤,在急性期肺部疾病患者中的表达上升,在此过程发挥显著的抗炎作用。结合本研究发现ARDS患者血清AAT水平高于健康人员,与既往报道的结果一致,且高表达患者的生存率低于低表达患者,推测可能由于ARDS患者发生全身性炎症反应导致NE水平上升,同时ARDS患者的肺部损伤与炎症反应会导致机体产生应激反应,合成更多的AAT来改善肺功能,缓解其损伤引发的炎症反应,故AAT的合成释放量增加,浓度上涨;同时AAT水平越高,表明患者的炎症反应越严重,故预后越差。但张力等[21]发现在慢阻肺并发支气管扩张患者中AAT的表达水平下调。张苗等[22]发现牙龈炎患者血清AAT水平较健康人员下降。张珊等[23]发现,AAT在早产脑白质损伤患儿中的表达水平下调。AAT是一种广谱蛋白酶抑制剂,多种蛋白酶可激活神经系统中广泛存在的蛋白酶受体,参与神经损伤进程,而AAT含量上升可抑制炎症细胞迁移浸润,缓解大鼠的脑损伤,保护神经功能。本研究结果与其不一致,推测炎症的异质性对AAT表达水平产生的影响不同,AAT在不同疾病中的表达机理有所不同。
本研究发现,血清AACT,AAT水平联合预测ARDS患者预后的敏感度(96.97%)与AUC(0.920)均明显高于单独预测,提示血清AACT,AAT水平联合预测ARDS患者预后的效能更好。王庆妹等[24]采用外周血核细胞miR-492,miR-155水平与新生儿急性生理学评分围产期补充II评分(score for neonatal acute physiology perinatal extension,SNAPPE-II)三项联合预测儿童ARDS患者预后的灵敏度与AUC分别为94.53%与0.928,本研究预测效能与其相当,提示血清AACT,AAT水平联合有望作为ARDS患者预后评估的辅助生物学指标。本研究显示,并发下呼吸道感染、使用血管活性物质、免疫抑制药物、发病至治疗时长、APACHE II评分、血清AACT,AAT水平均为ARDS患者30天死亡的危险因素;OI,有创机械通气时间为保护因素,此结果与既往研究结果一致[25-26],提示临床应加大对ARDS患者血清AACT,AAT水平的检测力度,增加对其中并发下呼吸道感染、使用血管活性物质和免疫抑制药物进行治疗、APACHE II评分、血清AACT与AAT水平偏高患者的关注度,并及早实施针对性治疗,同时延长机械通气时间,保证患者的OI处于较高的水平,以期提升临床疗效,提升患者的生存率。
综上所述,ARDS患者血清AACT,AAT均高表达,二者与ARDS患者生存情况相关,均为患者预后不良的危险因素,有望作为预测ARDS预后的辅助指标。本研究通过血清炎症指标预测ARDS患者的短期预后,操作性强,稳定性好,预测效能好,具有较好的推广性。但本研究仍然存在一定的局限性,本研究选择的样本数量偏少,且未对AACT,AAT参与ARDS的具体机制进行深入分析探讨,还需后期进行进一步的研究。
