基于重组酶介导等温扩增技术建立人腺病毒14型快速检测方法及初步应用评价
2023-12-01刘晴晴王宁宁周华君车飞虎杨春利孙青阳戴玉柱张英杰蚌埠医学院检验医学院安徽蚌埠33000中国人民解放军联勤保障部队第九三医院临床研究部杭州3003
刘晴晴,王宁宁,成 军,周华君,车飞虎,杨春利,孙青阳,王 月,戴玉柱,张英杰(.蚌埠医学院检验医学院,安徽蚌埠 33000;.中国人民解放军联勤保障部队第九〇三医院临床研究部,杭州 3003)
人腺病毒(human adenovirus,HAdV)是无包膜双链DNA病毒,可引起各种临床疾病,包括呼吸道感染、肺炎、结膜炎等[1-3]。据报道,至少5%~ 10%的儿童和1%~7%的成人呼吸道感染是由HAdV导致的[4-6]。2005年起人腺病毒14型(human adenovirus serotypes 14,HAdV-14)病毒已在多国导致数次大规模急性呼吸道感染疫情,引起了病毒学、流行病学、传染病学等领域专家的广泛关注[7]。因此,开发快速、灵敏、特异的HAdV-14诊断方法,及时诊断HAdV-14,对于控制HAdV-14感染扩散和传播至关重要。随着分子诊断技术的发展,聚合酶链式反应(polymerase chain reaction,PCR)、实时荧光PCR等分子诊断技术已经成为检测HAdV感染的常用工具[8-11],但因其需要热循环仪难以在医疗资源相对有限的地区和医院实现。相比之下,重组酶介导的等温扩增技术(recombinase-aided amplification,RAA)是一种新型的等温核酸扩增技术,不需要高温变性或低温退火的过程,反应简捷、快速、高效[12-16],已成功用于多种病原体的检测,如2019新型冠状病毒、呼吸道合胞病毒、肺炎克雷伯菌等[17-20]。因此,本研究针对HAdV-14的Hexon基因设计特异性引物和探针,将RAA与荧光探针相结合,拟建立一种快速实时荧光RAA测定法,为HAdV-14的临床诊断或现场评估提供新的方法。
1 材料和方法
1.1 研究对象 收集2017~2022年在中国人民解放军联勤保障部队第九〇三医院就诊的发热性呼吸综合征患者的50份咽拭子。纳入标准:①有发热或呼吸道感染的其他症状的住院患者;②符合急性呼吸道感染诊断标准;③实验室检测指标和临床信息完整;④进行咽拭子腺病毒核酸检测。经实时荧光PCR明确病原体,包括:5个HAdV-3阳性样本,1个HAdV-4阳性样本,5个HAdV-7阳性样本,1个HAdV-14阳性样本,1个HAdV-21阳性样本,5个HAdV-55阳性样本,10个甲型流感病毒阳性样本,10个2019新型冠状病毒阳性样本,10个呼吸道合胞病毒阳性样本,1个肺炎支原体阳性样本和1个肺炎链球菌阳性样本。样本均通过中国人民解放军联勤保障部队第九〇三医院医学伦理委员会审核[批准文号20230303/01/01/001]。
1.2 试剂与仪器 核酸提取或纯化试剂盒(圣湘生物科技股份有限公司),不同病原核酸检测试剂盒(PCR-荧光探针法,圣湘生物科技股份有限公司),RAA核酸扩增试剂盒(荧光法,江苏奇天基因生物科技有限公司),SYBR Green qPCR Mix荧光定量PCR试剂盒(Biosharp生物技术公司),ABI 7500荧光PCR仪(Applied Biostems公司),Natch 96核酸提取仪(圣湘生物科技股份有限公司)。
1.3 方法
1.3.1 引物探针的设计与合成:在NCBI(https://pubmed.ncbi.nlm.nih.gov/)的GenBank 数据库检索并下载HAdV常见亚型的hexon 基因序列,使用Jaview软件进行多序列比对,以HAdV-14亚型内保守亚型间特异的序列(GenBank: AY803294)为靶标,根据之前的研究中提到的RAA引物探针设计原则,使用Primer 6和Snap Gene设计引物和荧光探针[21-22]。本研究设计的引物和探针均由生工生物技术(上海)有限公司合成,引物探针序列见表1。

表1 用于检测HAdV-14的RAA引物和探针序列
1.3.2 阳性质粒标准品的构建:将筛选的HAdV-14(GenBank:AY803294)特异性保守序列片段连接到pUC 57载体上,构建HAdV-14阳性质粒标准品,该质粒由生工生物技术(上海)有限公司直接合成。使用Qubit 2.0荧光测定仪对上述质粒进行浓度测定,拷贝数计算公式如下:浓度(copies/μl)=[6.02×1023×浓度 (ng/μl)×10-9]/[DNA 长度(bp)×660]。将上述质粒从106,105,104,103,102,101copies/μl 进行梯度稀释,随后保存至-80℃冰箱备用。
1.3.3 样本核酸提取:从收集的咽拭子及HAdV-14阳性质粒标准品(人上皮细胞和HAdV-14阳性质粒构成的混合悬液)中取300μl,采用磁珠提取法提取核酸,具体操作严格按照试剂说明书进行,提取后的核酸-80℃保存,用于进一步检测和分析。
1.3.4 实时荧光RAA法的建立:构建RAA反应体系(50μl),在RAA含冻干粉的微型离心管中加入 25μl缓冲液VI,2.1μl正向引物(10μmol/L),2.1μl反向引物(10μmol/L),0.6μl(10μmol/L)探针,5μl的模板,12.7μl纯化水。为确保所有反应系统同时进行,最后将2.5μl乙酸镁加到管盖中,瞬时离心后启动扩增反应,立即置于ABI 7500型实时荧光定量PCR仪中进行荧光检测。荧光检测程序设置为:39℃或40℃或42℃ 30s,60个循环。
1.3.5 引物探针的筛选:①将设计的4组候选引物和1组探针进行组合,在相同反应体系及扩增条件下使用4组不同的引物探针组合进行RAA扩增,通过比较扩增曲线的阈值时间(threshold time,TT)来筛选最佳的引物探针组合。②熔解曲线分析:将SYBR Green qPCR Mix 荧光定量PCR试剂盒在室温下溶解并充分混匀,短暂离心后置于冰上,按照试剂盒说明书配制反应液,并根据说明书推荐两步法PCR程序进行反应。将设计的1个上游引物和4个下游引物进行组合,在相同反应体系及扩增条件下使用4组不同的引物组合进行熔解曲线分析。
1.3.6 反应条件的优化:将相同反应体系在不同温度下(39℃,40℃,42℃)进行实时荧光RAA扩增,每个温度重复5次,比较不同温度之间扩增曲线的TT,确定最佳反应温度。
1.3.7 灵敏度分析:将HAdV-14阳性质粒标准品梯度稀释至终浓度为104,103,102,101copies/μl的标准品溶液,以无核酶水为阴性对照,运用HAdV-14实时荧光RAA方法进行检测,每个浓度重复5次,以评估实时荧光RAA测定法的灵敏度,并分析5次重复检测结果的TT值批内CV。
1.3.8 特异度及临床样本分析:使用建立的HAdV-14实时荧光RAA方法,对在中国人民解放军联勤保障部队第九〇三医院收集的50份咽拭子进行检测,具体操作严格按照操作说明进行,并与实时荧光PCR检测结果进行比较,评估HAdV-14实时荧光RAA测定法的特异度及其在临床样本中的检测性能。
1.4 统计学分析 采用SPASS16.0统计学分析软件处理,其中TT值为计量资料,两组间比较采用t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 引物和探针的筛选 熔解曲线分析结果见图1。4组引物的溶解曲线均呈单峰,熔链温度在82℃左右,说明4组引物对的特异度良好。4组引物探针组合均出现了特异性荧光曲线,其中组合1(HAdV14-F1-4,HAdV14-R1,HAdV14-P)的TT最早,提示组合1为最佳引物探针组合,见图2。
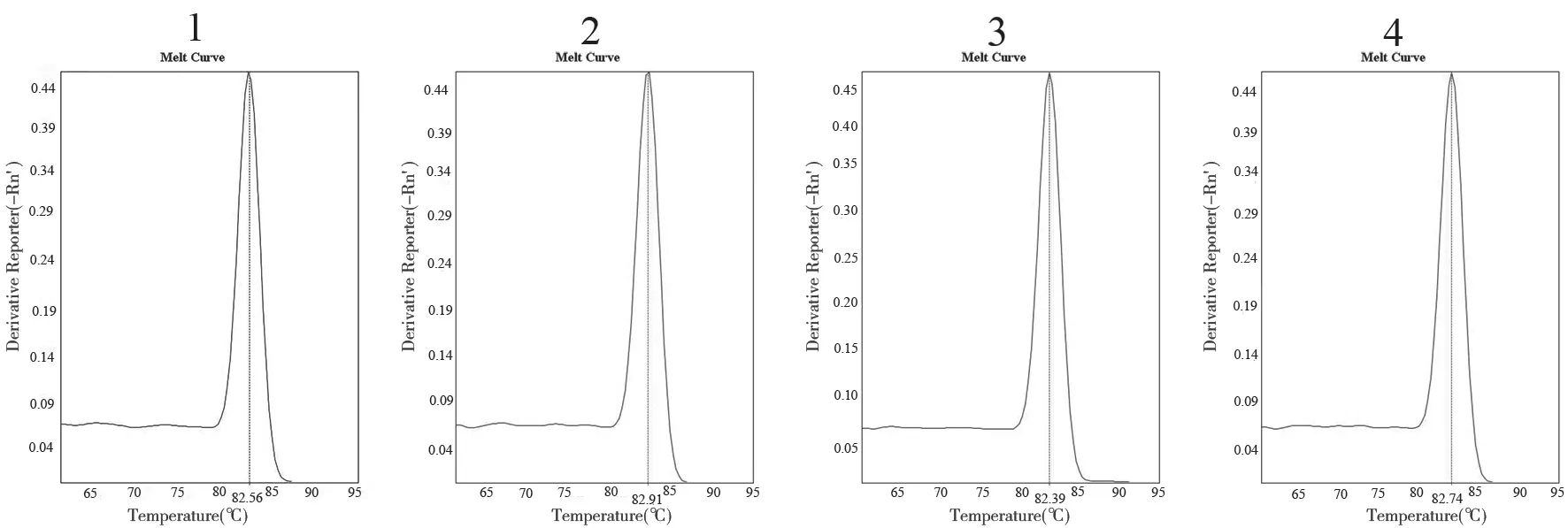
图1 不同引物组合熔解曲线分析结果
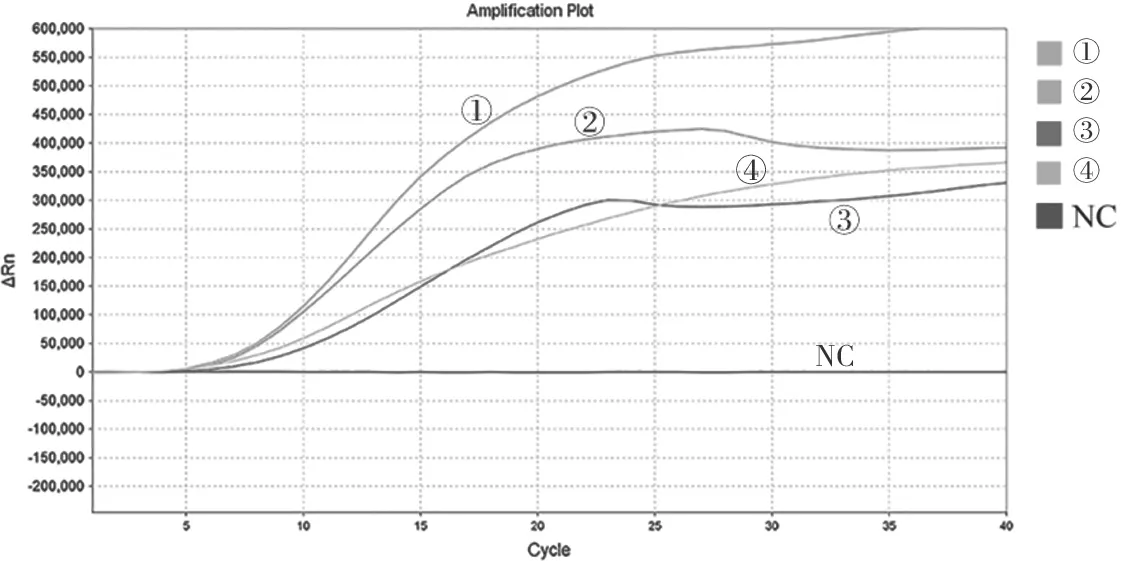
图2 不同引物探针组合实时荧光RAA扩增结果
2.2 不同温度下扩增效果比较 不同反应温度时扩增曲线的TT值不同见图3。在40℃条件下扩增时,特异性荧光曲线TT最早,且5次检测结果重复性良好,表明40℃为HAdV-14实时荧光RAA检测的最适反应温度。

图3 不同温度HAdV-14实时荧光RAA扩增结果
2.3 灵敏度评价 结果见图4。以HAdV-14阳性质粒标准品为模板,当浓度为104,103,102,101copies/μl时均有特异性扩增曲线,所以HAdV-14实时荧光RAA检测方法的灵敏度为101copies/μl。另外,5次重复检测结果的TT值批内CV<5%,结果见表2,表明该方法的重复性良好。
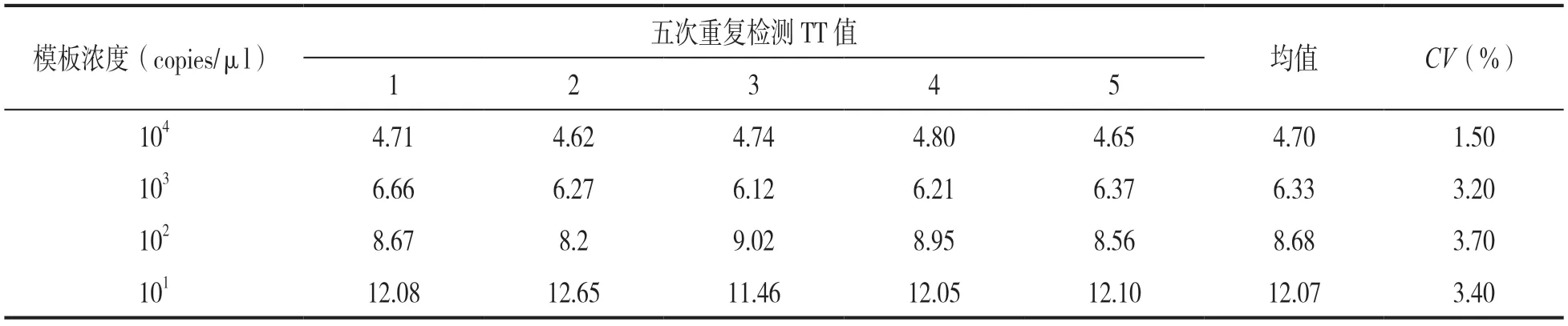
表2 不同模板浓度RAA检测的重复性
2.4 特异度及临床样本分析 见图5。HAdV-14阳性样本的DNA为模板时出现特异性荧光信号,但是当HAdV其他亚型(HAdV-3,HAdV-4,HAdV-7,HAdV-21,HAdV-55)与其它5种病原体核酸作为模板时,无特异性荧光信号,表明该检测方法的特异度良好,可满足临床检测需求。

图5 HAdV-14实时荧光RAA测定法的临床样本分析
3 讨论
人腺病毒(HAdV)是一种具有高传染性的病原体,能导致严重的呼吸道疾病。近年来,HAdV-14在全球范围内重新出现,引起一系列严重的呼吸道疾病的暴发和流行。由于人群普遍易感,其感染率较其它亚型高,可引起更严重的急性呼吸道疾病。因此,迫切需要开发快速、灵敏且特异的HAdV-14检测方法对这种病毒进行适当的监测,以预防HAdV-14感染的暴发和传播。传统的HAdV检测方法主要采用病毒分离、培养、免疫分析等技术,但这些技术存在费时费力等缺点,难以实现HAdV感染的快速诊断。目前,常用的分子诊断技术包括PCR和实时荧光PCR等,它们具有较高的灵敏度和特异度,已被广泛用于临床上HAdV感染的诊断。但是因为变温扩增过程需要热循环仪和训练有素的操作人员,这些方法不适用于野外或资源有限地区进行HAdV的快速诊断。与常用分子诊断技术相比,等温核酸扩增方法简单、快速且具有成本效益。RAA是一种新的等温扩增方法,周转时间短、温度低、灵敏度高、特异性强,特别适用于HAdV-14的快速诊断或现场评估。鉴于现存HAdV-14病毒检测方法的不足以及HAdV-14病毒快速现场检测的需求,研究一种可在常温下快速检测HAdV-14病毒且能应用于基层医疗的RAA扩增方法非常有必要。
等温扩增技术可以在相对较低的恒温条件下进行扩增,使用便携式实时荧光扫描仪或者胶体金试纸条对结果进行可视化检测。与实时荧光定量PCR相比,该方法检测时间大大缩短,所需设备简单,是一种检测HAdV-14简便且快速的方法,适用于在资源有限地区进行HAdV-14的快速诊断。尽管本研究建立的实时荧光RAA检测方法具有检测时间短、操作简便、对仪器要求低等诸多优势,但是该方法仍然具有一些局限性:①HAdV-14阳性样本较少,应该使用更多HAdV-14阳性的临床样本来评估该方法;②该方法没有加入内参作为对照,在实际应用中应加入内参以消除样品中潜在抑制剂的影响;③在撰写本文时,还没有专门的软件可用于设计RAA引物探针,如果将来开发专门的软件,可以进一步简化RAA的引物探针设计;④RAA技术目前在临床的应用多为定性试验,尚无绝对定量,即当高模板含量(>107拷贝)时,反应达阈值的时间很早,一般在一两分钟就可迅速扩增,这时反应曲线的阈值时间就很难准确检测,变异度大,所以阈值时间与模板起始拷贝数对数之间难以呈现线性[23]。
虽然 RAA 的优势在于等温扩增,检测过程无需大型核酸扩增仪,但是该方法仍需要核酸提取纯化这一繁琐的步骤,因此需要开发能够以与RAA方法兼容的快速核酸提取技术或核酸免提取技术,使其更加适用于资源匮乏地区的即时诊断。本课题组已成功研发了一种适用于PCR,实时荧光PCR及等温PCR的核酸免提取技术,该技术可能在常温下5~10 min内有效裂解呼吸道感染性疾病的病原体使其释放核酸(DNA和RNA),不需提取步骤即可直接进行核酸扩增。另外,随着2019新冠肺炎疫情的暴发,在户外及床旁检测SARS-CoV-2的需求日益增加,基于RAA技术的即时检验(pointof-care testing,POCT)应运而生[24-26]。截止目前,尚无关于HAdV-14的RAA检测试剂结合胶体金技术的报道。因此,课题组将在下一阶段开展核酸免提取、RAA与胶体金技术相结合的研究,有望得到用于HAdV-14的POCT检测试剂,并在军队、疾控等单位实施推广。
综上所述,我们开发了一种快速灵敏的实时荧光RAA检测方法用于检测HAdV-14。该方法在40℃条件下20min内即可检测出HAdV-14,灵敏度为101copies/μl,不与HAdV其他亚型及其他常见呼吸道病原体发生交叉反应。与实时荧光PCR相比,RAA检测更简便,耗时更少,它为临床快速诊断HAdV-14感染提供了新方法。
