筛选血清HBV-DNA阴性且HBsAg与HBsAb阳性CHB患者的血清危险因素及评分与预后的相关性研究
2023-12-01张欢妍彭俊华江苏医药职业学院金坛临床学院江苏常州1300江苏大学附属金坛第一人民医院检验科江苏常州1300
杨 阳,张欢妍,吕 幸,彭俊华(1.江苏医药职业学院金坛临床学院,江苏常州 1300;.江苏大学附属金坛第一人民医院检验科,江苏常州 1300)
当人体被乙肝病毒(hepatitis B virus,HBV)感染后,机体的免疫系统被激活,针对乙肝表面抗原(hepatitis B surface antigen,HBsAg)产生具有保护性的乙肝表面抗体(hepatitis B surface antibody,HBsAb),HBsAb中和HBsAg,进而协助机体清除HBV。因此,理论上HBsAg和HBsAb在人体内是先后出现的,但在实际的临床工作中确实存在两者同时阳性的情况,回顾性研究发现[1-3],HBsAg与HBsAb阳性在慢性乙型肝炎(chronic hepatitis B,CHB)患者中的发生率为2.43%~8.9%。既往的研究[2-5]主要集中在HBV-DNA阳性的CHB患者中,高HBV-DNA载量的HBsAg与HBsAb阳性患者预后相对更差,伴随着更严重的肝纤维化和肝硬化,患肝癌(hepatocellular carcinoma,HCC)的风险更高。研究发现[4],HBV-DNA阴性且HBsAg和 HBsAb阳性患者的预后与HCC的发生率无关,针对此类患者预后危险因素的研究甚少,探讨此类患者的预后危险因素对患者的治愈有着重要的意义。本研究从常见的血清学指标中筛选HBV-DNA阴性且HBsAg和 HBsAb阳性患者的危险因素,探讨危险因素评分与预后的相关性,进而指导临床针对性地治疗。
1 材料与方法
1.1 研究对象 选取2020年1月~2022年6月在常州市金坛第一人民医院就诊且HBV-DNA阴性CHB患者193例。其中,HBsAg和 HBsAb阳性的患者119例作为观察组,其中男性70例,女性49例,年龄65.0(54.0,73.0)岁;HBsAg阳性且HBsAb阴性的患者74例为对照组,其中男性47例,女性27例,平均年龄61.0(43.5,72.0)岁。两组间性别和年龄差异无统计学意义(χ2=0.42,U=3 842.00,均P>0.05)。纳入标准:①符合2020年慢性乙型肝炎基层诊疗指南的诊断标准[6];②HBsAg持续阳性超过6个月;③未接受抗病毒治疗;④HBsAg和HBsAb共同阳性患者经一个月以后的复查仍然为共存状态。排除标准:①并发甲、丙、丁、戊型病毒性肝炎;②酒精性肝病和非酒精性脂肪肝等原因造成的肝脏损害;③既往或正在接受抗病毒治疗。本研究经医院伦理委员会批准。
1.2 仪器与试剂 全自动化学发光分析仪及其配套试剂盒(苏州长光华医AE240);荧光定量PCR分析仪(美国生物系统公司ABI7500)及生物试剂盒(深圳市爱康生物科技股份有限公司);全自动生化分析仪及其配套试剂(贝克曼Au5800);血液分析仪及其配套试剂(Sysmex XN2000)。
1.3 方法
1.3.1 临床资料收集:收集所有患者的性别、年龄、肝功能血清学指标(ALT,AST,TP,ALB,TBIL)、乙肝血清学指标(HBsAg,HBsAb,HBVDNA)、血细胞检测参数(中性粒细胞计数、淋巴细胞计数、血小板计数)。
1.3.2 分组标准:观察组:HBV-DNA阴性且HBsAg和HBsAb阳性;对照组:HBV-DNA阴性且只有HBsAg阳性。
1.3.3 血清无创诊断指标计算公式:外周血炎性指标:中性粒细胞/淋巴细胞比率(neutrophil-to-lymphocyte ratio,NLR)=中性粒细胞计数/淋巴细胞计数;血小板/淋巴细胞比率(platelet-to-lymphocyte ratio,PLR)=血小板计数/淋巴细胞计数;系统炎症指数(systemic immune-inflammation index,SII)=血小板计数×中性粒细胞计数/淋巴细胞计数。无创肝纤维化指标: 谷氨酰基转移酶/血小板计数的比值(gamma-glutamyl-transpeptidase to platelet ratio,GPR)= GGT(U/L)×100/[PLT(×109/L)×GGT的正常上限(U/L)];天门冬氨酸氨基转移酶与血小板比值指数(aspartate aminotransferase to platelet ratio,APRI)= AST(U/L)×100/[PLT(×109/L)×AST的正常上限(U/L)];基于4因子的纤维化指数(fibrosis index based on the four factors,FIB-4)=[年龄(岁)×AST(U/L)]/[[PLT(×109/L)×[ALT(U/L)]1/2]。
1.3.4 跟踪随访:根据观察组随访二年内HBsAg和HBsAb水平变化分亚组。将HBsAg水平明显降低(减少一半以上)的患者归为预后良好组,低于检测下限0.1 IU/ml定义为HBsAg清除;HBsAg水平没有明显降低或HBsAb水平低于10 mIU/ml的患者归为预后不良组。追踪的方式主要是门诊随访。119例观察组中44例患者追踪到HBsAg和HBsAb的复检记录,53例患者没有复检记录,22例患者追踪时间未满2年。
1.4 统计学分析 应用SPSS 22.0软件进行统计分析。正态分布的计量资料用均数±标准差(±s)表示,采用两独立样本t检验;偏态分布的计量资料用中位数 ( 四分位数 ) [M(P25,P75)]表示,采用Mann-WhitneU检验。计数资料以例(百分率)[n(%)]表示,采用卡方检验。采用 Logistic 单因素回归分析HBsAg和HBsAb阳性模式的相关因素,多因素Logistic分析其发生独立预测因子;运用受试者工作特征(receiver operating characteristic,ROC)曲线明确HBsAg,TP,PLT和APRI等指标的截断值以及评价危险因素评分预测模型的诊断价值。以P<0.05为差异具有统计学意义。
2 结果
2.1 观察组和对照组临床资料和血清无创诊断指标的比较 见表1。观察组的HBsAb,PLT和TP水平高于对照组,而观察组的HBsAg水平和APRI比值低于对照组,差异具有统计学意义(均P<0.05);两组的性别、年龄以及ALT,AST,ALB,TBIL,NLR,PLR,SII,GPR和FIB-4指标比较,差异无统计学意义(均P>0.05)。
表1 观察组和对照组临床资料和血清无创诊断指标的比较[n(%),±s,M(P25,P75)]
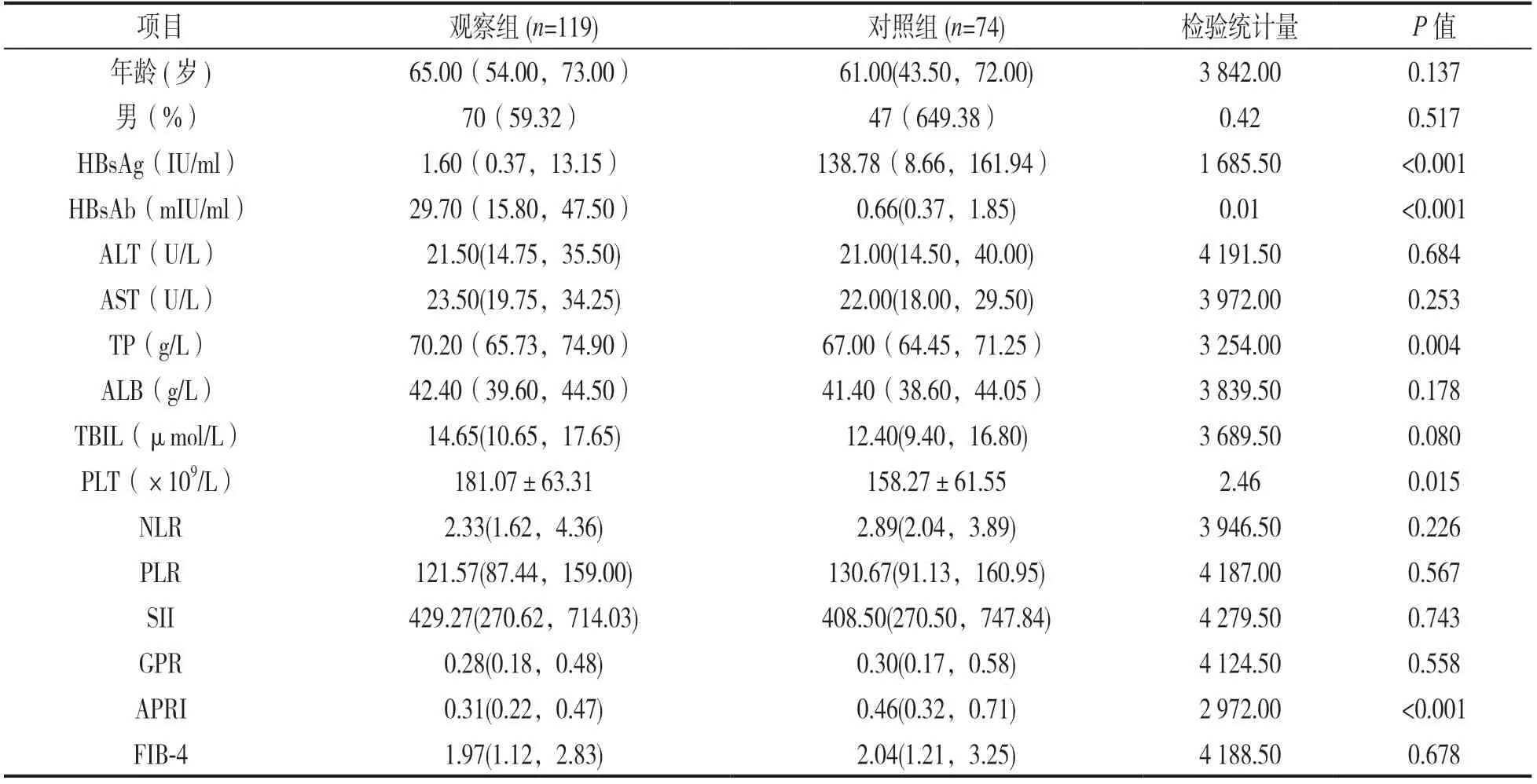
表1 观察组和对照组临床资料和血清无创诊断指标的比较[n(%),±s,M(P25,P75)]
项目观察组(n=119)对照组(n=74)检验统计量P值年龄(岁)65.00(54.00,73.00)61.00(43.50,72.00)3 842.000.137男(%)70(59.32)47(649.38)0.420.517 HBsAg(IU/ml)1.60(0.37,13.15)138.78(8.66,161.94)1 685.50<0.001 HBsAb(mIU/ml)29.70(15.80,47.50)0.66(0.37,1.85)0.01<0.001 ALT(U/L)21.50(14.75,35.50)21.00(14.50,40.00)4 191.500.684 AST(U/L)23.50(19.75,34.25)22.00(18.00,29.50)3 972.000.253 TP(g/L)70.20(65.73,74.90)67.00(64.45,71.25)3 254.000.004 ALB(g/L)42.40(39.60,44.50)41.40(38.60,44.05)3 839.500.178 TBIL(μmol/L)14.65(10.65,17.65)12.40(9.40,16.80)3 689.500.080 PLT(×109/L)181.07±63.31158.27±61.552.460.015 NLR2.33(1.62,4.36)2.89(2.04,3.89)3 946.500.226 PLR121.57(87.44,159.00)130.67(91.13,160.95)4 187.000.567 SII429.27(270.62,714.03)408.50(270.50,747.84)4 279.500.743 GPR0.28(0.18,0.48)0.30(0.17,0.58)4 124.500.558 APRI0.31(0.22,0.47)0.46(0.32,0.71)2 972.00<0.001 FIB-41.97(1.12,2.83)2.04(1.21,3.25)4 188.500.678
2.2 观察组和对照组差异指标的ROC分析 通过ROC分析来评价差异指标的预测价值。HBsAg,TP,PLT,APRI曲线下面积(AUC)分别为0.194(95%CI: 0.126~0.262),0.625(95%CI: 0.547~0.704),0.599(95%CI: 0.515~0.684)和0.340(95%CI: 0.262~0.418),敏感度分别为16.8%,52.9%,63.0%和52.1%,特异度分别为31.5%,68.5%,57.5%和19.2%,截断值分别为22.56 IU/ml,69.45 g/L,157.5×109/L和0.29。
2.3 观察组发生预后不良的危险因素分析 见表2。HBsAg≤22.56 IU/ml,TP≥69.45 g/L,PLT≥157.50×109/L,APRI≤0.29与观察组发生预后不良有关,差异均有统计学意义(均P<0.05)。将以上因素纳入多因素logistics回归分析,结果显示HBsAg≤22.56 IU/ml [OR(95%CI):9.853(4.722~20.560)] 和TP≥69.45 g/L[OR(95%CI):2.358(1.132~4.912)]是观察组发生预后不良的独立危险因素。SII因P>0.05,故以中位数413.35为临界值,年龄根据既往文献[7]确定临界值。
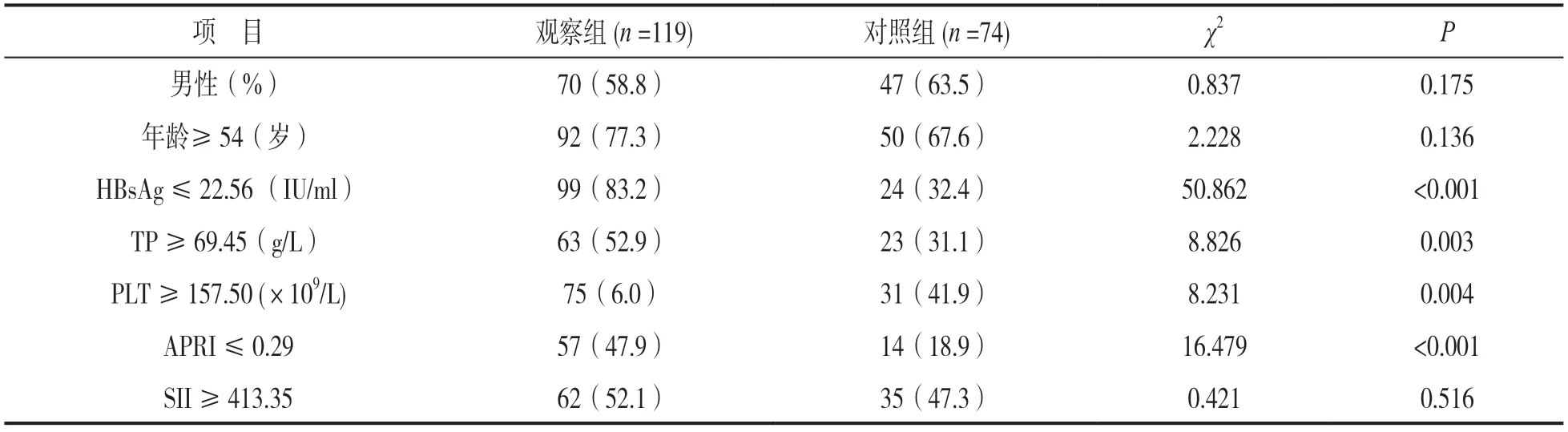
表2 观察组发生预后不良的单因素分析[n(%)]
2.4 建立危险因素评分模型 见图1。基于HBsAg≤22.559 IU/ml和TP≥69.45 g/L这两个独立危险因素对所有研究对象进行评分。每一个危险因素赋予1分,得到如下三组:0分组(无危险因素),1分组(1个危险因素),2分组(2个危险因素)。统计得到:0分组、1分组和2分组在观察组中分别有11例、54例和54例,在对照组中分别有34例、34例和6例,该危险因素建立的评分模型预测HBsAg和HBsAb阳性模式的AUC为0.703,灵敏度为66.7%,特异度为73.9%。
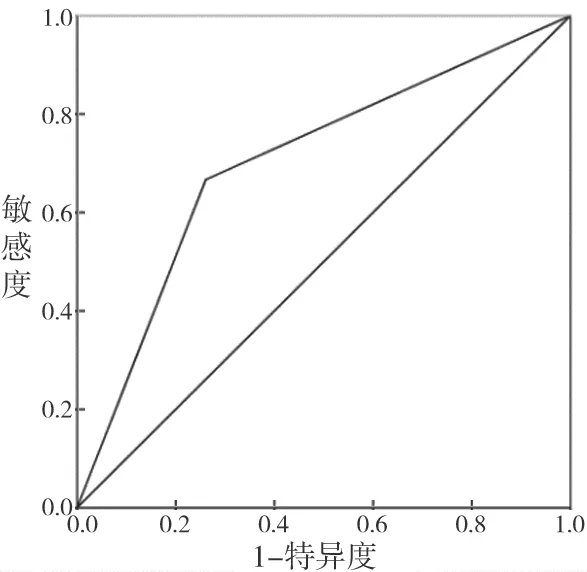
图1 危险因素评分模型预测HBsAg和HBsAb阳性模式的ROC曲线
2.5 危险因素评分模型与观察组预后情况分析 根据HBsAg,HBsAb水平变化对44例观察组患者二年内预后情况进行分析。在评分模型的0分组、1分组和2分组出现良好预后分别有1例、7例和12例,出现不良预后分别有6例、16例和2例,差异有统计学意义(χ2=13.838,P=0.001)。其中,发生HBsAg清除有9例(2.0%,9/44),发生在1分组和2分组分别有2例和7例;发生 HBsAb消失也有9例(2.0%,9/44),发生在0分、1分组和2分组分别是2例、6例和2例。结果表明评分高的HBsAg和HBsAb阳性患者趋向于HBsAg降低甚至血清学清除的良好预后;评分低的HBsAg和HBsAb阳性患者趋向于HBsAg升高甚至HBsAb消失的不良预后。
3 讨论
免疫球蛋白在慢性乙肝、代偿期肝硬化和失代偿期肝硬化人群中逐渐增高,表明HBV引起的免疫应答是导致肝细胞损伤及炎症坏死的主要原因,而炎症坏死持续存在或反复出现可导致肝硬化甚至肝细胞癌(HCC)[8-9]。临床上对乙肝病毒血清学标志物(HBsAg,HBsAb,HBV-DNA等)结合生化检测指标(ALT,AST,TBIL等)、血细胞检测和肝纤维化指标(GPR,APRI,FIB-4评分等)来确定慢性乙型肝炎(CHB)患者的进展阶段和严重程度,从而采取相应的治疗方案[8]。HBV-DNA阴性且HBsAg和HBsAb阳性患者作为临床的少见病例,其临床预后报道较少,在管理上与HBsAg阳性且HBsAb阴性患者没有区分,治疗上缺乏针对性。因此有必要筛选出HBV-DNA阴性的HBsAg和HBsAb阳性患者不同预后的危险因素,指导临床进行针对性诊疗。
CHB是慢性炎症、免疫系统失衡的全身性疾病,肝功能血清学指标可反映肝炎的进展和肝细胞的坏死程度;基于血细胞检测结果的NLR,PLR,SII等相关炎症指标,可用于预测重度肝纤维化和肝硬化[10],也可用于预测慢加急肝功能衰竭[11]、病毒性肝炎[12]和HCC的预后和进展[13];基于血清指标的无创诊断模型GPR,APRI,FIB-4与肝脏纤维化分期相关,为临床使用非侵入式方法诊断肝脏炎症和纤维化提供依据[14],甚至作为肝活检的替代方法[6]。本研究中,观察组和对照组肝功能血清学指标(ALT,AST,ALB,TBIL)集中在正常范围之内,相关炎症指标(NLR,PLR,SII)接近无纤维化的CHB患者[10],肝纤维化血清诊断模型(GPR,APRI,FIB-4)的结果低于肝纤维化的初级阶段[15-16],表明了本研究选取的研究对象多为非活动性HBV携带者,其肝脏的炎症损害和纤维化程度较低。有研究发现[15],APRI在无纤维化的F0阶段和轻度纤维化的F1阶段分别是0.32和0.48,推测本研究选取的观察组和对照组分别处于肝纤维化的F0阶段和F1阶段,并且本研究中观察组的PLT水平高于对照组,PLT的数量与肝纤维化相关[17-18],表明观察组肝纤维化程度低于对照组。其原因可能是HBV-DNA阴性的HBsAg和HBsAb阳性患者排除了免疫逃逸突变体导致的检测失败和新的HBV菌株的重复感染,处于HBsAg清除到HBsAb产生的过渡阶段,机体的免疫系统压制病毒的复制,患者肝内无炎症活动或仅有轻微炎症[4,8]。肝损害和肝纤维化是影响CHB患者预后和治疗的重要因素,低水平的肝损害和纤维化程度也是观察组患者趋向于良好预后的重要因素。
HBsAg和HBsAb阳性模式的最终血清学转变结果是HBsAg血清学清除和HBsAb血清学消失[4],前者达到了临床治愈的目标,后者可发展为CHB的严重阶段,两者预后的管理完全不同。本研究发现HBsAg水平低于22.56 IU/ml和TP水平高于69.45 g/L是影响HBsAg和HBsAb阳性模式的独立危险因素,低水平的HBsAg预示着HBV清除,高水平的TP提示更好的肝脏合成能力,结合肝功能的化学指标正常和肝脏组织无明显炎症或纤维化改变为良好的预后提供基础[8]。基于以上两个危险因素建立的评分模型预测HBsAg和HBsAb阳性模式发生情况的ROC曲线下面积是0.703,具有一定的诊断价值,高评分提示该模式的高发生率。值得一提的是,该评分模型的2分组出现了较多HBsAg降低甚至血清学清除现象,提示该评分模型可用于筛选良好预后人群,这与既往的研究结果相似[19]。出现良好预后的HBsAg和HBsAb阳性乙肝患者可能处于疾病恢复的短暂过渡阶段,属于临床治愈的优势人群,积极的配合治疗,能够提高HBsAg的清除率[20-21]。此外,本研究发现预后良好组两年内HBsAg清除率为2.0%,低于既往研究年清除率4.92%[20],可能原因是研究人群特征的差异以及随访的时间较短。然而,该评分模型的0分组和1分组出现了较多的HBsAg升高甚至HBsAb血清学消失的不良预后,提示该评分模型可用于筛选不良预后人群。出现不良预后的原因可能是HBV重新激活的信号,主要发生在无抗病毒预防情况下接受免疫抑制治疗的HBV感染者,可能导致爆发性肝炎、肝衰竭等致命的后果[4];另一个原因是人类基因寡聚腺苷酸合成酶3(OAS3)突变导致HBV的复制不受限制,从而使HBsAg清除失败[22],这两种情况都需要积极的干预。可见,HBV-DNA阴性的HBsAg和HBsAb阳性模式并不只是恢复的指标,不良临床结果的风险仍然存在,有必要筛选出不同临床预后人群加以针对性的治疗管理。
综上所述,HBV-DNA阴性且HBsAg和HBsAb阳性患者比HBsAg阳性且HBsAb阴性患者存在更低的HBsAg和纤维化水平,更高的TP和PLT含量。HBsAg≤22.56 IU/ml和TP≥69.45 g/L是HBsAg和HBsAb阳性模式发生不良预后的独立危险因素,基于这两个因素建立评分模型可用于预测其发生和筛选不同预后人群。本研究建立的模型指标简单易行,适合基层医院CHB患者的长期监测。但本研究的局限之处在于标本量较少导致建模数据有限,随访时间短无法长期观察到患者长期的血清学变化,后期将扩大标本量,长期随访进一步深入研究,为临床诊疗提供更有利的证据。
