急性缺血性脑卒中患者血清sTREM2和DKK-1水平检测对抑郁发生的预测价值研究
2023-12-01董汉宁彭芸娟雷国奇艾艳萍方足兵
董汉宁,彭芸娟,雷国奇,艾艳萍,方足兵
(武汉市汉口医院 a.心理康复科;b.中医科;c.神经内科,武汉 430012)
急性缺血性脑卒中(acute ischemic stroke,AIS)占所有脑卒中类型的70%,是我国致死致残首要原因[1]。卒中后抑郁(post-stroke depression,PSD)是脑卒中患者常见的神经精神并发症,发病率可达30%~50%,增加患者脑血管事件的复发及死亡风险[2-3]。可溶性髓细胞表达触发受体2(soluble myeloid cells expressed trigger receptor 2,sTREM2)能结合蛋白酪氨酸激酶,参与炎症及免疫反应、神经退行性疾病等病理生理过程[4-5]。研究表明,缺血性脑梗死大鼠中sTREM2的表达能增强梗死周围脑组织炎症免疫反应,是潜在的免疫调节靶点[6]。Wnt信号通路抑制因子1(Dickkopf-1,DKK-1) 是具有半胱氨酸结构域的分泌型蛋白,能结合抑制β-连环蛋白,抑制Wnt通路的信号传导[7]。研究发现,DKK-1的过度表达通过抑制Wnt/β-连环蛋白通路,诱导海马损伤,导致抑郁症的发生[8]。目前sTREM2,DKK-1与AIS患者PSD发生的关系尚不清楚。本研究通过检测AIS患者血清sTREM2和DKK-1水平,探讨两者对PSD发生的预测价值。
1 材料与方法
1.1 研究对象 选取2019年1月~2021年1月于武汉市汉口医院住院治疗的AIS患者251例为研究对象。病例纳入标准:①AIS诊断符合中华医学会神经病学分会2018年制定的《中国急性脑卒中临床研究规范共识2018》标准[9];②年龄18~80岁,卒中发作后1周内入院就诊且均为首次卒中;③经头颅CT或MRI扫描有明确的病灶;④患者及家属对本研究知情并签署知情同意书。排除标准:①既往有抑郁症或其它精神疾病史者,卒中发作前曾服用抗抑郁药物或抗精神疾病药物;②有意识障碍,精神症状或认知障碍不能配合者或因其他因素如失访、死亡等不能完成随访调查者;③并发严重的心肺功能异常、甲状腺功能低下、急性感染性疾病、自身免疫性疾病及恶性肿瘤者。本研究经我院伦理委员会批准通过。
1.2 仪器与试剂 人sTREM2 ELISA试剂盒(上海科培瑞生物公司,货号KPR-1265),人DKK-1 ELISA试剂盒(泉州睿信生物科技公司,货号RX-0103),Varioskan LUX多功能酶标仪(美国赛默飞公司)。
1.3 方法
1.3.1 检测方法:采用酶联免疫吸附实验检测血清sTREM2和DKK-1表达。留取所有研究对象入院后第二天清晨空腹静脉血约5 ml,3 000 r/min 离心10 min,留取上层血清待测。实验步骤按照试剂盒说明书进行。终止反应后酶标仪读取450nm处的吸光度值,根据标准品孔吸光度值计算样品孔浓度值。
1.3.2 观察指标:收集患者性别、年龄、受教育年限、体质量指数(body mass index,BMI)、高血压史、精神疾病家族史、糖尿病史、冠心病史、高脂血症史、卒中发病部位等资料。记录所有患者入院后第2天实验室检查指标,包括总胆红素、总胆固醇、三酰甘油、高密度脂蛋白-胆固醇、低密度脂蛋白-胆固醇、空腹血糖、血尿素氮、血肌酐、纤维蛋白原等。
1.3.3 卒中病情评估及分组:于患者入院当天由神经内科医师使用美国国立卫生研究院卒中量表(National Institutes of Health Stroke Scale,NIHSS)评估AIS患者病情严重程度,评分范围为0~42分,分数越高,神经受损越严重[10]。所有患者脑卒中后6个月时,采用日常生活活动能力量表(activities of daily living,ADL)评估日常生活活动功能,评分范围为0~100分,分数越低,患者日常生活活动能力越差[11];采用改良Rankin量表(modified Rankin scale,mRS )评估神经功能恢复情况,评分范围为0~6分,分数越高,患者神经功能恢复情况越差[12];采用汉密尔顿抑郁量表(Hamilton depression scale,HAMD)对所有AIS患者进行评分,分为PSD组(≥7分,n=68)和非PSD(none PSD,NPSD)组(<7分,n=183)。
1.4 统计学分析 应用SPSS22.0统计软件进行数据分析。符合正态分布且方差齐性的计量资料以均数±标准差(±s)表示,组间比较采用两独立样本t检验。计数资料以率(%)表示,组间比较采用卡方检验。相关性分析采用Pearson相关分析。多因素Logistic回归分析影响AIS患者PSD发生的因素。受试者工作曲线分析血清sTREM2,DKK-1及两者联合对AIS患者PSD发生的预测价值。以P<0.05为差异有统计学意义。
2.1 两组血清sTREM2,DKK-1水平及临床指标比较 见表1。PSD组男性比例、年龄、精神疾病家族史、高脂血症史、总胆固醇、血清sTREM2,DKK-1,NIHSS评分及mRS评分高于NPSD组,ADL评分低于NPSD组,差异具有统计学意义(均P<0.05)。
表1 两组血清sTREM2,DKK-1水平及临床指标比较[n(%),±s]
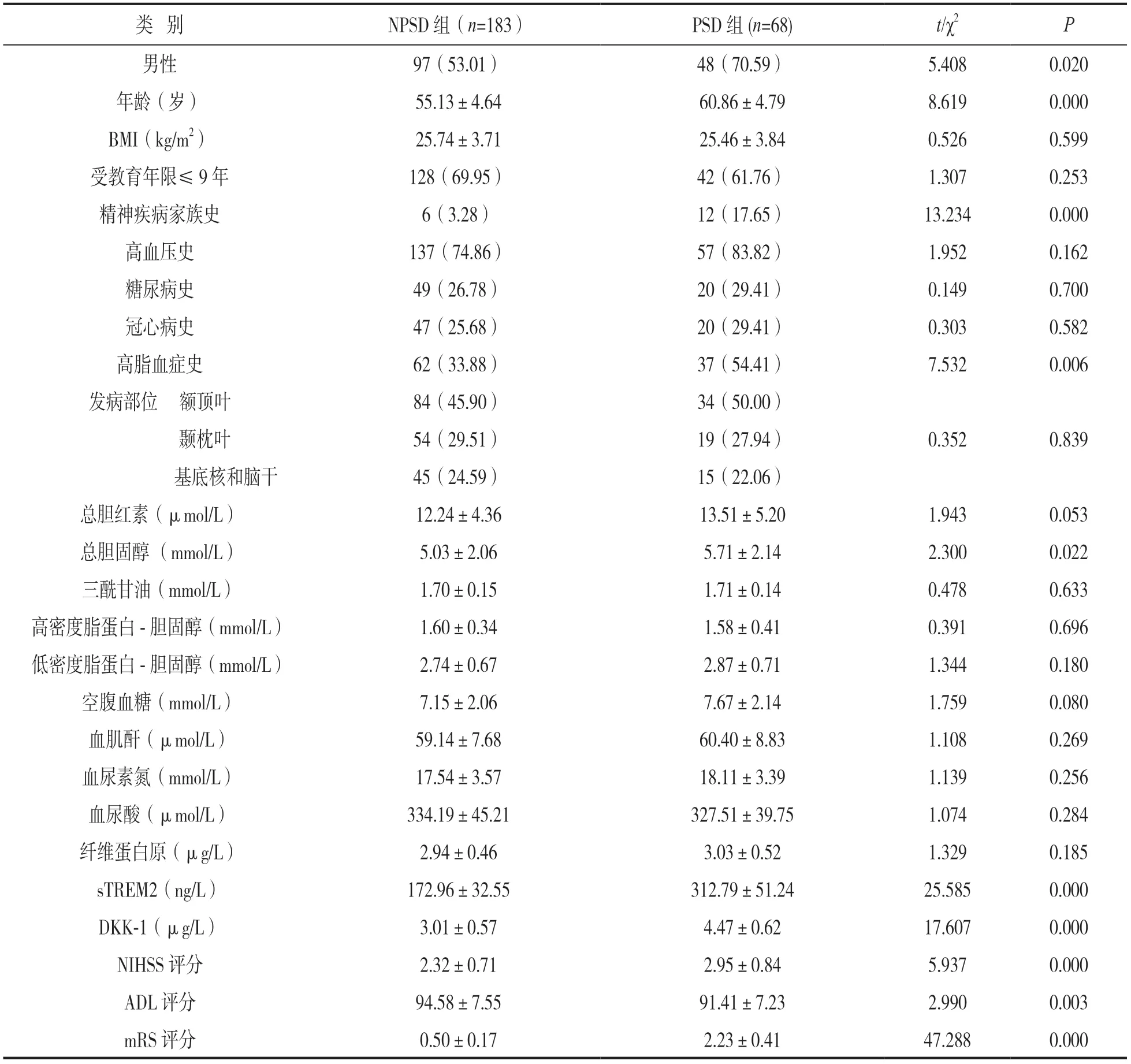
表1 两组血清sTREM2,DKK-1水平及临床指标比较[n(%),±s]
类 别NPSD组(n=183)PSD组(n=68)t/χ2P男性97(53.01)48(70.59)5.4080.020年龄(岁)55.13±4.6460.86±4.798.6190.000 BMI(kg/m2)25.74±3.7125.46±3.840.5260.599受教育年限≤9年128(69.95)42(61.76)1.3070.253精神疾病家族史6(3.28)12(17.65)13.2340.000高血压史137(74.86)57(83.82)1.9520.162糖尿病史49(26.78)20(29.41)0.1490.700冠心病史47(25.68)20(29.41)0.3030.582高脂血症史62(33.88)37(54.41)7.5320.006发病部位 额顶叶84(45.90)34(50.00)0.3520.839颞枕叶54(29.51)19(27.94)基底核和脑干45(24.59)15(22.06)总胆红素(μmol/L)12.24±4.3613.51±5.201.9430.053总胆固醇 (mmol/L)5.03±2.065.71±2.142.3000.022三酰甘油(mmol/L)1.70±0.151.71±0.140.4780.633高密度脂蛋白-胆固醇(mmol/L)1.60±0.341.58±0.410.3910.696低密度脂蛋白-胆固醇(mmol/L)2.74±0.672.87±0.711.3440.180空腹血糖(mmol/L)7.15±2.067.67±2.141.7590.080血肌酐(μmol/L)59.14±7.6860.40±8.831.1080.269血尿素氮(mmol/L)17.54±3.5718.11±3.391.1390.256血尿酸(μmol/L)334.19±45.21327.51±39.751.0740.284纤维蛋白原(μg/L)2.94±0.463.03±0.521.3290.185 sTREM2(ng/L)172.96±32.55312.79±51.2425.5850.000 DKK-1(μg/L)3.01±0.574.47±0.6217.6070.000 NIHSS评分2.32±0.712.95±0.845.9370.000 ADL评分94.58±7.5591.41±7.232.9900.003 mRS评分0.50±0.172.23±0.4147.2880.000
2 结果
2.2 血清sTREM2,DKK 1水平与各评分的相关性PSD组血清sTREM2,DKK-1水平与NIHSS评分(r=0.657,0.620,P=0.000),mRS评分(r=0.669,0.614,P=0.000)呈显著正相关,与ADL评分呈显著负相关(r=-0.712;-0.701,均P=0.000)。
2.3 影响AIS患者PSD发生的因素 见表2。以AIS患者是否发生PSD为因变量,以血清sTREM2,DKK-1为自变量,以性别、年龄、精神疾病家族史、高脂血症史、总胆固醇、NIHSS评分、mRS评分和ADL评分为协变量,多因素Logistic回归分析显示,血清sTREM2,DKK-1是影响AIS患者PSD发生的独立危险因素。

表2 多因素Logistic回归分析影响AIS患者PSD发生的因素
2.4 血清sTREM2,DKK-1对AIS患者PSD发生的预测价值 见表3,图1。血清sTREM2,DKK-1联合检测对AIS患者PSD发生预测的曲线下面积大于血清sTREM2,DKK-1单项指标,差异具有统计学意义(Z=3.864,4.072,均P<0.05)。
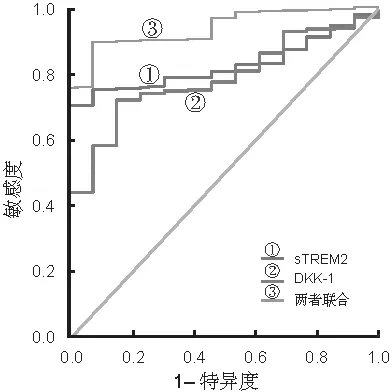
图1 受试者工作曲线分析各指标对AIS患者PSD发生的预测价值
3 讨论
临床上,卒中后抑郁(PSD)患者主要表现为情绪低落、兴趣缺失、快感缺乏及焦虑等症状。PSD多为轻中度抑郁,临床表现显著持久,影响急性缺血性脑卒中(AIS)患者的神经功能恢复,增加AIS的复发率及致死率[2]。目前PSD的诊断主要依据临床表现,缺乏可靠的生物学指标,难以及时发现及治疗[13]。PSD疾病机制尚不清楚,目前认为与年龄、脑卒中严重程度及单胺类神经递质水平下降有关。深入研究PSD疾病病因及疾病机制,寻找能够评估AIS患者PSD发生的血清指标,有助于PSD早期干预治疗。
髓细胞表达触发受体2(TREM2)主要表达于脑小胶质细胞表面,蛋白水解裂解后形成可溶性sTREM2,是小胶质细胞活化的生物标志物[14]。研究发现,在阿尔兹海默病、帕金森病等神经退行性疾病中,患者脑脊液中sTREM2水平升高,sTREM2通过促进神经元凋亡及炎症微环境形成,增加认知障碍及痴呆发生的风险[4-5,15]。本研究中,PSD组患者血清sTREM2升高,提示sTREM2升高参与AIS患者PSD的发生。有研究报道,大脑中动脉闭塞小鼠卒中模型中sTREM2的转录显著增加,在脑梗死区域周围的脑组织中,sTREM2的表达与对照组相比升高四倍,sTREM2能够通过受损的血脑屏障进入外周血,导致血清sTREM2表达水平升高[16]。此外,sTREM2能够激活脑梗死亚急性期小胶质细胞,促进白介素1β,肿瘤坏死因子α等促炎细胞因子及趋化因子的分泌产生,加重脑组织炎症反应[16]。HISAYAMA等[17]研究报道,血清sTREM2水平升高能够显著增加血管性痴呆的发生风险。本研究中发现,血清sTREM2表达与患者NIHSS评分、mRS评分均呈显著正相关,与ADL评分呈显著负相关,表明血清sTREM2水平能够反映患者神经功能损伤严重程度,sTREM2水平越高,患者神经功能损伤越严重,日常生活活动能力较差。分析其原因,sTREM2能够诱导患者AIS后的神经系统炎症反应,加重神经元的损伤,导致患者神经功能障碍。有研究报道,TREM2能够通过激活小胶质细胞引起神经元溶酶体功能障碍、脂质及葡萄糖代谢失调,促进神经元突触丢失及神经元凋亡,降低星状胶质细胞的神经修复作用[18]。本研究中,sTREM2升高是影响AIS患者PSD发生的独立危险因素,提示血清sTREM2是新的评估AIS患者PSD发生风险的血清标志物。研究发现,小胶质细胞过度激活及脑组织炎症反应加重,能引起大脑海马区可塑性发生变化,导致患者焦虑抑郁等行为学异常。
海马齿状回的颗粒下区是影响成人神经发生的最重要的区域之一,在抑郁症的发生发展中起着重要作用。Wnt/β-连环蛋白信号通路参与调节海马神经元的发生和正常功能的维持,该通路的异常与抑郁症的发生密切相关[19]。DKK-1是经典Wnt信号通路中的抑制因子。有研究报道,AIS患者存在DKK-1表达升高的现象,其水平升高可增加PSD的发生风险[20]。本研究表明,PSD组患者血清DKK-1水平升高,提示DKK-1升高参与AIS患者PSD的发生。PSD组患者血清DKK-1水平升高的原因可能是AIS后,脑梗死灶及血小板激活引起DKK-1释放增多,DKK-1通过受损的血脑屏障进入外周血,引起血清DKK-1水平升高。而DKK-1的水平升高能够抑制β-连环蛋白的表达,诱导海马神经元的损伤,导致抑郁及学习认知功能损害的发生[21]。本研究中,血清DKK-1水平与PSD患者神经功能评分有关,提示血清DKK-1水平有助于反映PSD患者神经功能损伤严重程度。研究发现,DKK-1水平升高能够促进循环促炎细胞因子的释放,诱导神经元凋亡,加重患者神经功能损伤[22]。有学者发现,脑卒中患者脑组织中DKK-1表达升高能抑制糖原合成酶激酶-3β丝氨酸9的磷酸化,加重海马神经元的氧化应激损伤,导致海马学习和记忆受损[8]。本研究中,血清DKK-1水平升高是影响AIS患者PSD发生的独立危险因素,提示DKK-1是一种新的血清生物标志物,有助于评估AIS患者PSD的发生风险。有学者报道,过表达DKK-1能够通过抑制Wnt通路,降低海马CA1区神经元的突触可塑性,引起神经突触功能障碍或功能丧失,导致患者焦虑和抑郁的发生及学习记忆功能障碍[23]。此外,DKK-1表达升高还能够抑制血管内皮细胞的增殖和迁移,激活血管组织中基质金属蛋白酶9的表达,损伤血管壁组织,造成血脑屏障完整性丧失,大量促炎介质造成海马神经元损伤,导致PSD的发生[24]。本研究发现,血清sTREM2,DKK-1两者联合对AIS患者PSD的发生具有较高的诊断价值,其诊断的敏感度和特异度分别为0.768,0.923,提示联合检测AIS患者血清sTREM2,DKK-1水平有助于评估PSD的发生风险,临床上针对高危PSD患者早期干预治疗,以提高患者的生存质量,促进神经功能的恢复。
综上所述,并发PSD的AIS患者血清sTREM2,DKK-1水平升高,两者表达与NIHSS评分、mRS评分及ADL评分有关。血清sTREM2,DKK-1水平升高是AIS患者中PSD发生的独立危险因素,两者联合检测对AIS患者PSD的发生具有较高的预测价值。临床医师可根据AIS患者血清sTREM2和DKK-1水平对AIS患者PSD发生的风险进行分层,优化临床治疗方案,以减轻患者神经功能损伤程度,降低PSD发生风险,改善患者临床预后。此外,针对sTREM2,DKK-1为靶点的临床治疗能否有助于AIS患者PSD的治疗,值得今后进行深入研究。但本研究也存在一定的不足,本研究未能对AIS患者血清sTREM2,DKK-1水平动态变化进行检测,有待今后深入研究。
