NAFLD患者血清25(OH)D3,Vaspin和AIP水平及其与疾病严重程度的相关性研究
2023-12-01陕西省人民医院老年病科保健办西安710068
延 华,李 敏(陕西省人民医院 .老年病科;.保健办,西安 710068)
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是全球最常见的慢性肝病[1],以肝细胞脂肪变性和脂肪蓄积为特征的临床病理综合征。如不加以预防及治疗,最终可导致肝硬化和肝癌[2]。因此,早期识别和判断疾病的严重程度是目前研究的重点。25-羟维生素D3[25-hydroxy vitamin D3,25-(OH)D3]是人体维生素D的主要形式,反映机体是否缺乏维生素D[3],同时25-(OH)D3缺乏可能是NAFLD患者胰岛素抵抗的重要原因[4]。有研究发现脂肪因子Vaspin在NAFLD发病机制中起重要的作用[5]。25-(OH)D3可通过脂肪组织中维生素D受体对脂肪因子的释放产生积极或消极的影响[6]。NAFLD患者Vaspin水平可能下降以及抗炎、调节胰岛素抵抗的功能受损[7]。研究提示心血管疾病是NAFLD患者死亡的主要原因[8]。血浆动脉粥样硬化指数(atherogenic index of plasma,AIP),即三酰甘油(TG)与高密度脂蛋白-胆固醇(HDL-C)的比值,是预测心血管疾病的潜在生物标志物[9]。但目前较少有研究同时评价NAFLD患者上述三种指标与疾病之间的关系。故本研究旨在探索NAFLD患者25-(OH)D3,Vaspin水平、AIP之间的关系,以期为NAFLD治疗和预防提供新的手段和思路。
1 材料与方法:
1.1 研究对象 2021年1月~2023年1月陕西省人民医院收治的112例NAFLD患者作为NAFLD组,其中男性58例,女性54例,平均年龄42.15±4.73岁。纳入标准:①无饮酒史,男性折合乙醇量<140g/w,女性<70 g/w;②NAFLD诊断根据《非酒精性脂肪性肝病防治指南(2018年更新版)》的诊断标准[10],B超根据肝脏前场回声增强(“明亮肝”)、远场回声衰减,以及肝内管道结构显示不清楚的特征诊断脂肪肝;③在其他医院无相关治疗。排除标准:①病毒性肝炎、酒精性肝病、药物性肝病和肝豆状核变性患者;②患者孕期和哺乳期;③患有可引起脂肪肝的全肠外营养和自身免疫的患者;④近三个月内服用影响肝功能、钙磷代谢药物如类固醇激素、噻嗪类利尿剂、活性维生素D和二膦酸盐制剂等。选取同期健康体检人群110例作为对照组,其中男性57,女性53例,平均年龄43.12±4.61岁;两组基线比较差异无统计学意义(χ2=12.137,t=1.531,均P>0.05)。本研究经陕西省人民医院伦理委员会批准。参与本研究的患者有完整的临床资料。所有受试者及其家属签署知情同意书。
1.2 仪器与试剂 日立7060全自动生化分析仪(日本),25-(OH)D3和Vaspin 酶联免疫吸附试验试剂盒(瑞士罗氏公司),离心机(上海浦东天本离心机械有限公司)。
1.3 方法 测量患者的身高、体重、腰围(WC),计算体质量指数(BMI)。臀围测量了臀部最宽的部分,并确定了腰臀比(WHR)。
所有研究对象禁食12h,采静脉血6ml,室温放置30min。血清在1 500g,4 ℃下离心10min分离血清,-20℃保存统一检测。采用全自动生化分析仪测定血清空腹血糖(FPG)、空腹胰岛素(FINS)、三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白-胆固醇(LDL-C)、高密度脂蛋白-胆固醇(HDL-C)、丙氨酸氨基转移酶(ALT)及天门冬氨酸氨基转移酶(AST)。采用酶联免疫吸附试验(ELISA)测定25-(OH)D3和Vaspin 水平。所有操作严格按照操作说明及试剂说明书进行。采用稳态模式评估法测定胰岛素抵抗指数(HOMA-IR)。HOMAIR=FPG×FINS/22.5。动脉粥样硬化指数(AIP)计算为log(TG/HDL)。维生素D分类标准:25-(OH)D3<10 ng/ml为维生素D缺乏,10 ng/ml≤25-(OH)D3<30 ng/ml为维生素D不足,25-(OH)D3≥30 ng/ml为维生素D正常[11]。
1.4 统计学分析 采用SPSS17.0版统计软件进行统计分析。计量资料进行 K-S 正态性检验,符合正态分布的计量资料以均数±标准差(±s)表示,多组间比较行单因素方差分析,两两比较行SNK-q检验,两组间计量资料比较行独立样本t检验。计数资料以n(%)表示,组间比较采用χ2检验。Logistic多因素分析影响NAFLD严重程度的因素,采用偏相关分析来评估维生素D浓度与其他变量的相关关系。P<0.05为差异有统计学意义。
2 结果
2.1 NAFLD患者一般资料及与对照组临床指标比较 见表1。研究共纳入112例NAFLD患者,110例健康体检人群作为对照组。其中78例(69.64%)NAFLD患者25-(OH)D3缺乏或不足,NAFLD组患者BMI,WHR,TG,TC,LDL-C,ALT,AIP和HOMA-IR升高,而Vaspin 和25-(OH)D3水平降低,差异具有统计学意义(均P<0.05)。
表1 NAFLD患者和对照组临床指标比较[±s,n(%)]
项 目NAFLD组(n=112)对照组(n=110)t/χ2P BMI(kg/m2)27.32±3.3725.51±3.252.3230.033 WC(cm)85.18±9.2184.26±9.721.6310.382 WHR0.85±0.030.83±0.012.1450.035 TG(mmol/L)1.92±0.531.51±0.213.2670.003 TC(mmol/L)4.56±1.724.31±1.342.5320.025 LDL-C(mmol/L)2.76±0.652.17±0.533.1280.003 HDL-C(mmol/L)1.03±0.311.21±0.521.2930.421 ALT(U/L)24.27±18.3622.01±18.363.1340.012 AST(U/L)26.62±19.4725.18±17.260.9170.516 Vaspin(ng/ml)7.12±2.369.34±3.154.5420.002 25-(OH)D3缺乏或不足78(69.64)38(34.55)4.1250.003 25-(OH)D3 (ng/ml)17.24±5.5625.18±4.725.1630.001 AIP0.68±0.130.53±0.212.6250.023 HOMA-IR3.25±1.672.47±1.575.0410.001
2.2 不同严重程度脂肪肝患者临床指标比较 见表2。112例NAFLD患者中轻度脂肪肝患者52例(46.4%)、中度脂肪肝患者38例(38.9%),重度脂肪肝患者22例(19.6%)。与轻、中度NAFLD患者比较,重度患者BMI,WHR,TG,ALT,AIP和HOMA-IR升高,而Vaspin和25-(OH)D3水平降低,差异具有统计学意义(均P<0.05)。
表2 不同严重程度脂肪肝患者临床指标比较(±s)
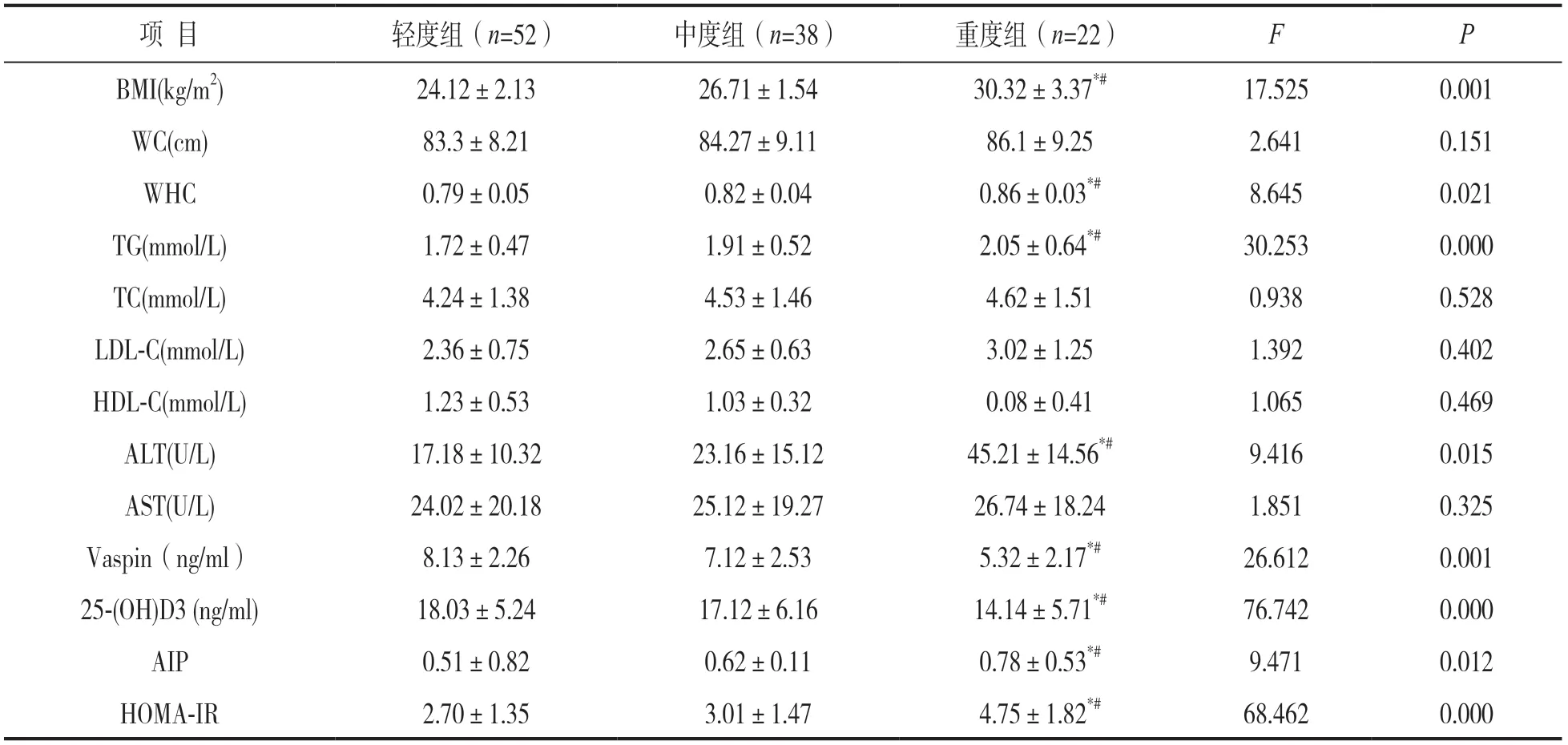
表2 不同严重程度脂肪肝患者临床指标比较(±s)
注:*与轻度组相比t=6.535,4.513,7.935,9.023,12.546,13.012,31.234,20.165,均P<0.05;#与中度组相比t=4.234,3.126,6.237,7.562,8.231,10.356,17.147,12.836,均P<0.05。
项 目轻度组(n=52)中度组(n=38)重度组(n=22)FP BMI(kg/m2)24.12±2.1326.71±1.5430.32±3.37*#17.5250.001 WC(cm)83.3±8.2184.27±9.1186.1±9.252.6410.151 WHC0.79±0.050.82±0.040.86±0.03*#8.6450.021 TG(mmol/L)1.72±0.471.91±0.522.05±0.64*#30.2530.000 TC(mmol/L)4.24±1.384.53±1.464.62±1.510.9380.528 LDL-C(mmol/L)2.36±0.752.65±0.633.02±1.251.3920.402 HDL-C(mmol/L)1.23±0.531.03±0.320.08±0.411.0650.469 ALT(U/L)17.18±10.3223.16±15.1245.21±14.56*#9.4160.015 AST(U/L)24.02±20.1825.12±19.2726.74±18.241.8510.325 Vaspin(ng/ml)8.13±2.267.12±2.535.32±2.17*#26.6120.001 25-(OH)D3 (ng/ml)18.03±5.2417.12±6.1614.14±5.71*#76.7420.000 AIP0.51±0.820.62±0.110.78±0.53*#9.4710.012 HOMA-IR2.70±1.353.01±1.474.75±1.82*#68.4620.000
2.3 影响NAFLD严重程度的Logistic多因素分析 见表3。以非酒精性脂肪肝为因变量,以BMI,WC,WHR,TG,TC,LDL-C,HDL-C,ALT,AST,Vaspin,25-(OH)D3,AIP和HOMA-IR为自变量,作多因素Logistic回归,其中BMI,TG,AIP和HOMA-IR为NAFLD危险因素,而Vaspin和25-(OH)D3则是NAFLD保护性因素,差异有统计学意义(均P<0.05)。

表3 影响NAFLD严重程度的Logistic多因素分析
2.4 血清25 (OH)D3水平与Vaspin,AIP和脂肪肝严重程度之间的相关性分析 研究显示25-(OH)D3水平与Vaspin,AIP和脂肪肝的程度具有显著相关性,血清25-(OH)D3水平与AIP,ALT,AST和HOMA-IR呈负相关(r=-0.32,-0.26,-0.34,-0.27,均P<0.05),而与Vaspin水平呈正相关(r=0.53,P=0.001)。
3 讨论
由于肥胖和代谢综合征的流行,非酒精性脂肪性肝病(NAFLD)的发病率逐年上升,已成为发达国家肝衰竭和肝细胞癌的重要原因[12]。肝脏是葡萄糖、蛋白质、脂肪三大营养物质代谢的重要场所,在胰岛素控制下维持机体能量的稳定。通常肝脏从血液中摄取游离脂肪酸合成TG,TG在肝脏内质网合成后,与载脂蛋白合成极低密度脂蛋白,由肝细胞分泌入血而转运至肝外。既往研究认为[2],胰岛素抵抗在NAFLD发病过程中起重要作用。发生胰岛素抵抗时,严重影响能量平衡和代谢,脂质过氧化使得三羧酸循环受到抑制,线粒体脂肪酸氧化能力降低,载脂蛋白缺乏,极低密度脂蛋白分泌出现障碍,加之一些细胞因子(如TNF-α)的参与,使得游离脂肪酸增加,从而TG沉积在肝脏中,形成脂肪肝。同时胰岛素抵抗还可加剧糖代谢紊乱,进而出现糖耐量受损和糖尿病的发生。肝脏不仅在糖脂代谢中有重要作用,而且也是25-(OH)D3生长的重要场所。本研究发现,与对照组比较,NAFLD组患者BMI,WHR,TG,TC,LDL-C,ALT,AIP和HOMA-IR升高,而25-(OH)D3,Vaspin水平降低。这与国内顾熙东等[13]的研究类似。表明NAFLD患者存在糖脂代谢、维生素D代谢紊乱和胰岛素抵抗。进一步与轻、中度脂肪肝组相比,重度脂肪肝组胰岛素抵抗和糖脂代谢相关指标升高,而Vaspin,25-(OH)D3水平降低。这提示25-(OH)D3,AIP,Vaspin和胰岛素抵抗可能参与NAFLD患者糖脂代谢紊乱的发生。维生素D和维生素D受体参与调节许多与炎症反应、胰岛素功能和代谢相关的机制,可能对NAFLD患者的葡萄糖耐量和胰岛素抵抗有影响,并直接或间接影响肝脏的功能。结合本研究,25-(OH)D3缺乏后,ALT,AST及HOMA-IR升高,胰岛素抵抗能够促进NAFLD发生,反之NAFLD又进一步加剧了患者胰岛素抵抗的程度,加重肝功能及糖脂代谢紊乱。
维生素D是一种多效激素,其功能超出了钙稳态调节和骨矿化,有研究表明维生素D参与介导许多免疫炎性和代谢过程[14]。维生素D活性形式25-(OH)D3和维生素D受体(VDR)轴已被研究证实与几个器官和组织的代谢途径紊乱有关,主要是与代谢调节有关的器官和组织,如骨骼肌、脂肪组织、胰腺和肝脏[15]。维生素D缺乏症的出现与胰岛素抵抗相关疾病的发生或发展有关,如代谢综合征和NAFLD[15-16]。SHARIFI等[17]人研究了补充维生素D对NAFLD患者血清转氨酶、胰岛素抵抗、氧化应激和炎症生物标志物的影响,结果显示25-(OH)D3可作为NAFLD患者的辅助治疗,减轻全身炎症和脂质过氧化。本研究提示NAFLD患者25-(OH)D3缺乏和不足者比例较高,与NAFLD呈负相关,这可能与NAFLD患者除肌肉水平外,肝脏和脂肪组织的胰岛素敏感性也降低,25-(OH)D3通过增加肌肉细胞中的胰岛素受体或提高胰岛素受体对胰岛素的敏感性及对过氧化物酶体增殖物激活受体δ的影响,提高胰岛素敏感性[18]。本研究Logistic多因素分析提示BMI,TG,AIP和HOMA-IR为危险因素,而25-(OH)D3是NAFLD保护性因素,进一步说明25-(OH)D3在NAFLD发生、发展中起到重要的作用。因此,补充维生素D可能改善NAFLD患者的胰岛素抵抗,进而可改善肝脏功能及糖脂代谢。
血浆动脉粥样硬化指数(AIP)是TG/HDL-C的一种转化,升高TG和/或降低HDL-C可以升高AIP。血脂异常是动脉粥样硬化的高危因素。AIP已被证明是比单一LDL-C或TC更有用的动脉粥样硬化和心血管风险的标志,可预测动脉粥样硬化和心血管疾病发生的风险。LORVAND AMIRI等[19]人研究发现在低热量饮食中补充维生素D12周后,HDL和TG水平有显著改善。DABBAGHMANESH等[20]人研究发现在补充25-(OH)D3三个月后,干预组和安慰剂组对比,只有干预组的高HDL-C水平在治疗结束后显著。在本研究中,我们观察到25-(OH)D3缺乏或不足的患者比25-(OH)D3充足的患者有更高的AIP值。进一步偏相关分析血清25-(OH)D3水平与AIP呈负相关。研究结果表明,25-(OH)D3缺乏可能增加血脂异常的风险。这可能的机制是脂质代谢异常通过肝脏脂肪积累而增加炎症、氧化应激的产生,在NAFLD的发病机制中发挥重要作用。固醇调节元件结合蛋白(sterol regulatory element-binding proteins,SREBPs)
是控制脂质稳态的转录因子,维生素D可能通过抑制SREBPs的激活来调节脂质代谢[21]。25-(OH)D3还可增加肠道钙的吸收,减少肝脏合成和分泌TG。由于不溶性钙-脂肪复合物的形成,肠道钙含量的增加会降低肠道对脂肪酸的吸收,从而影响NAFLD。
Vaspin是丝氨酸蛋白酶抑制剂家族成员,是一种胰岛素增敏的脂肪因子,在代谢性疾病中表达,以对抗胰岛素抵抗和炎症并发症,并可能在NAFLD的发生和进展中发挥抑制作用。有研究显示Vaspin与NAFLD患者的胰岛素抵抗、hs-CRP和IL-6之间存在显著相关性,提示在肥胖和胰岛素抵抗情况下具有抗炎作用[22]。AKTAS等[7]人研究认为Vaspin具有胰岛素增敏作用,提示其在肥胖炎症并发症中具有代偿作用。我们研究发现Vaspin在NAFLD中降低,并是ANFLD发生的危险因素,与25-(OH)D3呈正相关,可能vaspin通过调节细胞内钙离子浓度,影响了25-(OH)D3的代谢和作用,25-(OH)D3水平的降低又导致Vaspin表达的下降,二者相互影响[23]。
综上,NAFLD患者血清中25-(OH)D3低表达,与NAFLD的严重程度、AIP呈负相关,与Vaspin呈正相关,补充维生素D对NAFLD的防治具有指导作用。但本研究的样本中受试者的数量相对较少。其次,关于本研究的横断面设计,无法证实NAFLD患者所测得的脂肪因子水平与25-(OH)D3水平之间存在因果关系。脂肪因子和25-(OH)D3的确切联系需要在未来不同人群和更大样本量的研究中得到证实。
