乳腺癌患者血清NR3C2和DNMT3A表达水平及其诊断价值研究
2023-12-01张凌捷程爱群胡天华
张凌捷,葛 睿,程爱群,胡天华
(复旦大学附属华东医院普外科,上海 200040)
乳腺癌是全世界最常见的和最致命的女性恶性肿瘤之一,具有高度异质性的生物学和临床特征[1]。据统计,其发病率逐年上升,死亡率在女性恶性肿瘤中排名第二。近年来,尽管临床诊断和治疗体系有较大改善,但乳腺癌的复发和转移率仍较高,预后较差[3]。因此,仍需鉴定新的肿瘤生物标志物和治疗靶点,以提高乳腺癌的诊断和治疗水平。越来越多的研究表明,核受体亚家族C组成员2(nuclear receptor subfamily 3,group C,member 2,NR3C2)可以抑制某些肿瘤细胞的增殖、侵袭和迁移[4-5]。DNA甲基化转移酶-3A[DNA(cytosine-5)-methyltransferase 3A,DNMT3A]是一种负责DNA甲基化的蛋白质,参与DNA甲基化的从头建立,在肿瘤发生中起着至关重要的作用。DNA甲基化已被证明在乳腺癌的发展中起着极其重要的作用[6]。杨海荣等[7]人研究发现DNMT3A在宫颈癌中显著升高。本课题组前期研究发现,NR3C2和DNMT3A在乳腺癌患者血清中表达水平异常,而目前关于乳腺癌患者血清中NR3C2和DNMT3A的表达水平研究较少,且关于两者对乳腺癌的诊断价值更是鲜有报道。因此,本文检测乳腺癌患者血清中NR3C2和DNMT3A的表达水平,并分析其临床意义,以期为乳腺癌的早期临床诊断提供参考。
1 材料与方法
1.1 研究对象 收集复旦大学附属华东医院2017年5月~2020年12月期间住院的94例乳腺癌患者为乳腺癌组,全为女性,患者年龄45~72(60.50±5.62)岁。收集一般临床资料,包括肿瘤部位、TNM分期、肿瘤直径、淋巴结转移、组织分化程度等。另选取同期86例女性健康体检者为对照组,年龄40~68(59.50±5.28)岁。两组年龄比较差异无统计学意义(t=1.227,P>0.05)。纳入标准:①乳腺癌组均经病理活检确诊为乳腺癌;②临床资料完整;③患者术前未接受放疗或化疗。排除标准:①并发其他脏器功能障碍;②并发炎性乳腺癌或其他部位恶性肿瘤。本研究经患者及家属签署知情同意书,且经本院伦理委员会批准。
1.2 仪器与试剂 人NR3C2酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒(批号:E0158h),人DNMT3A ELISA试剂盒(批号:E13889h)[伊艾博(武汉)科技股份有限公司];酶标仪[型号:SpectraMax i3x,美谷分子仪器(上海)有限公司]。
1.3 方法 采用ELISA法检测血清NR3C2,DNMT3A水平。收集所有患者入院后次日清晨空腹外周静脉血3~4 ml,对照组体检时采集当日空腹时静脉血3~4 ml,5 000 r/min离心8 min,留取上清液,于-20℃冰箱中保存,待检。血清NR3C2和DNMT3A的测定严格按照ELISA试剂盒说明书操作。
1.4 统计学分析 采用SPSS25.0分析本研究数据。其中计数资料以n(%)表示,组间比较采用χ2检验;计量资料均符合正态分布,以均数±标准差(±s)表示,组间比较采用独立样本t检验;Pearson法分析乳腺癌患者血清NR3C2和DNMT3A表达水平相关性;多因素Logistic回归分析影响乳腺癌发生的因素;受试者工作特征(receiver operating characteristic,ROC)曲线分析血清NR3C2与DNMT3A诊断乳腺癌的价值。P<0.05为差异具有统计学意义。
2 结果
2.1 两组血清NR3C2与DNMT3A水平比较 乳腺癌组患者血清NR3C2水平为317.84±33.47 ng/L,低于对照组(374.25±47.72ng/L),DNMT3A的表达水平为451.63±75.47 μg/L,高于对照组(349.85±63.72 μg/L),差异具有统计学意义(t=9.243,9.729,均P<0.05)。
2.2 NR3C2与DNMT3A表达水平与乳腺癌组患者临床病理特征的关系 见表1。根据乳腺癌患者血清中NR3C2与DNMT3A表达水平均值分为NR3C2低表达(n=53,NR3C2<317.84ng/L)与NR3C2高表达(n=41,NR3C2≥317.84ng/L),DNMT3A低表达(n=43,DNMT3A<451.63μg/L)与DNMT3A高表达(n=51,DNMT3A≥451.63μg/L)。结果表明,NR3C2,DNMT3A高表达组与低表达组在TNM分期、淋巴结转移、组织分化之间差异具有统计学意义(均P<0.05)。
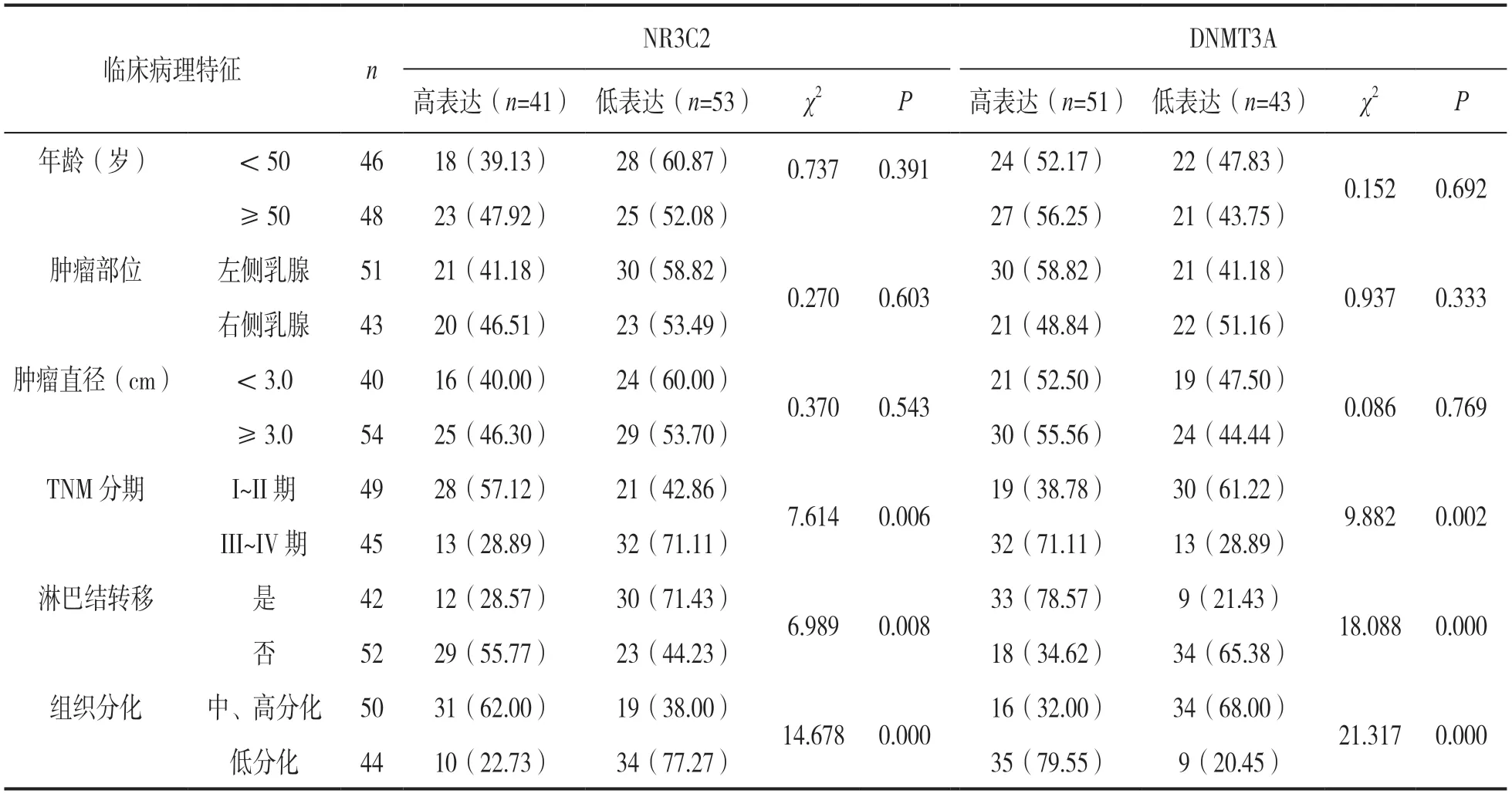
表1 NR3C2与DNMT3A表达与临床病理特征之间的关系[n(%)]
2.3 乳腺癌患者血清NR3C2,DNMT3A表达水平相关性 见图1。Pearson分析结果显示,乳腺癌患者血清NR3C2与DNMT3A表达水平存在明显负相关(r=-0.501,P=0.000)。
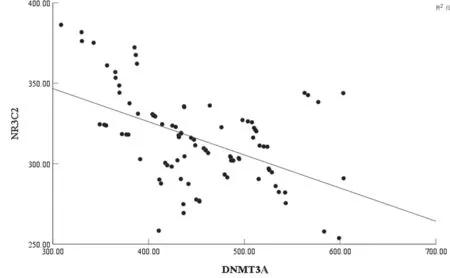
图1 乳腺癌患者血清NR3C2,DNMT3A表达水平相关性
2.4 多因素Logistic回归分析乳腺癌发生影响因素见表2。以乳腺癌是否发生为因变量,以血清NR3C2,DNMT3A水平为自变量,行多因素Logistic回归分析。结果显示,NR3C2高水平为乳腺癌发生的保护因素(P<0.05),DNMT3A高水平是乳腺癌发生的危险因素(P<0.05)。
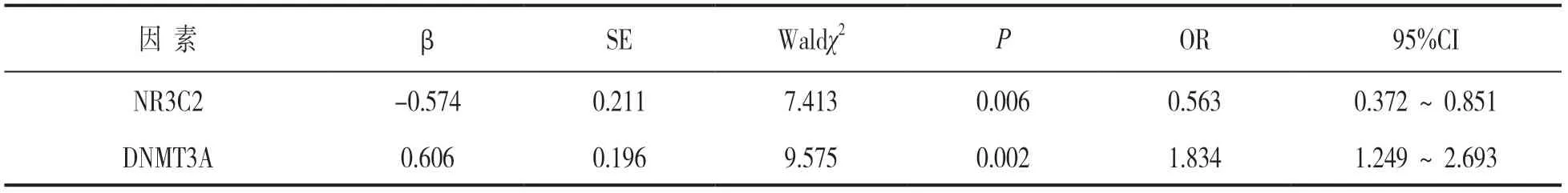
表2 多因素Logistic回归分析乳腺癌发生的影响因素
2.5 血清NR3C2与DNMT3A水平评估乳腺癌的诊断价值 见表3。ROC曲线发现,血清NR3C2与DNMT3A诊断乳腺癌的最佳截断值分别为334.828 ng/L和413.223 μg/L,曲线下面积(area under curve,AUC)分别为0.853和0.930,当两者联合时其AUC为0.969,高于两者单独检测(Z=3.460,1.894,P=0.000,0.034)。
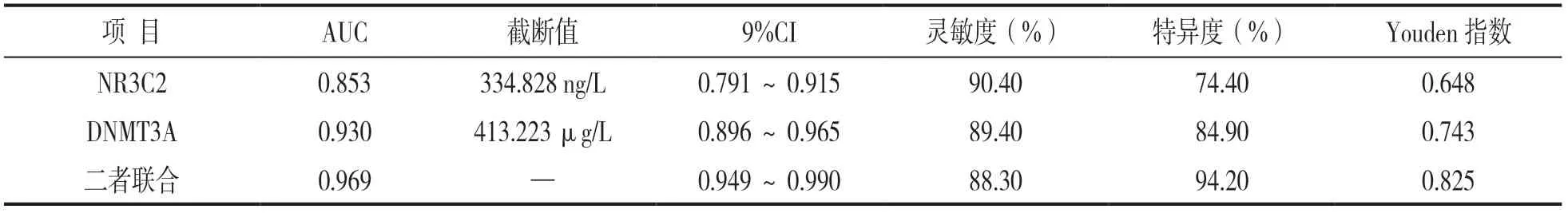
表3 血清NR3C2与DNMT3A水平对乳腺癌的诊断价值评估
3 讨论
乳腺癌是女性最常见和最致命的癌症[8]。在发展中国家和发达国家,乳腺癌的发病率和死亡率仍在上升[9-10]。虽然强化化疗、放疗和靶向治疗使乳腺癌患者的预后得以改善,但其仍是全球癌症死亡的第五大原因[11]。因此,迫切需要寻找生物标志物来诊断和准确地预测乳腺癌。
核受体亚家族C组成员2(NR3C2)可以抑制某些肿瘤细胞的增殖、侵袭和迁移[4-5]。被定义为一种盐皮质激素受体基因,编码肾上腺皮质激素受体[11]。作为转录依赖性因子,肾上腺皮质激素受体可以与盐皮质激素反应元件结合,介导醛固酮对受限靶细胞盐和水平衡的影响。近期研究表明,NR3C2在几种类型的癌症中下调,并且已被证明具有抑制作用,例如,NR3C2在结肠癌细胞中的表达下调,NR3C2的过表达抑制了结肠癌细胞的增殖、迁移、侵袭和血管生成[12]。另一项研究发现,NR3C2在肺腺癌、大细胞肺癌也呈现低表达[13]。PENG等[14]人研究发现NR3C2的低表达与乳腺癌患者的预后不良密切相关。LU等[15]人也研究报道,与正常乳腺组织相比,浸润性乳腺癌组织中NR3C2的表达水平降低。因此,我们推测NR3C2在乳腺癌患者表达降低。本研究结果显示,与对照组相比,乳腺癌组患者血清NR3C2的表达水平显著降低,表明NR3C2高表达能够抑制乳腺癌肿瘤的发生、发展。与上述结果一致。
DNA低甲基化或高甲基化以及染色质重塑与乳腺癌发展和恶性进展密切相关。例如,DNA甲基化转移酶-3A(DNMT3A)在乳腺瘤中的表达高于纤维腺瘤[16]。还有报道DNMT3A在乳腺肿瘤组织中比相邻的正常标本表达高[17]。此外,与原发性乳腺癌患者相比,DNMT3A在具有脑转移瘤的乳腺癌中具有高表达[18]。同样,本研究结果发现,与对照组相比,乳腺癌组患者血清DNMT3A的表达水平显著升高,表明DNMT3A对于乳腺癌发病进程具有促进作用。另外,Pearson相关性分析结果显示,乳腺癌患者血清中NR3C2与DNMT3A表达水平呈显著负相关,推测二者可能是直接或间接参与调控乳腺癌细胞增殖、迁移、侵袭过程中关键因子表达,共同影响乳腺癌的进程。但其具体调控机制尚未明确。经Logistic回归分析结果显示,NR3C2高水平为乳腺癌发生的保护因素,DNMT3A高水平,TNM分期(III~IV期)、淋巴结转移以及组织低分化均是乳腺癌发生的危险因素,表明NR3C2低水平、DNMT3A高水平与乳腺癌的发生密切相关,下一步研究可通过体内外实验验证两者关系,为乳腺癌的治疗提供新的思路。ROC曲线结果发现,血清NR3C2与DNMT3A诊断乳腺癌的AUC分别为0.853和0.930,当两者联合时其AUC为0.969,高于两者单独检测,表明两者联合检测对于乳腺癌的诊断具有较高的价值。
综上所述,乳腺癌患者血清中NR3C2表达水平降低,DNMT3A表达水平升高,与乳腺癌的发生、发展密切相关,且两者联合检测对于诊断乳腺癌的发生具有较高的价值,NR3C2与DNMT3A有望作为诊断乳腺癌的特异度指标。但本研究并未对NR3C2,DNMT3A与乳腺癌病理机制的关系进行研究,后续需进一步深入研究。
