脓毒症急性肾损伤患者血清USF2和THBS1表达水平及其诊断价值研究
2023-12-01赵瑞臣陈春燕中国人民解放军西藏军区总医院急诊医学科检验科拉萨850007
赵瑞臣,陈春燕,何 琴(中国人民解放军西藏军区总医院.急诊医学科;.检验科,拉萨 850007)
脓毒症(sepsis)是细菌等病原微生物侵入人体而引起的全身性炎症反应综合征,肾脏是脓毒症常见的受损靶器官,表现为脓毒症相关的急性肾脏损伤(acute kidney injury,AKI),大约三分之一的脓毒症患者会发展为AKI[1]。AKI是脓毒症患者死亡和不良预后的危险因素之一,早期诊断可为临床治疗决策提供依据[2]。研究显示上游刺激因子2(upstream stimulatory factor 2,USF2)通过与血小板应答蛋白-1(thrombospondin 1,TSP-1)基因启动子中的一个18 bp序列结合,调节肾系膜细胞TSP-1表达和转化生长因子-β(transforming growth factor-β,TGF-β)活性,促使促凋亡基因bax表达,诱导肾系膜细胞凋亡,USF2过表达被认为与糖尿病肾病发展密切相关[3]。血小板反应蛋白-1(thrombospondin-1,THBS1)是血小板反应蛋白家族的重要成员,具有调节细胞增殖、黏附和凋亡等多种作用。研究显示THBS1和其特异性受体CD47组成的细胞信号通路参与肾脏发病过程[4]。血清USF2和THBS1是否与脓毒症AKI发病有关尚不清楚,目前少有报道。鉴于此,本研究通过检测脓毒症患者血清USF2,THBS1水平,分析其在诊断脓毒症AKI的价值。
1 材料与方法
1.1 研究对象 选取2020年10月~2022年10月中国人民解放军西藏军区总医院急诊医学科收治的109例脓毒症患者,男性68例,女性41例,年龄41~65(50.67±9.29)岁;严重脓毒症86例,脓毒症休克23例。纳入标准:①符合欧洲危重病医学会制定脓毒症3.0诊断标准[5];②年龄18~70周岁。排除标准:①既往脓毒症;②既往肾病综合征、肾小球肾炎、肾癌等原发性肾脏疾病病史;③血液透析病史和肾移植手术史;④并发恶性肿瘤、血液系统、免疫系统疾病;⑤入住ICU后48h内死亡。参考KDIGO急性肾损伤临床实践指南拟定的标准[6],将患者分为AKI组(n=45)和非AKI组(n=64)。AKI组男性25例,女性20例,年龄40~65(53.19±7.42)岁,体质量指数20~28(24.17±3.25)kg/m2;基础疾病:糖尿病23例,高血压21例,高脂血症18例;感染部位:泌尿系统感染11例,血流感染17例,腹腔感染9例,其它8例;脓毒症分级:严重脓毒症28例,脓毒症休克17例。非AKI组男性43例,女性21例,年龄40~66(50.12±7.02)岁,体质量指数20~29(24.02±3.17)kg/ m2;基础疾病:糖尿病26例,高血压25例,高脂血症20例;感染部位:泌尿系统感染15例,血流感染25例,腹腔感染13例,其它11例;脓毒症分级:严重脓毒症58例,脓毒症休克6例。两组性别、体质量指数、基础疾病、感染部位比较差异无统计学意义(t/χ2=1.523,0.241,1.174,0.626,0.891,0.121,均P>0.05)。AKI组年龄、脓毒症休克比例高于非AKI组,差异有统计学意义(t/χ2=2.196,12.803,均P<0.05)。本研究获得中国人民解放军西藏军区总医院伦理会批准,患者及其家属均知情同意并签署同意书。
1.2 仪器与试剂 KA-2200血清专用离心机(日本久保田),超低温冰箱(Thermo Fisher公司),ABI7900HT快速PCR实时系统(美国Applied Biosystems公司),SpectraMax® iD5 多功能酶标仪(上海美谷分子仪器有限公司),AU400全自动生化分析仪(日本Olympus公司),TRIzol试剂盒(美国Invitrogen公司),M-MLV逆转录酶试剂盒(美国Epicentre 公司),THBS1试剂盒(河南鑫源生物科技有限公司),CRP试剂盒(武汉赛培生物科技公司),PCT试剂盒(上海研启生物科技公司),引物由上海生工生物科技有限公司设计合成。
1.3 方法
1.3.1 血清USF2表达检测:采集所有患者入院24h空腹静脉血3ml,3 000r/min离心15min,取上清液,TRIzol一步法提取总RNA,反转录合成cDNA后进行荧光定量PCR反应。USF2上游引物:5’-ATGGACATGCTGGACCCGGGTC-3’,下游引物:5’-TCACTGCCGGGTGCCCTCGCCC-3’;GAPDH上游引物:5’-GGGAGCCAAAAGGGTCAT-3’,下游引物:5’-GAGTCCTTCCACGATACCAA-3’。反应体系:cDNA1μl,上下游引物各0.4μl,2×Trans Taq® Tip Green qPCR SuperMix 10μl,Passive Reference Dye ( 50×) 0.4μl,最后添加双蒸水至20μl。反应条件:95℃变性15s,65℃退火20s;75℃延伸15s,共40个循环。以GAPDH为内参,血清USF2相对表达量采用2-ΔΔCt方法表示。
1.3.2 血清THBS1及肾功能指标检测:采用酶联免疫吸附试验检测血清THBS1。全自动生化分析仪检测血清尿素氮(blood urea nitrogen,BUN)、血肌酐(serum creatinine,sCr)和胱抑素C(cystatin C,CysC)水平。
1.3.3 临床资料收集:采集患者年龄、性别、体质量指数、基础疾病、感染部位、脓毒症分级、C反应蛋白(C-reactive protein,CRP)、降钙素原(procalcitonin,PCT)、急性生理与慢性健康状况评分Ⅱ(acute physiology and chronic health evaluation Ⅱ,APACHE Ⅱ)评分[7]和序贯器官衰竭评分(sequential organ failure assessment,SOFA)[8]。APACHE Ⅱ评分根据体温、心率、呼吸、平均动脉压、血氧分压、电解质、肌酐、白细胞计数、神经功能等最差值计算,SOFA根据患者呼吸系统、血液系统、肝(胆红素)、循环系统、神经系统、肾(肌酐、尿量)最差值计算。
1.4 统计学分析 采用SPSS 25.00分析数据,计量资料符合正态分布以均数±标准差(±s)表示,组间比较采用独立样本t检验。计数资料以率(%)表示,采用χ2检验。Pearson分析血清USF2,THBS1与肾功能指标之间的相关性,多因素Logistic回归分析脓毒症发生AKI的危险因素。受试者工作特征(receiver operator characteristics curve,ROC)曲线分析血清USF2和THBS1对脓毒症发生AKI的诊断价值。P<0.05为差异有统计学意义。
2 结果
2.1 各组临床指标及血清USF2,THBS1水平比较 见表1。AKI组血清BUN,sCr,CysC,CRP,PCT,USF2,THBS1水平、APACHEⅡ评分和SOFA评分均高于非AKI组,差异具有统计学意义(均P<0.05)。
表1 各组临床指标及血清USF2,THBS1水平比较(±s)
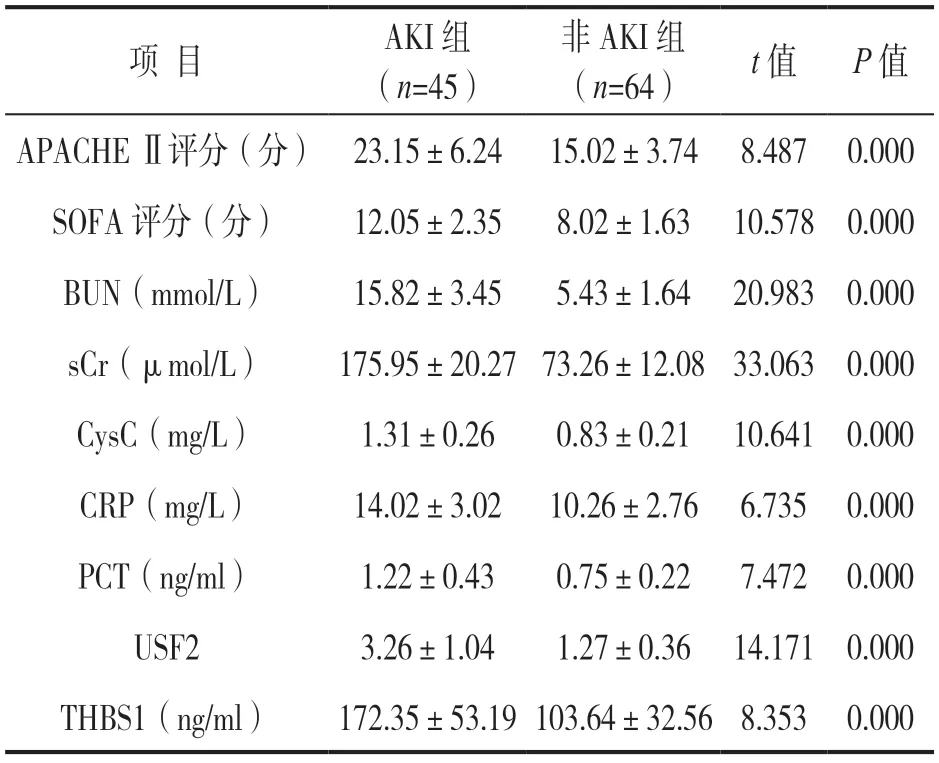
表1 各组临床指标及血清USF2,THBS1水平比较(±s)
项 目AKI组(n=45)非AKI组(n=64)t值P值APACHE Ⅱ评分(分)23.15±6.2415.02±3.748.4870.000 SOFA评分(分)12.05±2.358.02±1.6310.5780.000 BUN(mmol/L)15.82±3.455.43±1.6420.9830.000 sCr(μmol/L)175.95±20.2773.26±12.0833.0630.000 CysC(mg/L)1.31±0.260.83±0.2110.6410.000 CRP(mg/L)14.02±3.0210.26±2.766.7350.000 PCT(ng/ml)1.22±0.430.75±0.227.4720.000 USF23.26±1.041.27±0.3614.1710.000 THBS1(ng/ml)172.35±53.19103.64±32.568.3530.000
2.2 血清USF2,THBS1与肾功能指标的相关性AKI患者血清USF2,THBS1与BUN,sCr,CysC呈正相关(r=0.619,0.507,0. 432;0.596,0.607,0.547,均P<0.05),差异具有统计学意义。
2.3 脓毒症患者发生AKI的影响因素 见表2。以年龄、BUN,sCr,CysC,CRP,PCT,USF2,THBS1,脓毒症休克(赋值:0=否,1=是)、APACHE Ⅱ评分、SOFA评分为自变量,是否发生AKI(赋值:0=否,1=是)为因变量纳入Logistic回归分析,结果发现,高SOFA评分、高USF2、高THBS1是脓毒症患者发生AKI的危险因素(均P<0.05)。

表2 脓毒症患者发生AKI的影响因素分析
2.4 血清USF2,THBS1及联合检测对脓毒症AKI的诊断价值 见表3,图1。血清USF2,THBS1诊断脓毒症AKI的曲线下面积(area under the curve,AUC)分别为0.755,0.778,血清USF2和THBS1联合诊断脓毒症AKI的AUC为0.947,高于单一指标诊断,差异具有统计学意义(Z=3.592,4.024,P=0.032,0.021)。
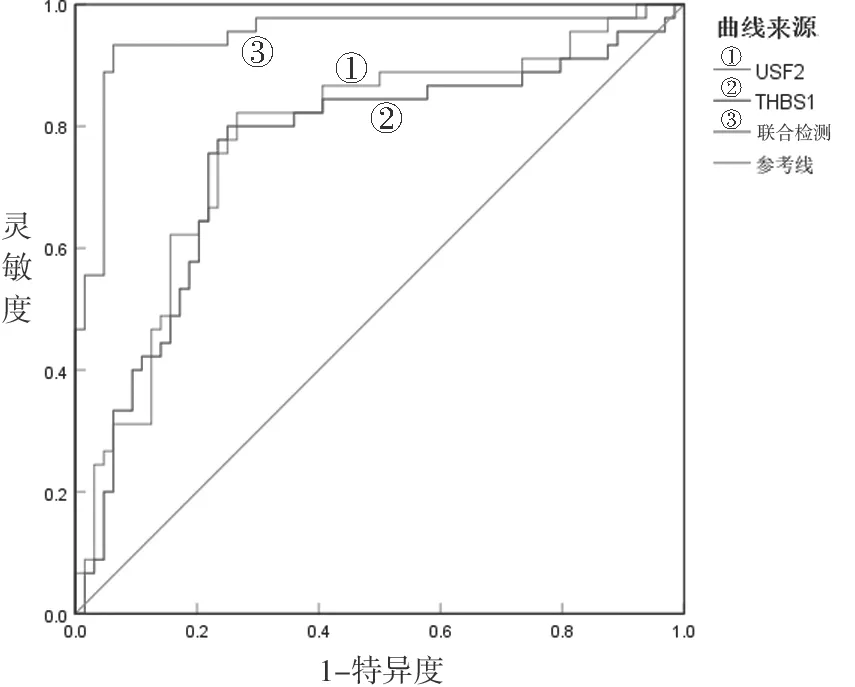
图1 血清USF2,THBS1及联合检测的ROC曲线

表3 血清USF2,THBS1及联合检测对脓毒症AKI的诊断价值
3 讨论
急性肾损伤(AKI)是最常见的脓毒症相关急危重症之一,与更长的住院时间以及更高的死亡风险有关[9]。早期识别脓毒症AKI可为临床提供支持性治疗,限制病情进一步进展。目前AKI的诊断主要依靠血清肌酐浓度的增加和/或尿量的减少,但是脓毒症会减少肌肉灌注,从而降低肌酸的产生,抑制血清肌酐浓度的升高,因此血清肌酐对AKI并不十分敏感,而少尿在脓毒症相关AKI中也是非特异性,利尿剂的使用可能会限制少尿在AKI诊断中的应用价值,因此亟需探寻新的生物学标志物。脓毒症AKI发病机制复杂,目前认为是感染刺激肾小管上皮细胞表面与细胞膜结合的模式识别受体激活,启动下游信号级联反应,导致促炎分子合成和释放,引起氧化应激、线粒体损伤,单核细胞活化,并在肾小球和肾小管周围浸润,使肾血管血流减慢,最终导致全肾血流减少和继发性肾小管上皮细胞死亡或急性肾小管坏死[1,10]。
USF2是一种参与多种细胞过程的转录因子,属于基本螺旋-环-螺旋亮氨酸拉链结构的转录因子家族,通过与靶基因中DNA-核心序列的e-box结合充当同二聚体或异二聚体,在应激、免疫反应、能量代谢、昼夜节律以及细胞生长发育过程中扮演转录激活子或转录抑制子角色[11]。现有研究显示USF2作为硫氧还蛋白还原酶1的转录抑制因子,直接与其启动子中两个e-box位点相互作用抑制硫氧还蛋白还原酶1表达,减少肝癌细胞增殖和转移,发挥抗肿瘤作用[12]。USF2还是辅助性T细胞17信号通路的上游调节因子,USF2表达上调通过激活T细胞17信号通路,导致促炎细胞因子白介素-17A,干扰素-γ,白介素-22和粒细胞-巨噬细胞集落刺激因子表达,引起类风湿关节炎[13]。USF2与肾脏疾病也存在密切关系,在单侧输尿管梗阻所致肾脏纤维化模型中USF2表达显著增加,USF2过表达可通过激活转化生长因子-β1(transforming growth factor-β1,TGF-β1)/Smad信号通路,激活后的Smad和p53结合诱导细胞表达I型纤溶酶原激活物抑制剂,促进胶原的分泌和肾小管间质纤维化进程[14]。本研究发现AKI组血清USF2水平较非AKI组升高,血清 USF2与BUN,sCr,CysC 呈正相关,高USF2表达是脓毒症AKI的危险因素。分析USF2参与脓毒症AKI的机制为:TGF-β在细胞生长、分化、细胞外基质沉积、免疫应答和纤维化中起关键作用,活性TGF-β1与其II型受体结合,激活I型受体和下游效应因子Smad2和Smad3,诱导肾细胞凋亡、坏死、氧化应激和炎症细胞间质浸润,加重缺血性肾损伤,导致AKI发生[15]。而USF2是TGF-β/Smad信号通路的上游调控因子,通过与TSP-1基因启动子结合上调TGF-β活性,激活TGF-β/Smad信号通路[16],因此USF2过表达可激活TGF-β/Smad信号通路参与AKI过程。
THBS1主要存在于血小板的α-颗粒中,在凝血酶激活血小板后被释放到外周血循环以及周围微环境中,先天免疫细胞、内皮细胞、血管平滑肌和上皮细胞在损伤或应激后也可诱导THBS1的表达,参与调节血管反应性和血管生成、血小板激活、炎症、氧化应激、伤口愈合和肿瘤发生等多种病理生理过程[17]。研究显示THBS1通过促进上皮-间质转化促进结直肠癌细胞迁移、侵袭以及肝转移[18]。THBS1还可结合并激活内质网应激效应因子-蛋白激酶R样内质网激酶,诱导其下游活化转录因子4表达,介导细胞自噬和心肌萎缩[19]。在肾脏疾病中THBS1也发挥重要作用,THBS1通过和其高亲和力受体CD47结合激活TGF-β信号通路,增强连接素-γ和上皮型钙黏蛋白之间相互作用,促使上皮-间质转化和纤维化[20],另THBS1作为一种天然的血管生成抑制剂,还可抑制血管内内皮生长因子表达,降低微血管密度,促使肾间质纤维化的发展[21]。本研究发现AKI组血清THBS1较非AKI组升高,血清THBS1与BUN,sCr,CysC 呈正相关,高THBS1表达是脓毒症AKI的危险因素。分析THBS1参与脓毒症AKI的机制为:首先,THBS1通过与CD47结合激活TGF-β/Smad信号通路,诱导肾缺血性损伤,导致肾上皮细胞坏死和凋亡[18],其次,脓毒症期间NOD样受体家族含pyrin结构域蛋白3(NOD-like receptor family pyrin domain containing 3,NLRP3)激活产生活性Caspase-1,随后产生白介素-1β和白介素-18,促使炎症级联反应和肾组织损伤[22],THBS1激活TGF-β/Smad/NLRP3/Caspase-1信号通路,促进氧化应激反应,刺激焦亡,导致肾损伤[23]。
ROC分析显示血清USF2,THBS1诊断脓毒症AKI的AUC为0.755,0.778,灵敏度和特异度均达70%以上,表明USF2,THBS1在脓毒症AKI诊断中具有一定价值,当联合两项指标后诊断脓毒症AKI的效能显著提高,提示USF2,THBS1可能作为脓毒症AKI的潜在标志物。回归分析高SOFA评分与脓毒症AKI发生也有关,SOFA评分是通过测定主要器官功能损伤的程度对患者进行预后判断的评分系统,肾脏功能受全身各个脏器的影响较大,比如,肾脏对自身血流非常敏感,当心脏泵血功能下降,血液流经肾脏量减少时,可导致肾脏灌注不足,引起肾功能下降,因此SOFA评分越高,肾损伤的可能性越大,并发AKI风险越高。
综上,脓毒症AKI患者血清USF2和THBS1水平均显著增高,两者与脓毒症患者肾功能下降以及AKI的发生有关,血清USF2和THBS1联合检测在脓毒症AKI诊断中具有较高的价值。但本研究尚存在不足,本研究样本例数较少,有待今后扩大样本例数,开展多中心研究加以验证。
