原发性肾病综合征患儿治疗前后外周血CXCL13和PD-L1+B淋巴细胞水平变化及临床意义研究
2023-12-01邯郸市中心医院病案科内分泌科生殖科河北邯郸056000
胡 洋,扬 力,陈 静(邯郸市中心医院.病案科;.内分泌科;.生殖科,河北邯郸 056000)
原发性肾病综合征(primary nephrotic syndrome,PNS)是儿童常见的肾小球疾病之一,首选用药为糖皮质激素治疗,但是约90%患儿会在治疗过程中出现激素依赖和复发,PNS病情进展与激素耐药和激素依赖有关[1-2]。近年有研究表明,PNS发病与免疫功能紊乱关系密切,细胞免疫和体液免疫功能异常同时存在[3-4]。临床研究也发现,B淋巴细胞耗竭剂利妥昔单抗治疗能有效降低难治性PNS复发频次[5-6],提示B淋巴细胞功能异常参与PNS发病。趋化因子C-X-C基序配体13(chemokine C-X-C motif ligand 13,CXCL13)是B淋巴细胞趋化因子,可吸附、直接调控B细胞的成熟和发育,参与机体免疫系统信号传递[7]。CXCL13/CXCR5共同作用参与外周循环B淋巴细胞归巢到淋巴结的过程,并促进次级淋巴结内B淋巴细胞分化为浆细胞,调控体液免疫[8]。程序性死亡受体配体1(programmed death protein ligand 1,PD-L1)与程序性死亡受体1(programmed cell death protein 1,PD-1)结合可抑制机体免疫细胞分泌细胞因子[9]。有学者报道,B细胞膜上表达的PD-L1与PD-1表达阳性的T细胞结合,可以抑制T淋巴细胞的活化增殖及间接影响生发中心B细胞的形成和发展[10]。实体肿瘤中也证实,调节性B细胞膜上PD-L1高表达,通过PD-1/PD-L1轴能够抑制T细胞对肿瘤细胞的免疫抑制作用[9]。目前有关PNS与B淋巴细胞功能异常的研究有限,本文探究了PNS患儿治疗前后外周血中CXCL13和PD-L1+B淋巴细胞水平变化,并讨论了PNS免疫功能紊乱的可能机制,期望为儿童PNS研究提供新的参考。
1 材料与方法
1.1 研究对象 选取2022年4~12月邯郸市中心医院收治的激素敏感型初发PNS患儿52例进行研究,男性35例,女性17例,年龄2.36~12.05(6.43±2.61)岁;诊断符合2016 版《儿童激素敏感、复发/依赖肾病综合征诊治指南》[11]的标准,入院后给予糖皮质激素治疗。排除入院前使用免疫制剂或糖皮质激素治疗患儿;①并发感染、免疫性疾病、内分泌疾病及恶性肿瘤等继发性因素;②并发其他肾脏疾病史和继发性PNS。另选取同期本院健康体检儿童30例为对照,男性19例,女性11例,年龄2.14~12.10 (6.52±2.73)岁。两组性别、年龄比较差异无统计学意义(t/χ2=0.148,0.134,P=0.833,0.715)。所有家属知情并签署知情同意书。
1.2 主要试剂与仪器 BV650标记的抗人CD19抗体,FITG标记的抗人PD-L1抗体(Biolegend公司);LSRFortessaTM型流式细胞仪(美国 BD Biosciences公司);酶联免疫吸附法检测试剂盒(上海酶联生物技术有限公司)。
1.3 方法
1.3.1 治疗方法与疗效判定:所有患儿均给予醋酸泼尼松片(江苏恒瑞制药有限公司,生产批号200226),按照患儿体重2 mg/(kg·d),分3次口服,服用4周后开始逐渐减量,每4周减5.0 mg,治疗6个月。疗效判定:完全缓解以血生化、尿检完全正常为标准。
1.3.2 外周血B细胞及PD-L1+B淋巴细胞检测:收集所有儿童晨起空腹静脉血2 ml,EDTA抗凝,密度梯度离心法分离单个核细胞,2 500 r/min离心弃上清,PBS洗涤2次,用PBS重悬细胞调整浓度为1×106个/ml,吸取100 μl,加入CD19-BV650,PDL1-FITC抗体各1 μl混匀,每个对照组管加入抗FITC,BV650标记的同型抗体,室温避光孵育30 min,加入红细胞裂解液,混匀静置15 min,加入2 ml PBS,离心弃上清,于流式细胞仪检测外周血中总B细胞(CD19+B)及PD-L1+B淋巴细胞百分比,用Cell Quest软件进行分析。
1.3.3 血清CXCL13,sPD-L1及细胞因子水平检测:收集所有儿童晨起空腹静脉血6 ml,EDTA抗凝,2 500 r/min离心取上清液,采用酶联免疫吸附法分别检测患儿血清中CXCL13和可溶性PD-L1(sPD-L1),同时检测两组转化生长因子-β1(TGF-β1)、肿瘤坏死因子-α(TNF-α)、白细胞介素-10(IL-10)和白细胞介素-1β(IL-1β)等细胞因子水平。
1.3.4 临床数据收集:收集患儿血清清蛋白(albumin,ALB)、24h尿蛋白定量、血尿素氮(blood urea nitrogen,BUN)、血肌酐(serum creatinine,Scr)、总T细胞计数(CD3+T)、免疫球蛋白G(immunoglobulin G,IgG)和免疫球蛋白M(immunoglobulin M,IgM)水平。
1.4 统计学分析 采用SPSS 25.0统计分析软件。对计量资料进行K-S检验显示均方差齐性符合正态分布,数据以均数±标准差 (±s) 表示,两组间比较采用独立样本t检验,PNS组治疗前后比较采用配对样本t检验。PNS患儿外周血PD-L1+B淋巴细胞和CXCL13及与实验室指标的相关性采用Pearson相关分析。以P<0.05为差异有统计学意义。
2 结果
2.1 两组临床实验室指标比较 见表1。与健康对照组比较,PNS组ALB和IgG水平降低,24h尿蛋白定量及IgM和总T细胞计数升高,差异有统计学意义(均P<0.05),两组Scr,BUN比较差异无统计学意义(均P>0.05)。
表1 两组临床实验室指标水平比较(±s)
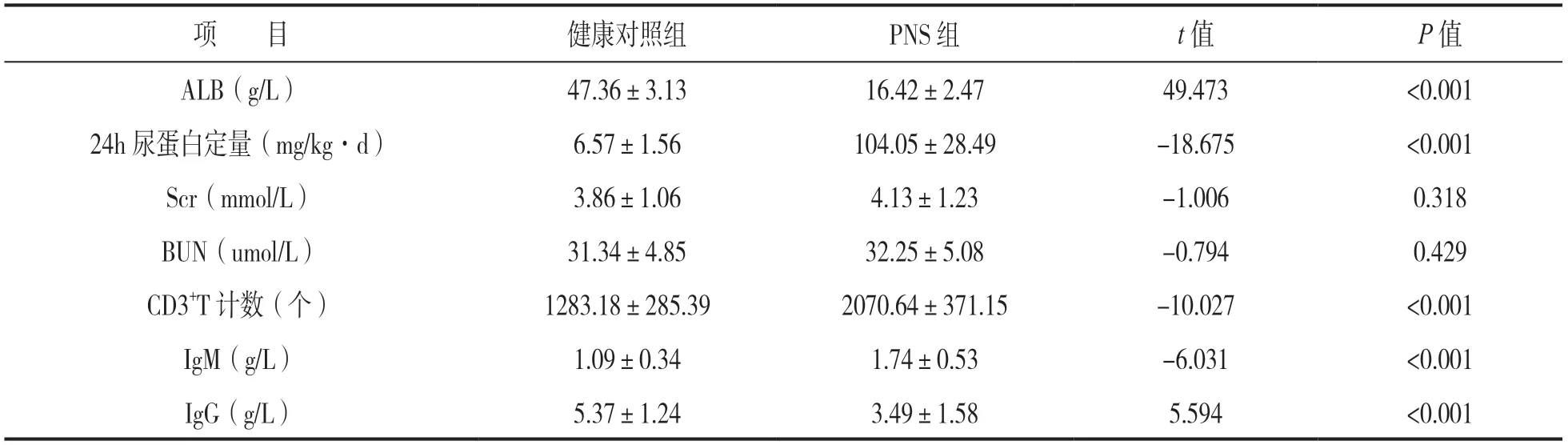
表1 两组临床实验室指标水平比较(±s)
项 目健康对照组PNS组t值P值ALB(g/L)47.36±3.1316.42±2.4749.473<0.001 24h尿蛋白定量(mg/kg·d)6.57±1.56104.05±28.49-18.675<0.001 Scr(mmol/L)3.86±1.064.13±1.23-1.0060.318 BUN(umol/L)31.34±4.8532.25±5.08-0.7940.429 CD3+T计数(个)1283.18±285.392070.64±371.15-10.027<0.001 IgM(g/L)1.09±0.341.74±0.53-6.031<0.001 IgG(g/L)5.37±1.243.49±1.585.594<0.001
2.2 两组B细胞、PD-L1+B淋巴细胞及血清CXCL13,sPD-L1和细胞因子水平比较 见表2。与健康对照组比较,PNS组治疗前患儿外周血总B细胞、PD-L1+B淋巴细胞及血清CXCL13,sPD-L1,TGF-β1,TNF-α,IL-10和IL-1β水平均明显升高,差异有统计学意义(均P<0.05);PNS组患儿治疗后各细胞及血清指标水平均较治疗前下降,差异有统计学意义(均P<0.05)。
表2 两组B细胞、PD-L1+B淋巴细胞及血清CXCL13,sPD-L1和细胞因子水平比较(±s)
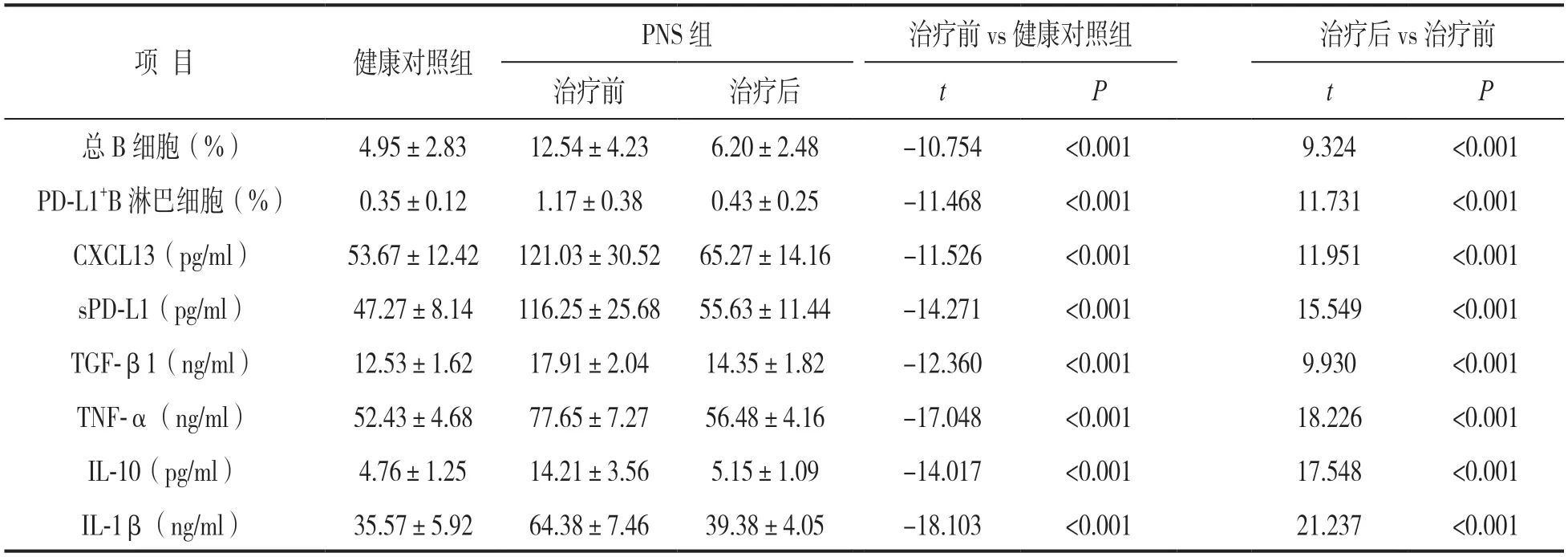
表2 两组B细胞、PD-L1+B淋巴细胞及血清CXCL13,sPD-L1和细胞因子水平比较(±s)
PNS组治疗前 vs 健康对照组治疗后 vs 治疗前治疗前治疗后tPtP总B细胞(%)4.95±2.8312.54±4.236.20±2.48-10.754<0.0019.324<0.001 PD-L1+B淋巴细胞(%)0.35±0.121.17±0.380.43±0.25-11.468<0.00111.731<0.001 CXCL13(pg/ml)53.67±12.42121.03±30.5265.27±14.16-11.526<0.00111.951<0.001 sPD-L1(pg/ml)47.27±8.14116.25±25.6855.63±11.44-14.271<0.00115.549<0.001 TGF-β1(ng/ml)12.53±1.6217.91±2.0414.35±1.82-12.360<0.0019.930<0.001 TNF-α(ng/ml)52.43±4.6877.65±7.2756.48±4.16-17.048<0.00118.226<0.001 IL-10(pg/ml)4.76±1.2514.21±3.565.15±1.09-14.017<0.00117.548<0.001 IL-1β(ng/ml)35.57±5.9264.38±7.4639.38±4.05-18.103<0.00121.237<0.001项 目健康对照组
2.3 PNS患儿外周血PD-L1+B淋巴细胞和CXCL13及与实验室指标的相关性 见表3。Pearson相关性分析,PD-L1+B淋巴细胞比例与ALB和IgG水平呈负相关,与IgM水平呈正相关,差异有统计学意义(均P<0.05);CXCL13表达水平与ALB和IgG水平呈负相关,差异有统计学意义(均P<0.05);PD-L1+B淋巴细胞比例与CXCL13表达水平呈正相关,差异有统计学意义(P<0.05)。
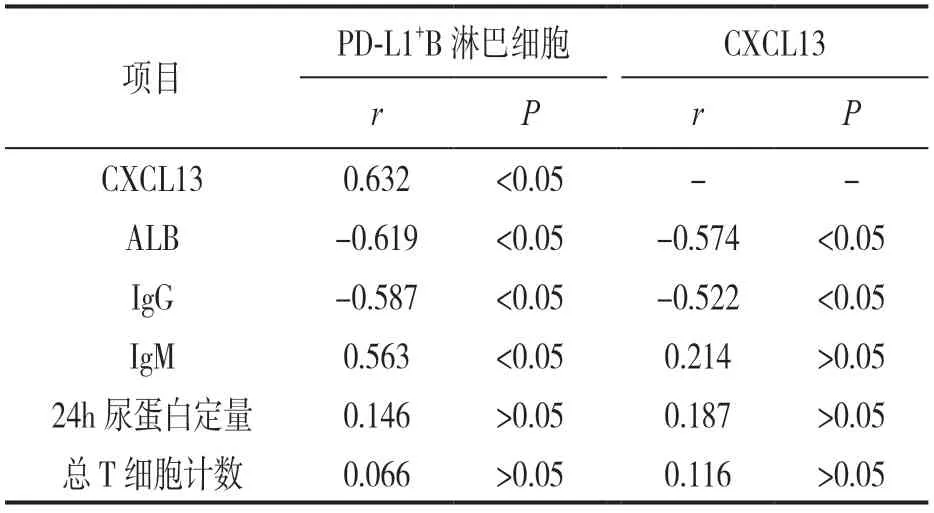
表3 相关性分析结果
3 讨论
目前原发性肾病综合征(PNS)发病机制尚未完全明确,研究发现患儿外周血淋巴细胞亚群比例改变,PNS频繁复发和激素耐药与患儿体内免疫功能异常有关,监测治疗过程中发现免疫功能明显变化,证实PNS发病与免疫功能紊乱密切相关[12]。PNS发病涉及细胞机制、免疫致病、炎症介质损伤和遗传因素[1],其中免疫致病的相关因素研究是PNS近年的热点。
PNS发病与T细胞亚群紊乱及致病T细胞因子升高有关,T淋巴细胞介导的细胞免疫在PNS发病中发挥主导作用[13]。有研究发现,PNS不仅与T淋巴细胞介导的免疫有关,也和B细胞介导的体液免疫关系密切[14]。在疾病活动期频繁复发型和激素依赖型PNS患儿总B细胞、记忆B细胞、过渡B细胞水平明显升高。随着免疫抑制剂环磷酰胺(影响B细胞存活)和生物制剂利妥昔单克隆抗体(耗竭B细胞)药物在PNS中的应用,发现有效地预防了疾病复发,证实由B细胞介导的体液免疫参与PNS发病[5-6]。本研究结果检测证实PNS患儿体内免疫紊乱。最新研究发现,程序性死亡受体配体1(PD-L1)+B淋巴细胞与滤泡辅助性T细胞上表达的程序性死亡受体1(PD-1)结合抑制该T细胞的生成,降低体液免疫活化所需的辅助作用,在自身免疫性疾病和体液免疫疾病中发挥重要作用[17-18]。通常PD-L1+B细胞在各种疾病中扮演着免疫应答的负性调节作用,而在PNS研究中,吕治安等[19-20]研究表明,PD-1/PD-L1信号参与了PNS的发病过程。本研究亦发现外周血PD-L1+B淋巴细胞和血清sPD-L1表达升高与PNS发病相关。低ALB是PNS诊断的特征条件之一,主要原因是肾小球通透性改变或滤过屏障损伤造成ALB从尿液中大量丢失[21]。大多数PNS在初发期和复发期均存在低IgG血症,说明分泌免疫球蛋白的B细胞免疫功能紊乱,IgM则升高[22]。本研究中得出PD-L1+B淋巴细胞表达均与ALB,IgG和IgM显著相关,分析PD-L1+B细胞可能促进PNS患儿的体液免疫反应,造成IgM和IgG分泌异常。
趋化因子C-X-C基序配体13(CXCL13)是唯一可与CXCR5受体结合的配体,稳定表达于成熟的B细胞、辅助性及调节性T细胞,参与免疫调控[7]。据文献报道,CXCL13能够调控外周循环B淋巴细胞归巢到淋巴结的过程,可促进次级淋巴结内B淋巴细胞分化为浆细胞,发挥体液免疫[23]。自身免疫性疾病中已证实CXCL13存在异常,本研究也表明CXCL13高表达参与了PNS发病。另外有学者报道,免疫反应失衡和炎症反应亢进与PNS有关,炎症介质TGF-β1和TNF-α等作用于肾小球,可介导炎症损伤,参与免疫反应,诱发PNS的发生[17]。ANSEL等[24-25]报道,CXCL13作为B淋巴细胞趋化剂,与CXCR5结合可选择性的介导外周血中B细胞的趋化性,增加B细胞产生释放IL-10和IL-1β等细胞因子,参与免疫调节。最新研究表明,CXCL13可作为糖皮质激素治疗的一种血清标志物,反映B细胞免疫的效应程度[21]。本研究结果表明PNS患儿自身存在炎症反应,疾病发生期CXCL13和炎症细胞因子释放增加;治疗后机体免疫紊乱改善,炎症反应受到抑制,猜测CXCL13可能通过促进外周血B淋巴细胞趋化性,促进免疫细胞生产炎症细胞因子,引起炎症和抗炎反应激活,加重PNS早期过度免疫炎症反应。然而B细胞介导的免疫与PNS的关系研究较少见,具体作用调控分子机制仍需后期进一步的研究明确。积极研发靶向CXCL13的抑制剂或药物,或许能通过抑制B淋巴细胞趋化性,进而减轻过度免疫炎症反应,降低PNS对患儿的损害,为PNS早期诊疗提供新的策略。
综上所述,CXCL13和PD-L1+B淋巴细胞比例升高与PNS患儿免疫系统紊乱相关。CXCL13可能通过促进外周血中B淋巴细胞趋化性,增加免疫细胞生产炎症细胞因子,加重PNS早期过度免疫炎症反应。
