早产儿坏死性小肠结肠炎患者血清miR-21-3p和miR-22-3p水平表达与病情严重程度的分析研究
2023-12-01祁秋霞吴良宇张文雅海南省人民医院新生儿科海口570100
祁秋霞,吴良宇,张文雅(海南省人民医院新生儿科,海口 570100)
坏死性小肠结肠炎(necrotizing enterocolitis,NEC)是早产儿中常见的胃肠道疾病,影响5%~12 %出生体重极低的新生儿的生命健康[1]。且NEC存活患者的长期并发症有较高的发生风险[2-3]。尽管目前NEC治疗和预防方面不断取得突破,但仍无针对该疾病的特效治疗方法,其相关疾病的发病率和死亡率仍然很高,早期预防和诊断难度也较大,因此需要开发非侵入性方法来预测NEC的发生。据报道,肠道微生物生态失调与NEC的发生有关[2,4]。微小核糖核酸(microRNA,miRNA,miR)是内源性小非编码核糖核酸分子,主要通过与mRNA的3’-UTR区域的互补靶向参与RNA沉默和基因表达调节[5]。近期许多研究表明,miRNA参与肠道疾病的各种生物学功能,如细胞凋亡、细胞增殖、肠上皮屏障功能、炎症浸润和致癌作用[6]。研究显示,微小RNA(miRNA,miR)-21-3p可作为肠道屏障功能障碍和相关肠道疾病的潜在生物标志物以及治疗靶点[7]。miR-22-3p在NEC患儿中水平下调,核梭杆菌通过LncRNA ENO5-IT1/miR-22-3p途径诱导干扰素调节因子5(interferon regulatory factor-5,IRF5)表达加重新生儿NEC[8]。本研究通过分析NEC早产儿血清miR-21-3p和miR-22-3p表达与肠道菌群紊乱及病情程度的相关性,为NEC的临床诊疗提供一定依据。
1 材料与方法
1.1 研究对象 选取海南省人民医院2020年3月~2022年12月收治的112例NEC早产儿为研究对象(NEC组),其中男性58例,女性54例,平均日龄9.82±2.64天;另选取在本院同期体检健康的早产儿100例作为研究对象(对照组),其中男性52例,女性48例,平均日龄10.24±2.85天。二组性别、日龄比较,差异无统计学意义(χ2/t=0.001,1.114,均P>0.05)。NEC患儿分组:根据NEC诊断指南[9],将NEC组患儿进行分组,Ⅰ期NEC患儿为轻度组35例,Ⅱ期NEC患儿为中度组47例,Ⅲ期NEC患儿为重度组30例。本研究经医院伦理委员会批准。
纳入标准:①均为出生胎龄28~37周的早产儿;②临床确诊为NEC患儿[9];③患儿家属知情且签署同意书;④临床资料完整。排除标准:①先天性代谢疾病患者;②先天性消化道畸形患者;③腹部创伤或其它原因休克者;④染色体异常者。
1.2 仪器与试剂 台式高速冷冻离心机(湖南湘仪公司,型号:H2100R);核酸蛋白分析仪(美国赛默飞公司,型号:NanoDrop 2000C);实时荧光定量PCR仪(美国应用生物系统公司,型号:StepOne TM),实时荧光定量PCR(real-time fluorescence quantitative PCR,qRT-PCR)试剂盒(广东正一实验装备有限公司,货号:MA6000),HiScript II One Step qRT-PCR Probe Kit试剂盒(南京诺唯赞公司,货号:Q222-01);血清/血浆RNA提取试剂盒(上海信裕生物,货号:XYB0901)。肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α),白介素-10(interleukin-10,IL-10),白介素-6(interleukin-6,IL-6)的酶联免疫吸附剂测定(enzyme-linked immunosorbent assay,ELISA)试剂盒(武汉默沙克生物科技有限公司),酶标仪(Epoch™ Microplate Spectrophotometer,USA)。
1.3 方法
1.3.1 样本收集:收集NEC患儿就诊当日和对照组早产儿体检当日静脉血3 ml,4℃冰箱保存,4 000 r/min离心10 min,取上清液,-70℃冰箱保存备用。
1.3.2 ELISA法检测TNF-α,IL-10,IL-6水平:使用特定的ELISA试剂盒检测血清中TNF-α,IL-10,IL-6的水平。使用酶标仪测量450 nm处的吸光度。
1.3.3 qRT-PCR测定血清miR-21-3p和miR-22-3p水平:采用血清/血浆RNA提取试剂盒提取样品总RNA,通过凝胶电泳检验提取RNA质量,结果显示28S和18S两条RNA带,表明样品无DNA污染和RNA降解,可进行下一步实验。测定RNA产物浓度和吸光度值,A260nm/A280nm比值在1.9~2.1表示RNA纯度较高、质量较好,可进行下一步实验。采用探针法qRT-PCR试剂盒进行qRT-PCR检测miR-21-3p和miR-22-3p,以U6为内参基因,每个样品设置3个技术重复。qRT-PCR反应体系20 μl:包含上下游引物各0.5 μl,TaqMan Probe 0.2 μl,模板RNA 10 ng,One-Step Q Probe Enzyme Mix 1 μl。反应条件:先50℃ 30 min,95℃ 5 min,再95℃ 10 s,60℃ 30 s,45 cycs,确认Real Time PCR的扩增曲线,制作标准曲线。使用primer5.0软件设计miR-21-3p,miR-22-3p和U6的qRT-PCR反应引物由华大基因生物公司合成。引物序列见表1。采用2-△△Ct计算miR-21-3p,miR-22-3p的水平。

表1 引物列表
1.3.4 肠道菌群紊乱程度评估:采集NEC患儿确诊当日粪便样本进行检测,根据肠道菌群紊乱程度评估标准对其进行分组[10]:Ⅰ级紊乱组34例,样本细菌总数较正常值略低,革兰阳性菌数量小于革兰阴性菌数量,革兰阴性杆菌和革兰阳性球菌均增加;Ⅱ级紊乱组52例,样本细菌总数明显低于正常值,革兰阳性球菌和革兰阴性杆菌数目均较多,少量酵母样菌出现;③Ⅲ级紊乱组26例,样本细菌总量极少,无或极少革兰阳性和阴性杆菌,酵母样菌明显增加。分级越高表示肠道菌群紊乱程度越严重。
1.4 统计学分析 采用SPSS 25.0对所得数据进行统计学分析,计量资料均符合正态分布,以均数±标准差(±s)表示,组间比较采用独立样本t检验,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验;计数资料以例(n)和百分数(%)表示,采用χ2检验;采用spearman分析血清miR-21-3p和miR-22-3p水平与NEC患儿病情程度和肠道紊乱程度相关性;采用受试者工作特征(receiver operator characteristic curves,ROC)曲线评价血清miR-21-3p和miR-22-3p水平在预测NEC中重度患儿中的价值。P<0.05为差异有统计学意义。
2 结果
2.1 NEC患儿血清miR 21 3p,miR 22 3p及炎性因子的水平比较 见表2。独立样本t检验显示,与对照组相比较,NEC组血清miR-21-3p,TNF-α,IL-6和IL-10均上调,血清miR-22-3p水平较对照组下调,差异有统计学意义(均P<0.01)。
表2 NEC患者血清miR-21-3p,miR-22-3p及炎性因子水平比较(±s)

表2 NEC患者血清miR-21-3p,miR-22-3p及炎性因子水平比较(±s)
项 目对照组(n=100)NEC组(n=112)t值P值miR-21-3p0.92±0.282.16±0.7315.9670.000 miR-22-3p1.36±0.420.74±0.2613.0690.000 TNF-α(pg/ml)12.26±2.7336.27±8.5626.8500.000 IL-6(pg/ml)14.34±3.36429.52±68.3660.6540.000 IL-10(pg/ml)3.62±1.0525.83±6.4633.9740.000
2.2 不同病情下NEC患儿血清miR-21-3p,miR-22-3p及炎症因子的水平比较 见表3。多因素方差分析显示,NEC患儿血清miR-21-3p,TNF-α,IL-6和IL-10水平随病情加重呈增高趋势,但血清miR-22-3p却呈降低趋势,差异有统计学意义(均P<0.01)。
表3 不同病情严重程度NEC患儿血清miR-21-3p和miR-22-3p及炎症因子的水平比较(±s)

表3 不同病情严重程度NEC患儿血清miR-21-3p和miR-22-3p及炎症因子的水平比较(±s)
注:*与轻度组比较,t=7.935,14.926,4.513,9.785,9.031; 16.546,19.874,35.645,13.060,20.277,均P<0.05;#与中度组比较,t= 8.310,6.077,8.988,18.964,9.112,均P<0.05。
项 目轻度组(n=35)中度组(n=47)重度组(n=30)F值P值miR-21-3p/U61.65±0.332.17±0.42*2.74±0.49*#55.7200.000 miR-22-3p/U60.90±0.230.75±0.21*0.54±0.18*#24.0170.000 TNF-α(pg/ml)24.46±5.7636.68±8.91*49.41±10.55*#68.5320.000 IL-6(pg/ml)185.30±42.78441.02±89.33*696.42±100.82*#318.4470.000 IL-10(pg/ml)12.64±3.6627.58±7.73*38.49±9.32*#105.1450.000
2.3 血清miR-21-3p和miR-22-3p水平与NEC患儿病情程度和肠道紊乱程度相关性分析 spearman相关分析结果显示,miR-21-3p与NEC患儿病情严重程度以及肠道紊乱程度呈正相关(r=0.516,0.531,均P<0.05);miR-22-3p与NEC患儿病情严重程度以及肠道紊乱程度呈负相关(r=-0.504,-0.529,均P<0.05)。
2.4 血清miR-21-3p和miR-22-3p水平在预测中重度NEC中的应用 见图1。以血清miR-21-3p和miR-22-3p水平为检验变量,以NEC患儿为中重度状态(是=1,否=0)绘制ROC曲线。结果显示,血清miR-21-3p水平预测NEC患儿是否为中重度患者的曲线下面积(AUC)为0.837(95 %CI:0.760-0.913),截断值为2.16,特异度和灵敏度分别为88.57%,68.83%;血清miR-22-3p水平预测NEC患儿是否为中重度患儿的AUC为0.852(95% CI:0.780-0.923),截断值为0.86,特异度和灵敏度分别为71.43 %,85.71 %。
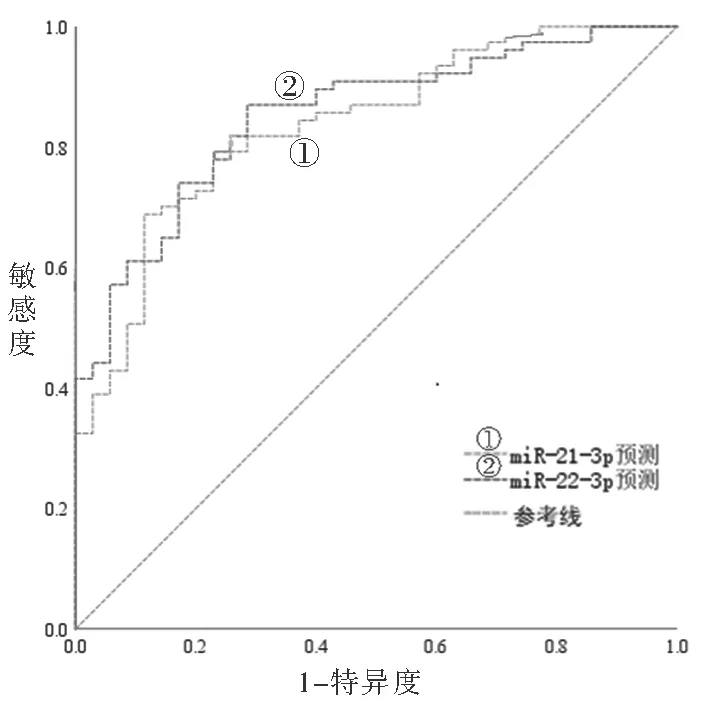
图1 血清miR-21-3p和miR-22-3p水平预测中重度NEC的ROC曲线
2.5 不同NEC病情患儿中肠道菌群紊乱情况 见表4。卡方分析显示,NEC患儿不同病情程度中,肠道菌群Ⅰ级紊乱、Ⅱ级紊乱、Ⅲ级紊乱之间差异具有统计学意义(χ2=14.389,P=0.006).
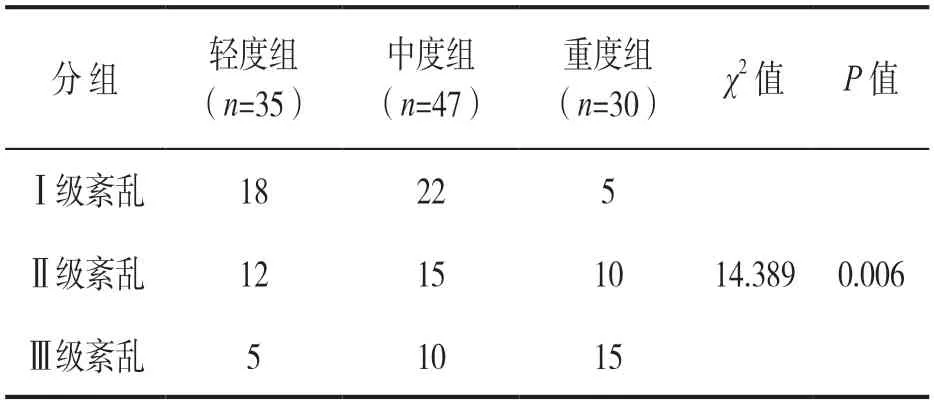
表4 不同NEC病情患儿中肠道菌群紊乱情况
2.6 不同肠道菌群紊乱NEC患儿中血清miR-21-3p和miR-22-3p及炎症因子水平 见表5。多因素分析显示,NEC患儿血清miR-21-3p及炎症因子水平随患儿肠道菌群紊乱程度加重而逐渐升高(均P<0.01);血清miR-22-3p水平随患儿肠道菌群紊乱程度加重而逐渐降低(P<0.01)。
表5 不同肠道菌群紊乱NEC患儿中血清miR-21-3p和miR-22-3p及炎症因子水平(±s)

表5 不同肠道菌群紊乱NEC患儿中血清miR-21-3p和miR-22-3p及炎症因子水平(±s)
注:*与Ⅰ级紊乱组比较,t=6.963,14.674,4.853,8.473,10.503; 18.705,20.057,33.465,13.649,20.902,均P<0.05;#与Ⅱ级紊乱组比较,t=9.523,4.734,10.644,17.881,10.139,均P<0.05。
项目Ⅰ级紊乱(n=34)Ⅱ级紊乱(n=52)Ⅲ级紊乱(n=26)F值P值miR-21-3p1.67±0.352.14±0.44*2.84±0.51*#53.9340.000 miR-22-3p0.89±0.240.73±0.21*0.56±0.17*#18.0370.000 TNF-α25.43±4.0636.81±6.98*49.37±9.45*#87.7610.000 IL-6192.17±35.77449.65±84.26*699.64±115.63*#282.8830.000 IL-1013.38±2.9527.46±6.62*38.85±9.48*#112.1750.000
3 讨论
坏死性小肠结肠炎(NEC)是导致早产儿死亡的主要原因,给患儿和家庭带来极大的痛苦和经济负担[11]。临床上,NEC可从相对轻度喂养不耐受和腹胀迅速进展为肠缺血和坏死、暴发性脓毒性休克、严重酸中毒、多器官功能障碍和死亡[12]。尽管在过去几十年中新生儿临床护理取得了重大进展,但全球NEC的患病率并未显著下降[13]。因此寻求新的生物标志物对其病情进行预估,使其可尽早防治,提高患儿生命安全十分重要。
微小核糖核酸(miRNA)是炎症反应和免疫调节的关键调节因子。许多研究表明,miRNA参与疾病的发生和发展,具有一定病理特异性,miRNA是极易从不同组织和血液中分离出来的稳定小分子,因此可以将其视为理想的生物标志物[14]。miR-21包括miR-21-5p和miR-21-3p两种成熟形式[15]。研究显示,miR-21在溃疡性结肠炎患者的血液、粪便和结肠组织中上调,并在结直肠癌中进一步升高,miR-21不仅可以用作检测结直肠癌的潜在非侵入性生物标志物,还可以用于区分功能性和器质性结直肠疾病[16]。在结肠炎患者中的研究显示,结肠炎组织中miR-21-3p表达水平高于健康组织,其在炎症性肠病发展中发挥潜在作用[17]。本研究发现,NEC患儿血清miR-21-3p水平上调,与MARTÍNEZ-GUTIERREZ等[17]研究结果相似。血清miR-21-3p水平随NEC患儿病情严重程度加重而逐渐升高,且miR-21-3p水平与NEC患儿病情严重程度呈正相关,与JIANG等[7]在直肠癌组织中的水平趋势一致,提示高水平miR-21-3p可推进NEC患儿的疾病进程。谢春燕等[18]人发现,miR-22可参与调节肠道屏障完整性和肠道通透性,通过介导炎症反应参与溃疡性结肠炎的发生发展,通过上调miR-22水平,可对溃疡性结肠炎大鼠起到保护作用。研究显示,肺腺癌患者组织中miR-22-3p水平较对照组降低,低表达与临床病理特征和预后密切相关,可作为肺腺癌诊断和预后的生物标志物[19]。本研究发现,NEC患儿血清miR-22-3p水平下调,与MA等[19]在肺腺癌中的研究结果相似。血清miR-22-3p随NEC患儿病情严重程度加重而逐渐降低,且miR-22-3p水平与NEC患儿病情严重程度呈负相关,与WANG等[20]在直肠癌患者中的研究结果趋势相似,提示NEC患儿血清miR-22-3p水平降低诱导患儿病情发生发展。进一步研究发现,血清miR-21-3p,miR-22-3p水平预测NEC患儿是否为中重度患儿的AUC分别为0.837,0.852,且miR-21-3p预测中特异度较高,miR-22-3p预测中灵敏度较高。提示miR-21-3p对NEC患儿是否为中重度患儿有一定的预测价值。有望成为NEC患儿是否为中重度患儿的预测因子。
早产儿较足月儿更容易患NEC的主要原因之一是早产儿肠道的屏障功能发育不够完善,其原因可能是由于早产儿肠道上皮细胞紧密连接蛋白的表达不足,增加了其细胞膜通透性,导致NEC更易发生[21]。近期研究也表明,肠道菌群失调可以激活不受控的促炎反应从而导致NEC的发生发展[22]。炎症反应与炎症因子的异常表达密切相关,据报道,新生儿坏死性小肠结肠炎肠组织中TNF-α,IL-6,IL-10等水平较对照组升高[4,23]。且新生儿NEC患儿血清IL-12,IL-17水平升高,且与患儿病情严重程度相关[24]。本研究发现,血清TNF-α,IL-6和IL-10水平随NEC患儿病情严重程度加重而逐渐升高,与上述研究结果一致,提示患儿机体处于高炎状态。进一步研究发现,NEC患儿血清miR-21-3p水平随患儿肠道菌群紊乱程度加重而上升,miR-22-3p水平随患儿肠道菌群紊乱程度加重而下降。提示肠道菌群紊乱与NEC病情密切相关。因此猜测本研究结果可能是随着miR-21-3p水平上调,血清miR-22-3p水平下调,且肠道菌群紊乱激活患儿机体炎症反应,进而促进NEC发生发展,具体机制还需进一步研究。
综上所述,NEC患儿血清miR-21-3p水平上调,血清miR-22-3p水平下调,且与肠道菌群紊乱程度和病情严重程度相关,两者在预测NEC患儿病情严重程度中具有一定价值。本研究未对miR-21-3p和miR-22-3p参与NEC的调控途径进行深入分析,下一步可通过构建动物模型实验对此进行探究。
