冠心病PCI术后患者血液FIB,NLRP3和LECT-2水平表达与冠状动脉微血管疾病发生的相关性研究
2023-12-01蒋红英王依阳梁宸源姜瑞嘉任园园许百灵
蒋红英,王依阳,赵 慧,梁宸源,姜瑞嘉,任园园,陈 亮,许百灵,程 功
(1.陕西省人民医院心血管内科,西安 710068;2.美国密苏里哥伦比亚大学-核科学暨工程研究所,密苏里州MO 65211)
冠状动脉疾病(coronary artery disease,CAD)是全球发病和死亡的主要原因[1]。经皮冠状动脉介入术(percutaneous coronary intervention,PCI)是治疗冠状动脉病变的主要方法之一。然而,临床工作中发现有部分患者行PCI术后仍有心绞痛等心肌缺血相关症状存在。有证据[2]表明,这些患者中有很大一部分是因为存在冠状动脉微血管疾病(coronary microvascular disease,CMVD)。据报道[3],CMVD是心血管不良事件的独立预测因子,与心血管事件的发生率及死亡率存在显著关联。因此,探讨早期冠心病PCI术后生物标志物对CMVD早期识别和干预具有重要意义。有研究[4]表明,纤维蛋白原(fibrinogen,FIB)水平升高与CMVD之间显著相关。研究[5]证实,血管内皮功能障碍是导致CMVD发病率增加的主要潜在因素,核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain like receptor protein 3,NLRP3)[6]和白细胞衍生趋化因子2(leukocyte cell-derived chemotaxin 2,LECT-2)[7]均可通过核因子-κB(nuclear factor kappa-B,NF-κB)信号通路促进炎症因子释放,导致冠脉血管内皮损伤,加重心肌灌注不足。目前,国内外针对NLRP3,LECT2与CMVD发生的相关研究较少。鉴于此,本研究首次基于一种无创性SPECT定量技术测算CFR诊断冠状动脉微血管疾病,通过检测冠心病PCI术后患者血液FIB,NLRP3和LECT-2表达水平,评价其与冠心病PCI术后患者CMVD发生的相关性。
1 材料与方法
1.1 研究对象 选取 2021年 7 月~2022年9月冠心病PCI术后患者仍有心肌缺血相关症状就诊于陕西省人民医院心内科患者,冠状动脉造影或冠脉CT血管成像检查提示心外膜冠脉狭窄直径<50%,根据行单电子发射计算机断层成像(single-photon emission computer tomography,SPECT)检查测定冠状动脉血流储备(coronary flow reserve,CFR)进行分组,CFR<2.0患者为CMVD组(n=78),CFR≥2.0患者为对照组(n=47)。纳入标准:①年龄18~80岁,性别不限;②PCI术后患者出现心肌缺血症状经冠状动脉造影/冠脉CT血管成像复查提示各支心外膜冠脉狭窄直径<50%;③签署知情同意书,自愿参加本次研究;④成功完成了SPECT测定CFR[8]。排除标准:①患慢性肺源性心脏病、扩张型心肌病、肥厚型心肌病;②并发上呼吸道感染等对炎症相关指标影响较大的疾病;③严重肝功能不全(ALT或AST>200U/L)、肾功能不全(GFR<60ml/min);④心脏超声检查提示左室射血分数<50%;⑤可能引起血流动力学不稳定的严重心律失常;⑥有三磷酸腺苷静脉注射禁忌症或对其过敏。体质量指数(BMI)=体重(kg)/身高2(m)2。本研究经陕西省人民医院伦理委员会审核批准[伦理审查批件号(NO):2022K194],所有患者对本研究知情并签署知情同意书。两组患者的年龄、体重指数、性别、吸烟史、饮酒史、高血压史、糖尿病史、脑梗史等资料相比,差异均无统计学意义(t=-0.478,-0.732,χ2=0.063,0.454,0.164,0.216,1.642,3.243,均P>0.05)。
1.2 仪器与试剂 全自动血液分析仪[Sysmex,XN-10(B2)];全自动生化分析仪(贝克曼,AU5801);人NLRP3试剂盒(美国SAB公司);人IL-18,LECT2试剂盒(武汉菲恩生物科技有限公司)。
1.3 方法 收集所有患者一般资料、血液及常规生化指标。抽取所有患者入院时的空腹静脉血5ml,以3 000r/min离心15min,离心完成后提取血浆并保存于-80℃待检。全自动血液/生化分析仪检测血细胞、血浆生化指标,血清NLRP3,IL-18和LECT2蛋白水平采用酶联免疫吸附试验(ELISA)试剂盒检测,操作步骤均按照试剂盒说明书进行。
1.4 统计学分析 数据分析采用SPSS 26.0统计软件,计数资料以率表示,组间比较采用χ2检验。计量资料正态分布以均数±标准差(±s)表示,组间比较用独立样本t检验。偏态分布以M (P25,P75) 表示,组间比较用Mann-WhitneyU非参数检验。二元Logistic回归分析CMVD的独立危险因素,受试者工作特征(recciver operating characteristic,ROC)曲线分析FIB和NLRP3诊断冠心病PCI术后患者CMVD发生的预测价值。P<0.05为差异有统计学意义。
2 结果
2.1 两组血液及常规生化指标水平比较 见表1。CMVD组FIB,PLR,HbA1c,NLPR3和LECT-2水平均高于对照组,差异有统计学意义(均P<0.05),其他指标如PT-T,APTT,WBC,NEU,LYM,MONO,HB,PLT,NLR,LMR,ALT,AST,TBIL,DBIL,TP,ALB,TC,TG,HDL-C,LDL-C,ApoAI,ApoB,ApoE,LP(a),UREA,CRE,UA和HCY水平组间比较,差异无统计学意义(均P>0.05)。
表1 两组血液及常规生化指标水平比较[±s或M(P25,P75)]
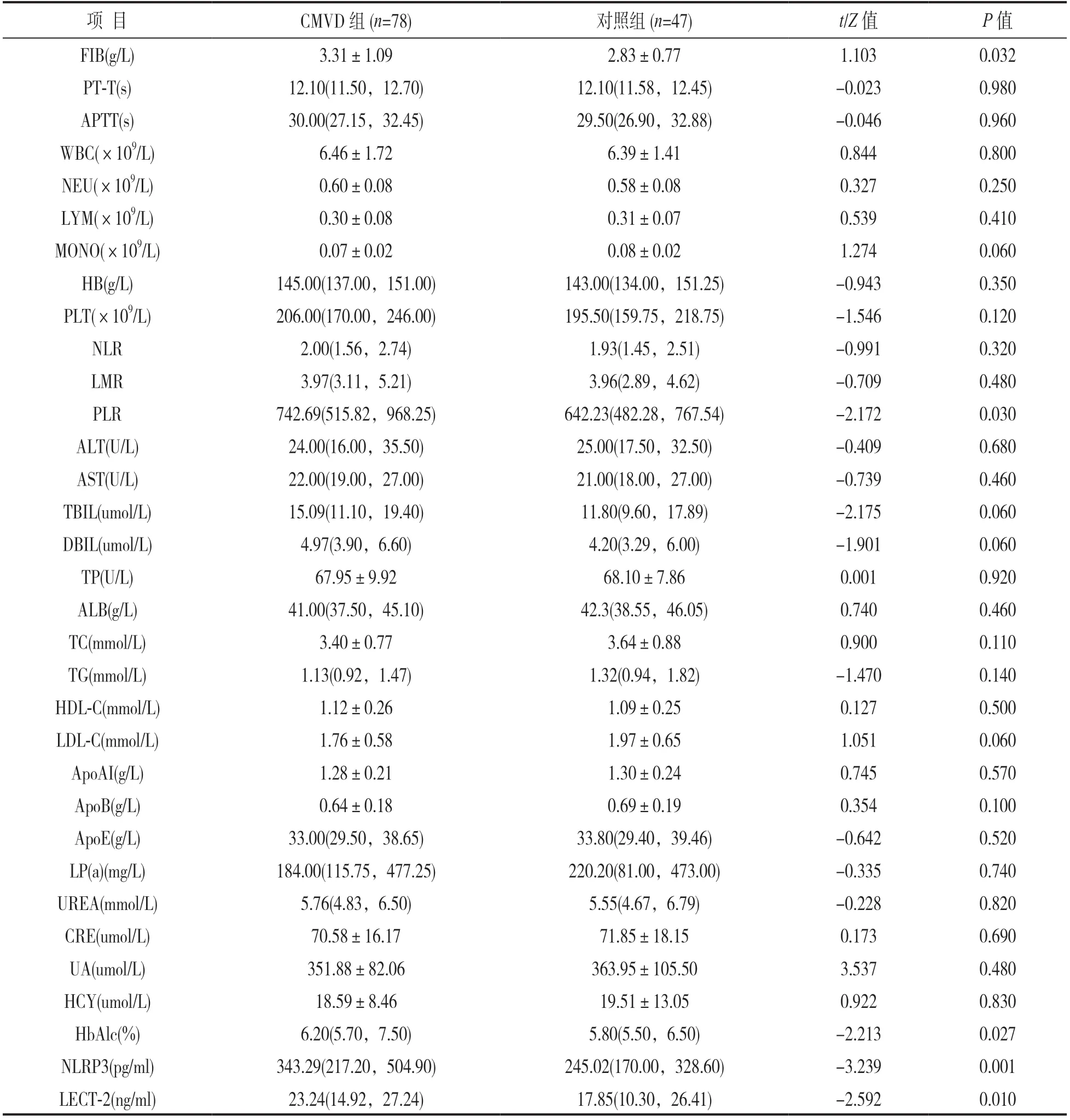
表1 两组血液及常规生化指标水平比较[±s或M(P25,P75)]
项 目CMVD组(n=78)对照组(n=47)t/Z值P值FIB(g/L)3.31±1.092.83±0.771.1030.032 PT-T(s)12.10(11.50,12.70)12.10(11.58,12.45)-0.0230.980 APTT(s)30.00(27.15,32.45)29.50(26.90,32.88)-0.0460.960 WBC(×109/L)6.46±1.726.39±1.410.8440.800 NEU(×109/L)0.60±0.080.58±0.080.3270.250 LYM(×109/L)0.30±0.080.31±0.070.5390.410 MONO(×109/L)0.07±0.020.08±0.021.2740.060 HB(g/L)145.00(137.00,151.00)143.00(134.00,151.25)-0.9430.350 PLT(×109/L)206.00(170.00,246.00)195.50(159.75,218.75)-1.5460.120 NLR2.00(1.56,2.74)1.93(1.45,2.51)-0.9910.320 LMR3.97(3.11,5.21)3.96(2.89,4.62)-0.7090.480 PLR742.69(515.82,968.25)642.23(482.28,767.54)-2.1720.030 ALT(U/L)24.00(16.00,35.50)25.00(17.50,32.50)-0.4090.680 AST(U/L)22.00(19.00,27.00)21.00(18.00,27.00)-0.7390.460 TBIL(umol/L)15.09(11.10,19.40)11.80(9.60,17.89)-2.1750.060 DBIL(umol/L)4.97(3.90,6.60)4.20(3.29,6.00)-1.9010.060 TP(U/L)67.95±9.9268.10±7.860.0010.920 ALB(g/L)41.00(37.50,45.10)42.3(38.55,46.05)0.7400.460 TC(mmol/L)3.40±0.773.64±0.880.9000.110 TG(mmol/L)1.13(0.92,1.47)1.32(0.94,1.82)-1.4700.140 HDL-C(mmol/L)1.12±0.261.09±0.250.1270.500 LDL-C(mmol/L)1.76±0.581.97±0.651.0510.060 ApoAI(g/L)1.28±0.211.30±0.240.7450.570 ApoB(g/L)0.64±0.180.69±0.190.3540.100 ApoE(g/L)33.00(29.50,38.65)33.80(29.40,39.46)-0.6420.520 LP(a)(mg/L)184.00(115.75,477.25)220.20(81.00,473.00)-0.3350.740 UREA(mmol/L)5.76(4.83,6.50)5.55(4.67,6.79)-0.2280.820 CRE(umol/L)70.58±16.1771.85±18.150.1730.690 UA(umol/L)351.88±82.06363.95±105.503.5370.480 HCY(umol/L)18.59±8.4619.51±13.050.9220.830 HbAlc(%)6.20(5.70,7.50)5.80(5.50,6.50)-2.2130.027 NLRP3(pg/ml)343.29(217.20,504.90)245.02(170.00,328.60)-3.2390.001 LECT-2(ng/ml)23.24(14.92,27.24)17.85(10.30,26.41)-2.5920.010
2.2 发生CMVD危险因素Logistic 回归分析 见表2。以CMVD为因变量,血液FIB,PLR,HbA1c,NLRP3,LECT-2水平作为协变量进行二元Logistic回归分析,结果显示:FIB和NLRP3是冠心病PCI术后CMVD发生的独立危险因素(均P<0.05)。
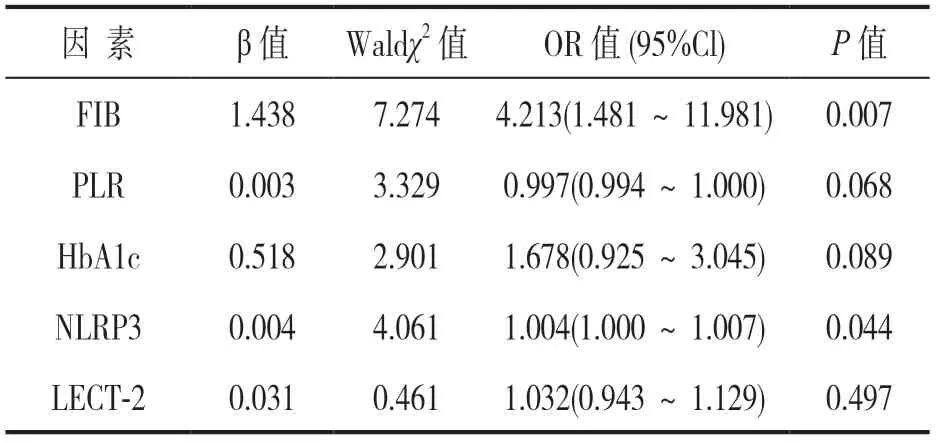
表2 发生CMVD相关因素的Logistic回归分析
2.3 ROC曲线预测 见图1。以入院时FIB和NLRP3为检验变量,以发生CMVD为状态变量绘制ROC曲线,结果显示曲线下面积(area under the curve,AUC)分别为0.648和0.679,二者联合诊断时AUC为0.712。其中FIB以2.39s为最佳临界值时,敏感度和特异度分别为85.7%和41.2%;NLRP3最佳临界值为304.83pg/ml,敏感度和特异度分别为61.5%和74.5%;二者联合诊断的敏感度和特异度分别为81.6%和65.9%。
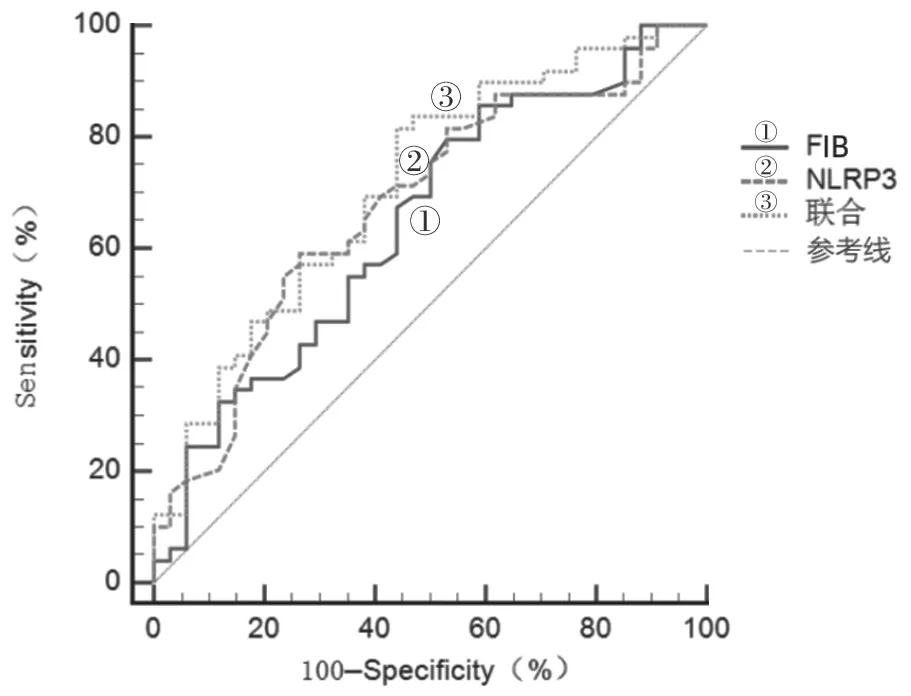
图1 ROC曲线分析FIB与NLRP3对CMVD发病预测价值
3 讨论
缺血性心脏病是全球死亡和残疾的主要原因之一[9]。在冠状动脉微血管疾病(CMVD)有心肌缺血症状的患者中,冠脉造影检查表明非梗阻性病变的发生率为45%~60%[10]。已知CMVD与大血管CAD有许多相似的危险因素[11-12],包括吸烟、糖尿病、衰老、高血压等。本研究中年龄、BMI,性别、吸烟史、饮酒史、高血压史、糖尿病史、脑梗死史这些传统危险因素组间比较差异并无统计学意义,这同既往研究[11-12]结果不符,分析原因可能是由于我们的研究例数太少没有对高血压、糖尿病等传统因素进行亚组分析,导致这些传统危险因素对CMVD的影响被低估而未分析出两者的相关性。但我们观测到HbA1c组间比较差异有统计学意义,说明高血糖可能参与了CMVD的发生发展。据报道[13],炎症与内皮功能障碍、动脉粥样硬化和冠状动脉微血管疾病的发病机制有关。因此,寻找更为准确、可靠的标记物指导临床决策具有重要意义。
纤维蛋白原(FIB)是一种炎症标志物,与冠状动脉疾病的病理生理学、存在、严重程度和预后有关[14]。研究[15]证实,即使在低密度脂蛋白胆固醇高患者中,如果FIB水平低,心血管风险也不会增加。这表明,FIB在动脉壁上的沉积可能是吸附低密度脂蛋白颗粒和触发动脉粥样硬化斑块形成和生长的必要条件。研究[16]表明,梗死相关冠状动脉机械再通成功后的基线FIB浓度是心肌再灌注缺乏的独立危险因素。在本研究中,无论单因素和多因素分析均发现FIB浓度是CMVD的独立危险因素。考虑与以下作用机制相关:①FIB及其代谢物可能导致内皮功能障碍。黏附在内皮表面的纤维蛋白原导致血管活性分子的释放并扰乱内皮通透性,导致FIB沉积在内皮下区域,这为动脉粥样硬化聚集体的细胞外积累提供了易感的内皮表面[17]。此外,FIB可能刺激内皮细胞退化和紊乱,并增加内皮细胞来源生长因子的释放。所有这些过程都表明FIB在刺激血管炎症中发挥作用,并导致内皮功能障碍[18]。②高FIB浓度可能影响血液流变学参数。增加FIB含量可增加血浆黏度、红细胞聚集和血小板血栓形成,从而改变血管反应性和损害内皮细胞层完整性来影响微循环[19]。
血小板与淋巴细胞比值(PLR)。众所周知,动脉粥样硬化斑块的形成同血小板聚集密不可分。有研究[20]表明,PLR是冠心病患者冠脉斑块稳定性的独立危险因素,且与预后密切相关。因此,PLR越高,提示炎症和血小板相关机制在心血管疾病中的贡献越大。YILDIZ等人[21]证明高PLR(>160)是STEMI患者无再流的独立预测因子。除此之外,SZOLC等[22]人研究表明,PLR可作为慢性冠脉综合征和无明显心外膜狭窄时冠脉微血管病变的预测指标。我们的研究与该结论一致,组间比较中PLR在CMVD组中更高。因此有理由认为,高水平PLR可能参与CMVD发生过程。
核因子-κB(NF-κB)蛋白家族是一种多效转录因子,它可以特异性地结合到各种启动子的κB位点以促进它们的转录表达,被认为是一种典型的促炎信号通路[23]。既往研究发现,由于炎症和细胞凋亡介导的级联反应可通过NF-κB信号途径调节微血管内皮细胞功能障碍[24]。在CMVD发展过程中,冠脉微血管内皮细胞(coronary microvascular endothelial cells,CMEC)受损是关键环节[25]。CMEC约占心肌细胞总数的1/3,CMEC功能障碍往往先于心肌损伤[26]。血管内皮在维持血管稳定状态中起着至关重要的作用,内皮功能障碍有助于心血管疾病的发生和进展[27]。核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)是一种多核蛋白复合体,在心血管疾病中起着重要作用,包括心肌缺血/再灌注、心肌梗死和心脏毒性[28-30]。近年来发现,NLRP3信号通路参与了CMEC的损伤。NLRP3介导的信号通路可激活NF-kB,诱发半胱氨酸天冬氨酸蛋白酶1(caspase-1)活化,进而促进下游白介素-1β及白介素-18的成熟和分泌,引起局部炎症反应,损伤内皮功能[31]。另有研究发现,NLRP3蛋白在心肌细胞中几乎不表达,但在CMEC中表达,这进一步表明NLRP3炎性小体在CMEC的病理生理学中起重要作用[32]。因此,我们认为NLRP3炎症体也可能参与了CMVD的发展过程。在对NLRP3的相关统计分析中发现,组间比较CMVD组NLRP3水平更高,Logistic回归分析提示高NLRP3是CMVD的独立危险因素,ROC曲线分析提示NLRP3对CMVD有一定的预测作用,这表明NLRP3可能通过NF-kB信号调节通路参与CMVD的发生发展。
除经典的直接参与内皮细胞损伤相关蛋白外,近年来发现还有其他蛋白参与了微血管内皮损伤过程的调节,白细胞衍生趋化因子 2 ( LECT2) 是一种主要由肝细胞产生的 16 kDa 蛋白,被鉴定为一种新的中性粒细胞趋化因子。研究[33]表明,LECT2通过NF-kB信号传导,在炎症反应的调节中起重要作用。JUNG等[34-35]人同样发现,LECT2 可通过NF-κB信号传导激活诱导促炎过程,增加人细胞间黏附因子1、促炎细胞肿瘤坏死因子α、人单核细胞趋化蛋白-1和IL-1β的表达,这些物质可导致血管局部炎症反应,导致冠脉血管内皮的损伤,加重心肌灌注不足。综合以上文献回顾,发现LECT2可能通过调节NF-κB信号通路诱导炎症反应进而引起冠脉血管内皮的损伤。本研究经分析发现两组患者LECT2组间差异有统计学意义,与上述研究结论相符,提示高水平LECT2可能通过增加炎症反应损伤微血管内皮而影响CMVD。
综上所述,FIB和NLRP3升高可能是冠心病PCI术后患者发生CMVD的危险因素,两者具有较好的发病预测价值。但本研究仍有不足之处:首先,本研究是一个单中心、小样本量的临床研究,研究中的数据测量可能存在一定的误差,对影响冠状动脉微血管疾病的危险因素及生物标志物需要大样本量及更长时间的研究来进一步证实;其次,FIB和NLRP3都可通过调节NF-κB信号通路促进炎症反应损伤冠脉血管内皮进而参与CMVD的发生过程,但其潜在的具体机制仍不清楚.因此仍需在基础研究中进一步深入探索。
