生酮饮食对EGFR/KRAS基因突变型人肺腺癌细胞裸鼠移植瘤生长的影响及其机制
2023-12-01郑友妹彭倩张依原倩影高永峰陈纪涛
郑友妹,彭倩,张依,原倩影,高永峰,陈纪涛
广州医科大学附属第五医院肿瘤科 广东高校生物靶向诊治与康复重点实验室,广州510700
饮食结构的改变对于肿瘤的发生发展至关重要[1-2]。生酮饮食是一种由高比例脂肪、极低碳水化合物、适量蛋白质构成的饮食方案,该方案模拟空腹状态新陈代谢,诱导酮体产生作为机体能量的主要来源[3]。有研究发现,肿瘤细胞线粒体功能障碍、酮体分解限速酶3-琥珀酰辅酶A转移酶1(OXCT1)和β-羟基丁酸脱氢酶1(BDH1)基因表达缺失,可引起酮体供能障碍,抑制肿瘤细胞生长[4-5]。在肺腺癌发生发展过程中,表皮生长因子受体(EGFR)和Kirsten大鼠肉瘤病毒基因同源物(KRAS)基因突变起到重要的驱动作用[6]。在前期工作中,我们选择了两种经典突变型肺癌细胞模型,EGFR突变型肺癌细胞株PC9和KRAS基因突变型细胞株A549[7-8],对这两株细胞开展酮体β-羟丁酸(β-HB)干预实验,发现生酮饮食可抑制A549细胞的增殖和迁移,同时出现了促进PC9细胞增殖和迁移的表型。有学者向非小细胞肺癌细胞株H1299无血清培养基中加入β-HB,发现该细胞通过OXCT1调控β-HB代谢,促进其自身增殖[9]。查询公认的HPA数据库,发现OXCT1基因在A549细胞中表达明显低于PC9细胞。然而,对于A549、PC9细胞酮代谢的具体调控机制目前尚不清楚。2022年7—8月,本研究建立了A549、PC9细胞裸鼠皮下移植瘤模型,观察生酮饮食对人肺腺癌两种基因突变型裸鼠移植瘤生长的影响,并探索可能的作用机制,旨在开发突变型肺癌的新疗法和抗肿瘤酮代谢的治疗靶点。
1 材料与方法
1.1 细胞、动物与主要材料 人非小细胞肺癌细胞株A549、PC9购自中国科学院细胞库。24只雌性SPF级BALB/c-nu裸鼠购自广东省医学实验动物中心,体质量14 ~ 17 g,鼠龄28 ~ 40 d,饲养于广州医科大学实验动物中心SPF级屏障设施中。标准化饲料和生酮饮食饲料由上海斯莱克实验动物有限责任公司加工而成。胎牛血清购自澳洲Gibico公司,DMEM高糖培养基购自美国Corning公司。雅培血糖、血酮体试纸及血糖血酮体仪购自康伴保健器械专营店。人肺癌裸鼠皮下移植瘤转录组测序委托北京诺禾致源科技股份有限公司完成。本动物实验经广州医科大学实验动物中心伦理委员会审核批准。
1.2 细胞培养与裸鼠皮下移植瘤制作 A549、PC9细胞接种于含10%胎牛血清的DMEM培养基,置于37 ℃、5% CO2培养箱中常规培养。待细胞均处于对数生长期、细胞量达到每只裸鼠接种1×106数量级时,用胰酶将两种细胞分别消化,使用细胞计数仪调整细胞密度为5×106/mL。为保持细胞活性,将细胞悬液置于冰上以降低细胞代谢。接种时先混匀,再用1 mL注射器吸取0.2 mL细胞悬液缓慢注射到裸鼠右前肢皮下,按压30 s缓慢拔出针头以防悬液漏出。
1.3 动物分组及饮食干预 制作裸鼠移植瘤成功后,瘤体直径小于2 mm时两种裸鼠均常规进食,于瘤体直径达到2 mm时开始饮食干预。按照喂养方式将每种裸鼠分为标准饮食组(SD组)和生酮饮食组(KD组),每组6只。SD组和KD组分别采用标准饮食(饲料外观呈颗粒状,主要营养成分为5.28%脂肪、22.1%蛋白质和52%碳水化合物)和生酮饮食(饲料外观呈乳糜状,主要营养成分为69%脂肪、20%蛋白质及3%碳水化合物)。连续饮食干预30 d。
1.4 裸鼠体质量、血糖、血酮体检测 每天记录裸鼠一般情况(包括活动、毛色、饮食等)。接种当天测量一次裸鼠体质量,以后每5 d重复测量。在饮食干预第1、10、20、30天采集尾静脉血5 μL检测血糖和血酮体,检测仪器为雅培超越立妥血糖仪。
1.5 瘤体体积、质量检测及脏器病理组织观察饮食干预第30天,颈椎脱臼法处死裸鼠后取材测量瘤重,将肿瘤组织送北京诺禾致源科技股份有限公司完成测序。采用游标卡尺测量肿瘤长短径、计算肿瘤体积和抑瘤率。抑瘤率=(SD组平均体积-KD组平均体积)/SD平均体积×100%。分别切取裸鼠的肿瘤、心、肝、肺、肾和脑组织,甲醛固定后,石蜡包埋,切片,HE染色,观察病理组织变化。
1.6 A549、PC9细胞中酮代谢关键基因OXCT1和BDH1检测 通过人类蛋白质图谱项目(HPA)数据库检索酮代谢关键基因OXCT1、BDH1在RNA Cell line模块的表达,进一步通过Lung Cancer模块找出A549、PC9细胞株,比较OXCT1和BDH1在两种细胞株中的转录表达情况。
1.7 KD组与SD组A549、PC9细胞裸鼠移植瘤差异表达基因筛选及分析 在完成基因表达定量分析后,筛选KD组与SD组A549、PC9细胞裸鼠移植瘤的差异表达基因。按照常用经验值,差异基因的筛选标准标准为|log2(FoldChange)|≥1及校正P≤0.05。采用火山图直观展示每个比较组合的差异基因分布情况;采用热图进行实验数据的质量控制和差异数据的具像化展示;采用clusterProfiler软件对差异基因集进行KEGG通路富集分析,KEGG通路富集以校正P<0.05作为显著性富集的阈值。
1.8 统计学方法 采用SPSS16.0统计软件。计量资料以表示,组间比较采用两独立样本t检验;重复测量资料比较采用重复测量的方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 两组荷瘤裸鼠体质量、血糖、血酮体比较 两组饮食干预不同时点裸鼠体质量差异无统计学意义。KD组血糖水平略低于SD组,差异无统计学意义。第10天开始,两种荷瘤裸鼠KD组血酮体水平均高于SD组(P均<0.05)。见表1 ~ 3。
表1 两组饮食干预不同时点A549、PC9细胞荷瘤裸鼠体质量比较(g,)
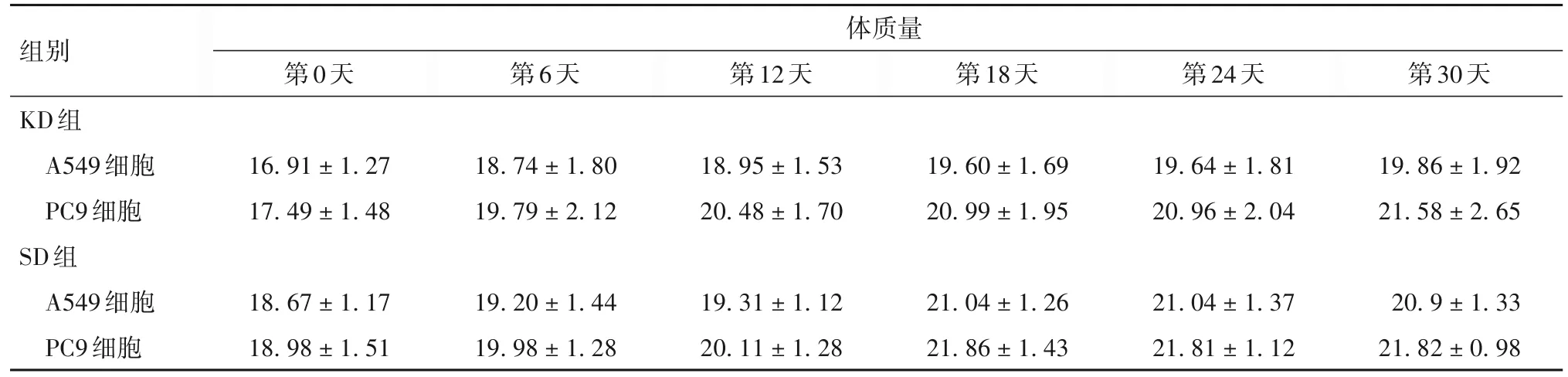
表1 两组饮食干预不同时点A549、PC9细胞荷瘤裸鼠体质量比较(g,)
组别KD组A549细胞PC9细胞SD组A549细胞PC9细胞体质量第0天第6天第12天第18天第24天第30天16.91 ± 1.27 17.49 ± 1.48 18.74 ± 1.80 19.79 ± 2.12 18.95 ± 1.53 20.48 ± 1.70 19.60 ± 1.69 20.99 ± 1.95 19.64 ± 1.81 20.96 ± 2.04 19.86 ± 1.92 21.58 ± 2.65 20.9 ± 1.33 21.82 ± 0.98 18.67 ± 1.17 18.98 ± 1.51 19.20 ± 1.44 19.98 ± 1.28 19.31 ± 1.12 20.11 ± 1.28 21.04 ± 1.26 21.86 ± 1.43 21.04 ± 1.37 21.81 ± 1.12
表2 两组饮食干预不同时点A549细胞荷瘤裸鼠血糖、血酮体水平比较(mmol/L,)

表2 两组饮食干预不同时点A549细胞荷瘤裸鼠血糖、血酮体水平比较(mmol/L,)
注:与同时点SD组相比,*P<0.05。
组别KD组第1天第10天第20天第30天SD组第1天第10天第20天第30天血糖血酮体6.04 ± 0.32 6.30 ± 0.56 4.92 ± 0.96 4.88 ± 0.57 0.80 ± 0.04 1.30 ± 0.23*1.44 ± 0.50*1.18 ± 0.40*0.79 ± 0.05 0.90 ± 0.12 0.7 ± 0.00 0.84 ± 0.15 6.06 ± 0.33 6.58 ± 0.48 5.60 ± 0.37 5.80 ± 0.35
表3 两组饮食干预不同时点PC9细胞荷瘤裸鼠血糖、血酮体水平比较(mmol/L,)
注:与同时点SD组相比,*P<0.05。
血酮体血糖5.26 ± 0.13 5.52 ± 0.28 4.54 ± 0.54 4.96 ± 0.72 0.81 ± 0.05 1.00 ± 0.32*1.34 ± 0.38*0.94 ± 0.15*组别KD组第1天第10天第20天第30天SD组第1天第10天第20天第30天0.83 ± 0.04 0.90 ± 0.10 0.66 ± 0.05 0.58 ± 0.13 5.84 ± 0.48 6.00 ± 0.96 5.36 ± 0.61 4.92 ± 0.34
2.2 两组瘤体大小、重量及脏器病理改变比较 与SD组相比,KD组A549细胞裸鼠移植瘤体积变小、质量变轻,KD组PC9细胞移植瘤体积增大、质量增加(P均<0.05)。KD组A549、PC9细胞移植瘤的抑瘤率分别为58%、-133%。见图1、表4。HE结果显示两种荷瘤裸鼠各脏器未见明显病理改变。
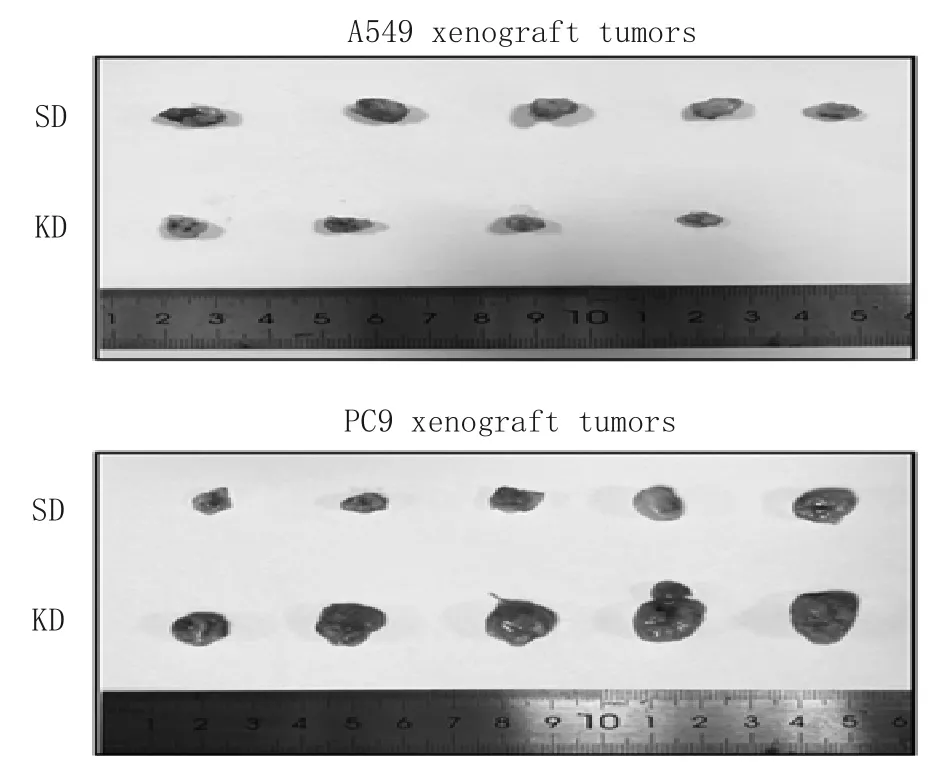
图1 两组饮食干预第30天A549、PC9细胞荷瘤裸鼠移植瘤外观
表4 两组A549、PC9细胞裸鼠移植瘤的肿瘤体积、肿瘤质量、抑瘤率比较()

表4 两组A549、PC9细胞裸鼠移植瘤的肿瘤体积、肿瘤质量、抑瘤率比较()
注:与同种细胞裸鼠移植瘤SD组相比,*P<0.05。
组别KD组A549细胞PC9细胞SD组A549细胞PC9细胞肿瘤体积(mm3)肿瘤质量(g)抑瘤率(%)232.81 ± 85.79*1632.96 ± 240.85*0.13 ± 0.05*0.94 ± 0.30*58-133 357.52 ± 103.92 761.55 ± 277.82 0.23 ± 0.08 0.33 ± 0.20
2.3 A549、PC9细胞中OXCT1、BDH1基因表达比较 HPA数据库查询及分析结果显示,在A549细胞中,BDH1 RNA nTPM为2.3,OXCT1 RNA nTPM为2.3;在PC9细胞中,BDH1 RNA nTPM为16.2,OXCT1 RNA nTPM为19.5。OXCT1、BDH1基因在PC9细胞中的表达高于A549细胞。
2.4 KD组与SD组A549、PC9细胞裸鼠移植瘤的差异表达基因
2.4.1 两组酮代谢关键基因表达比较 KD组A549细胞移植瘤中OXCT1基因(11.79 ± 2.98)表达低于SD组(57.01 ± 16.42),P<0.05。KD组PC9细胞移植瘤中OXCT1基因(311.00 ± 90.00)表达高于SD组(88.00 ± 11.36),P<0.05。A549荷瘤裸鼠SD组、KD组肿瘤中BDH1基因表达量分别为44.00 ±3.33、53.33 ± 3.78;PC9荷瘤裸鼠SD组、KD组肿瘤中BDH1基因表达量分别为203.00 ± 9.33、226.33 ±17.56。BDH1基因在KD组和SD组两种细胞移植瘤中的表达差异无统计学意义。
2.4.2 差异表达基因及聚类分析 SD组和KD组A549细胞移植瘤差异表达基因2 998个,与SD组相比,KD组中有1 600个基因表达下调,1 398个基因表达上调。SD组和KD组PC9细胞移植瘤差异表达基因1 229个,与SD组相比,KD组中有648个基因表达下调,581个基因表达上调。见OSID码图1。不同饮食干预条件下,A549、PC9细胞裸鼠移植瘤中基因表达存在明显差异,且A549和PC9细胞荷瘤裸鼠相比,其肿瘤组织中基因表达也存在差异。见OSID码图2。
2.4.3 差异表达基因KEGG信号通路富集分析结果 SD组和KD组A549细胞移植瘤差异表达基因主要富集在细胞周期、ECM受体相互作用、细胞因子受体相互作用、神经活性的配体—受体相互作用、肿瘤信号通路、补体与凝血级联信号通路、JAKSTAT信号通路、人类T细胞白血病病毒1感染等信号通路。SD组和KD组PC9细胞移植瘤差异表达基因主要富集在细胞周期信号通路、IL-17信号通路、Relaxin信号通路、阿米巴病、蛋白质消化和吸收通路、卵母细胞减数分裂、p53信号通路、孕酮介导的卵母细胞成熟、AGE-RAGE和NF-κB等信号通路。见表5 ~ 6。
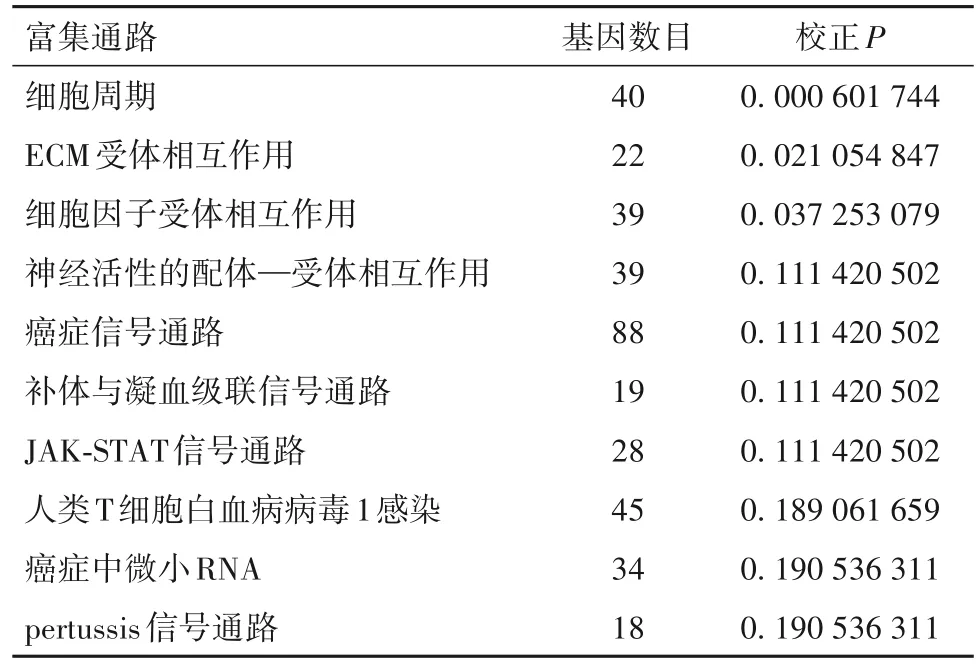
表5 两组A549细胞移植瘤差异表达基因KEGG信号通路分析结果(校正P值排序前10位)
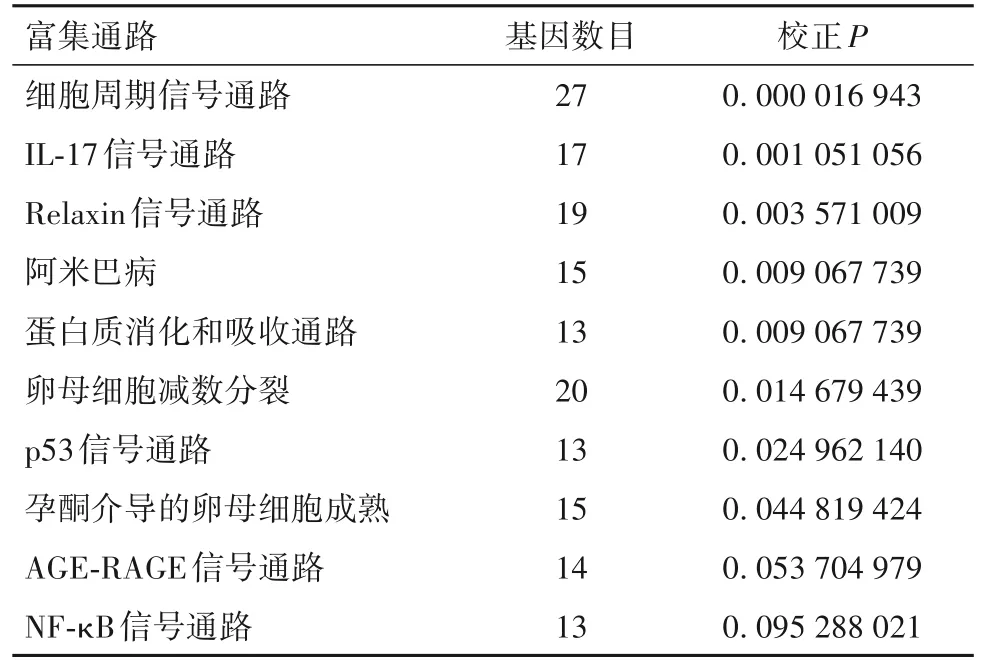
表6 两组PC9细胞移植瘤差异表达基因KEGG信号通路分析结果(校正P值排序前10位)
3 讨论
2021年NCCN指南V1版肺癌治疗方案指出,EGFR突变作为肿瘤发病重要的驱动因子,30%以上的肺癌患者存在该基因突变;V5版指出KRAS是非小细胞肺癌常见的致癌突变,在中国人群发生率约为9.8%,仅次于EGFR突变。针对EGFR、KRAS的药物疗效更好,患者容易耐受,可明显延长患者生存期,这也是肺癌患者治疗前尽量做基因突变检测的原因。但随着靶向药的反复使用,除了治疗费用昂贵外,患者逐渐出现获得性耐药,一定程度上限制了其在临床上的应用[10-11]。因此,继续探索肺癌治疗有效手段,有望让更多患者从中受益。
膳食结构在人类疾病发生发展和转归中起到很重要的作用[12-13]。生酮饮食最早用于脑部疾病(如癫痫)的治疗,因疗效显著而被确立为一种食疗方案[14]。随着研究不断深入,许多学者将生酮饮食与代谢性疾病的治疗联系在一起[15-16]。肿瘤被认为是一种代谢性疾病,能量代谢重编程使肿瘤获得迅速的发生发展和侵袭转移[17-18]。目前研究发现,酮体在肝脏脂肪酸氧化分解的主要产物β-HB通过与Hcar2(一种G蛋白偶联受体)结合并激活Hopx表达,引起细胞周期阻滞来抑制结肠癌细胞的生长[19]。生酮饮食除了对葡萄糖/胰岛素信号发挥抑制作用外,还可以通过降低氧化应激、线粒体代谢和炎症反应抑制肿瘤的增殖[20]。虽然目前生酮饮食抗肿瘤治疗相关研究已经取得巨大进展,然而其具体的作用机制尚未完全阐明。
β-HB作为生酮饮食产生的主要脂质代谢产物,常用于体内外肿瘤细胞酮体代谢相关研究[21-22]。前期研究中我们对突变型肺癌细胞株开展β-HB干预实验,发现生酮饮食可抑制A549细胞的增殖和迁移,但可促进PC9细胞增殖和迁移的表型(数据暂未发表)。为了进一步探索潜在机制,本研究建立A549、PC9细胞裸鼠移植瘤模型,分别采用生酮饮食和标准饮食干预,结果发现KD组裸鼠血酮体明显升高,符合生酮饮食治疗动物模型数据标准。体质量直接反映动物的整体状态,两组相比无明显差异,病理检查显示饮食干预对裸鼠脏器无明显病理损害,说明生酮饮食对裸鼠无明显副作用。肿瘤体积和瘤重测量结果表明,生酮饮食可抑制A549移植瘤生长但促进PC9细胞移植瘤生长,这与体外实验结果相吻合。此外,我们前期实验同样证实生酮饮食能够抑制A549细胞增殖[23],这说明该实验结果可信且具有良好的重复性。
据文献报道,向无血清的培养基中加入β-HB能够促进肺癌H1299细胞的增殖和迁移,进一步研究发现该细胞中OXCT1表达升高,且可以通过激活NF-κB信号通路来促进非小细胞肺癌的生长和迁移[24]。HPA数据库分析发现,PC9细胞中OXCT1基因表达高于A549细胞,肿瘤组织测序结果进一步印证数据库分析结果。据此,我们推测生酮饮食干预后,PC9细胞和PC9细胞移植瘤的生长明显加快,可能与酮体代谢增强相关,具体机制尚未阐明,这也是下一步需要探究的问题。有研究发现对EGFR突变型非小细胞肺癌靶向治疗容易产生获得性耐药,降脂药物和分子靶向药物联合使用不仅可以增强体外治疗效果,还可以减缓体内肿瘤的生长[25],这提示对人EGFR基因突变型肺腺癌可采用与降低血脂的药物联合治疗方案。
从差异基因表达和聚类分析结果来看,两种裸鼠移植瘤基因表达存在明显差异,且每种荷瘤裸鼠采取不同的饮食干预,同样明显影响肿瘤组织中基因的表达。针对差异表达基因进行KEGG信号通路富集分析发现,生酮饮食对A549细胞移植瘤的生长抑制作用可能与差异表达基因富集信号通路中细胞周期阻滞和JAK-STAT信号通路激活相关[26]。在PC9细胞移植瘤测序结果中,许多差异表达基因均富集在重要的肿瘤信号通路,例如IL-17、Relaxin、AGE-RAGE和NF-κB等信号通路[27-29],提示生酮饮食干预促进PC9细胞增殖可能与以上信号通路激活有关,具体的作用机制还需要大量实验进行验证。
综上所述,本研究选择两种经典基因突变型肺癌细胞株PC9、A549作为研究对象,在前期体外实验基础上,通过体内实验进一步证实生酮饮食干预可导致突变型细胞株出现相反增殖表型。接下来通过对肿瘤组织开展转录组测序分析,找到荷瘤裸鼠不同干预条件下肿瘤组织中存在差异表达的酮代谢关键酶和活化信号通路。以上研究结果提示生酮饮食对EGFR、KRAS突变型肺癌均有一定调控作用,有望为突变型肺癌的治疗提供参考。
