新疆农牧区老年肌少症患者外周血PBMC中TWEAK、Fn14及NF-κB通路基因表达分析
2023-12-01赵艳姣刘金玲卓娅买买提乌斯满冯智群杨星雨王红梅
赵艳姣,刘金玲,卓娅·买买提乌斯满,冯智群,杨星雨,王红梅
1 新疆医科大学研究生学院,乌鲁木齐830000;2 新疆维吾尔自治区人民医院综合保健内科二病区;3 石河子大学医学院
随着社会经济、医疗水平的提高及人们保健意识的增强,人口平均寿命逐渐延长,老龄化趋势日益明显[1]。人类衰老过程常伴随着骨骼肌质量和功能下降,其严重下降可致肌肉减少症(后简称肌少症)。肌少症为年龄相关的骨骼肌肌量下降、肌肉力量和(或)躯体功能低下[2],可增加老年人群认知障碍、骨折、跌倒、住院和全因死亡的风险[3]。目前肌少症的发病机制尚未明确,低水平的慢性炎症状态被认为是其重要发病机制之一,即促炎细胞因子[如肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)等]水平升高[4]。肿瘤坏死因子样细胞凋亡弱诱导物(TWEAK)属于TNF超家族促炎细胞因子。TWEAK/成纤维细胞生长因子诱导早期反应蛋白14(Fn14)轴与多种生物学反应有关,包括炎症、血管生成、骨骼肌萎缩和细胞凋亡等[5]。研究表明,TWEAK可通过激活泛素—蛋白酶体和核因子κB(NF-κB)系统导致蛋白合成减少、水解增强及炎症因子升高,造成肌萎缩和功能减退[6]。目前国内外关于肌少症患者TWEAK/Fn14轴及其下游NF-κB通路因子表达变化的研究较少。2022年1—12月,本研究观察了新疆农牧区老年肌少症患者外周血单个核细胞(PBMC)中TWEAK、Fn14及NF-κB信号通路关键分子的表达变化,并分析其与老年肌少症发病的相关性。现报告如下。
1 研究对象与方法
1.1 研究对象 纳入标准:年龄≥65岁;具有本地户口的常住农牧区居民;能独立行走,未使用辅具。排除有认知障碍、言语障碍、听力障碍者,精神疾病患者,有代谢性疾病及重要器官功能衰竭等病史者,近期有手术史者,服用激素类药物者,合并感染性疾病者,体内配戴心脏起搏器等电子医疗器械者,恶性肿瘤、肺结核等消耗性疾病患者。肌少症诊断标准参考中国老年人肌少症诊疗专家共识(2021)及2019年亚洲肌少症工作组制定的标准[7]。采用多级随机抽样方法,于北疆木垒县、南疆洛浦县农牧区居住的社区老年人群中进行抽样,选取肌少症患者与健康人群各40例分别纳入病例组和对照组。具体抽样过程及方法见OSID码图1。由经过统一培训的专职人员收集研究对象的性别、年龄、身高、骨骼肌指数(SMI)、握力、步速、收缩压、舒张压、民族、学历、婚育史等信息。本研究经过新疆维吾尔自治区人民医院医学伦理委员会批准,所有参与者签署知情同意书。病例组男29例、女11例,汉族27例、其他民族13例,文化程度为高中及以下16例、高中以上24例,吸烟史12例、饮酒史8例,合并高血压27例、冠心病11例、糖尿病17例。对照组男23例、女17例,汉族19例、其他民族21例,文化程度为高中及以下22例、高中以上18例,吸烟史10例、饮酒史9例,合并高血压29例、冠心病8例、糖尿病18例。病例组与对照组年龄、性别、民族、文化程度、收缩压(SBP)、舒张压(DBP)、血生化指标[谷氨酸氨基转移酶(ALT)、门冬氨酸氨基转移酶(AST)、肌酐(Cr)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)]、握力、步速、吸烟史、饮酒史及合并高血压、糖尿病、冠心病情况差异均无统计学意义(P均>0.05)。病例组SMI低于对照组(P<0.05)。详见表1。
表1 病例组与对照组临床资料比较(n=80, )
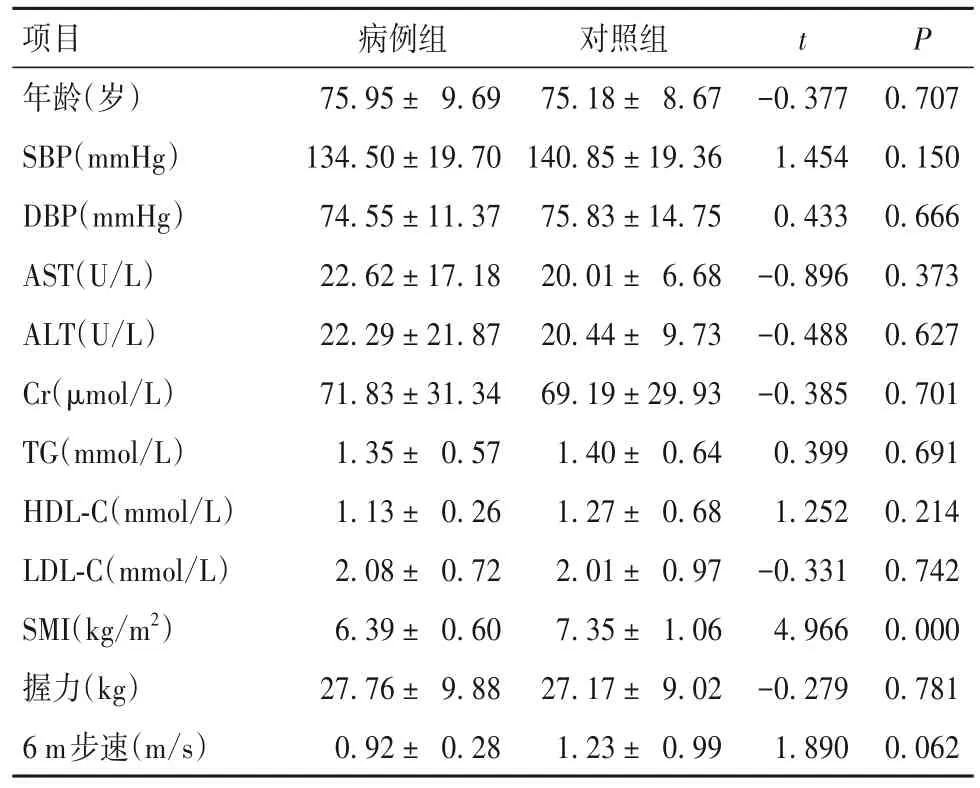
表1 病例组与对照组临床资料比较(n=80, )
项目年龄(岁)SBP(mmHg)DBP(mmHg)AST(U/L)ALT(U/L)Cr(μmol/L)TG(mmol/L)HDL-C(mmol/L)LDL-C(mmol/L)SMI(kg/m2)握力(kg)6 m步速(m/s)病例组75.95 ± 9.69 134.50 ± 19.70 74.55 ± 11.37 22.62 ± 17.18 22.29 ± 21.87 71.83 ± 31.34 1.35 ± 0.57 1.13 ± 0.26 2.08 ± 0.72 6.39 ± 0.60 27.76 ± 9.88 0.92 ± 0.28对照组75.18 ± 8.67 140.85 ± 19.36 75.83 ± 14.75 20.01 ± 6.68 20.44 ± 9.73 69.19 ± 29.93 1.40 ± 0.64 1.27 ± 0.68 2.01 ± 0.97 7.35 ± 1.06 27.17 ± 9.02 1.23 ± 0.99 t P-0.377 1.454 0.433-0.896-0.488-0.385 0.399 1.252-0.331 4.966-0.279 1.890 0.707 0.150 0.666 0.373 0.627 0.701 0.691 0.214 0.742 0.000 0.781 0.062
1.2 外周血PBMC中TWEAK/Fn14及其下游NF-κB信号通路基因检测 采集两组空腹静脉血至少5 mL,入EDTA抗凝的采血管中,充分混匀后立即进行梯度离心,分离血清与PBMC。将PBMC添加1 mL的TRIzol试剂,储存于-80 ℃冰箱。采用实时荧光定量PCR法检测PBMC中的TWEAK、Fn14、IκB激酶α(IKKα)、IκB激酶β(IKKβ)、NF-κB p65 mRNA。通过TRIzol法提取收集好的PBMC总RNA,进行cDNA合成。使用Primer5软件设计TWEAK、Fn14、IKKα、IKKβ、NF-κB p65基因及内参基因GAPDH引物序列,见表2。PCR体系包括Evagreen 2×qPCR Master Mix 10 μL、上游引物0.6 μL、下游引物0.6 μL、cDNA 2 μL、RNase-free Water 6.8 μL,总反应体积为20 μL。PCR条件:预变性95 ℃ 10 min、1个循环,变性95 ℃ 15 s,退火/延伸60 ℃ 60 s,共40个循环。采用SYBR法进行荧光定量检测,以2-ΔΔCt表示目的基因相对表达量。

表2 目的基因与内参基因引物序列
1.3 统计学方法 采用SPSS26.0统计软件。计量资料以表示,采用t检验。计数资料以例(%)表示,采用χ2检验。以性别、年龄作为协变量,采用协方差分析,比较肌少症组、对照组相关基因的表达差异。相关性分析采用偏相关分析法。P<0.05为差异有统计学意义。
2 结果
2.1 两组外周血PBMC中TWEAK/Fn14及其下游NF-κB信号通路分子表达比较 病例组外周血PBMC中TWEAK、Fn14、IKKα、IKKβ mRNA表达均高于对照组(P均<0.05)。见表3。校正性别、年龄后,协方差分析结果显示,病例组外周血PBMC中TWEAK、Fn14、IKKα、IKKβ mRNA表达高于对照组(P均<0.05)。见表4。
表3 两组外周血PBMC中TWEAK、Fn14、IKKα、IKKβ、NF-κB p65 mRNA表达比较()
注:与对照组相比,*P<0.05。
组别病例组对照组NF-κB p65 1.578 ± 0.987 1.374 ± 1.306 n 40 40 TWEAK 1.364 ± 0.644*1.073 ± 0.464 Fn14 2.938 ± 2.195*1.743 ± 1.464 IKKα 2.149 ± 1.332*1.459 ± 0.959 IKKβ 1.987 ± 1.174*1.456 ± 0.902

表4 校正性别、年龄后两组外周血PBMC中TWEAK、Fn14、IKKα、IKKβ、NF-κB p65 mRNA表达比较
2.2 病例组外周血PBMC中TWEAK、Fn14表达与NF-κB信号通路基因表达的相关性 校正性别、年龄后,外周血PBMC中TWEAK、Fn14 mRNA表达呈正相关(r=0.424,P<0.01),与IKKα、IKKβ mRNA表达无相关性;Fn14 mRNA表达与IKKα、IKKβ mRNA表达均呈正相关(r分别为0.264、0.284,P均<0.05);IKKα、IKKβ mRNA表达与NF-κB p65 mRNA表达均呈正相关(r分别为0.724、0.660,P均<0.01)。
3 讨论
骨骼肌的正常结构和功能在很大程度上取决于肌肉微环境的稳定性。炎性细胞因子是肌肉微环境的重要组成部分,如TNF-α、IL-6是分解反应的重要介质[8]。随着衰老过程,人体会出现慢性低度炎症状态,即老年人普遍存在无症状、持续性、非特异性的轻微炎症状态,为非特异性的C反应蛋白、TNF-α、IL-6水平轻微升高,导致慢性病、衰弱、残疾和过早死亡的风险增加[9]。研究表明,慢性低度炎症可通过信号转导途径影响肌肉蛋白质的合成和分解,导致肌肉质量、力量和功能的减弱[10]。
TWEAK是一种促炎细胞因子,属于TNF超家族配体,在其C末端结构域被蛋白水解切割成可溶形式[11],并作为三聚分子发出信号。TWEAK的膜结合和可溶性形式都具有生物活性。通常TWEAK的众多生物学反应是通过与Fn14结合而发生。Fn14是一种属于TNF受体超家族(TNFRSF)的Ⅰ型跨膜受体,Fn14仅富含一个半胱氨酸的重复序列,是该家族成员中最小的[12]。与TNFRSF其他成员相似,Fn14的细胞质结构域包含一个TRAF结合位点,在TWEAK刺激时允许下游信号转导[13]。正常情况下,Fn14在大多数细胞和组织中表达水平相对较低,然而在组织损伤和各种病理状况下,Fn14表达急剧增加[14]。ENWERE等[15]研究表明,不同水平的TWEAK可促进或抑制肌原性分化,低水平的TWEAK能够促进成肌细胞融合,高水平时则抑制肌原性分化。在严重损伤或慢性疾病时,持续的TWEAK/Fn14激活会导致肌萎缩[16]。多项动物模型实验结果显示,TWEAK、Fn14表达增加可抑制骨骼肌再生和生长[17-20]。一项研究表明,与非肌少症患者相比,调整混杂因素后,高水平的TWEAK(>1 276.48 pg/mL)可使肌少症的发生风险增加13.4倍[21]。本研究参与者均为老年人,且合并慢性疾病,依据上述理论,Fn14表达会高于正常生理状态,病例组外周血PBMC中TWEAK、Fn14 mRNA表达高于对照组;且协方差分析提示,在校正年龄、性别后病例组TWEAK、Fn14 mRNA亦高于对照组;另外,Fn14作为TWEAK的特异性受体,偏相关分析(校正性别、年龄)提示二者表达呈正相关,进一步证实老年人肌少症与外周血PBMC中TWEAK、Fn14 mRNA高表达相关。
低水平的慢性炎症状态已被认为是肌少症的重要发病机制之一。在相关信号通路中,NF-κB是维持骨骼肌稳态的关键因素。ZHANG等[22]研究表明,TNF-α、IL-6等炎症因子可通过诱导NF-κB,加快肌肉蛋白降解,导致肌少症发生。RATAJCZAK等[23]发现,NF-κB信号通路是TWEAK/Fn14的下游靶点。NF-κB是主要的促炎转录因子,它不仅可以介导炎性细胞因子的作用,还可增加其表达[24]。在哺乳动物细胞中,NF-κB以二聚体形式参与炎症、细胞凋亡、细胞增殖等多种进程,最常见的是NF-κB p50/p65和NF-κB p50/p50[25]。NF-κB可通过经典途径和替代途径被激活。TNF-α激活经典途径是通过激活IKK复合物触发κB抑制剂(IκB)快速磷酸化,使p65/RelA和p50滞留在细胞质中,而NF-κB转录因子(如p65/RelA、p50和c-Rel)穿梭到细胞核发挥作用[26]。非经典途径是前体蛋白p100被IKKa同二聚体磷酸化,介导p100水解成p52,p52与RelB结合易位到细胞核[27]。可见IKK复合物可激活NF-κB通路,该复合物包含IKKα、IKKβ及IKKγ/NEMO[28]。研究表明,在衰老过程中NF-κB表达增加,老年人肌肉中炎症相关的NF-κB蛋白表达水平是年轻人的4倍[29]。JIN等[30]发现,针刺治疗可减少衰老骨骼肌中NF-κB p65的激活,从而改善肌萎缩。动物实验结果显示,香烟烟雾暴露导致的肌萎缩小鼠IKK、NF-κB p65 mRNA显著升高[31-32]。本研究结果显示,病例组外周血PBMC中IKKα、IKKβ mRNA高于对照组,在校正性别、年龄后上述结果不变,证实老年人肌少症与外周血PBMC中IKKα、IKKβ mRNA高表达相关。经偏相关分析显示,Fn14 mRNA与IKKα、IKKβ mRNA表达均呈正相关,IKKα、IKKβ mRNA表达与NF-κB p65 mRNA表达也呈正相关;IKKα、IKKβ可激活NF-κB通路发挥作用,这提示TWEAK/Fn14与NF-κB的激活相关。本研究中两组NF-κB p65 mRNA表达差异无统计学意义,可能是经典途径激活后的NF-κB转录因子不只p65/RelA一种,同时还有p50、c-Rel等因子,同时也不能排除IKKa可激活非经典途径发挥作用,因此后续研究中需观察其他因子的表达差异。此外,目前关于人类肌少症的上述研究数据相对较少,仍需大样本研究进一步分析。
综上,本研究发现,新疆农牧区老年肌少症患者外周血PBMC中TWEAK、Fn14、IKKα、IKKβ mRNA高表达,TWEAK、Fn14 mRNA表达与IKKα、IKKβ mRNA表达有相关性,TWEAK、Fn14可能通过调节IKK激活NF-κB炎症通路,参与老年人肌少症的发生发展。然而本研究为横断面研究,只能提示相关性,且样本量不大,尚需扩大样本量进一步进行前瞻性研究来验证以上结果,并开展细胞和动物实验研究相关机制。
