黄芩多糖对PRV感染猪睾丸细胞的作用及其差异基因表达分析
2023-12-01张王芝舒相华张雅靖李长妹杨春坤宋春莲
张王芝, 舒相华, 张 莹, 张雅靖, 李长妹, 杨春坤, 全 伟, 宋春莲
(1.云南农业大学动物医学院, 云南 昆明 650201 ; 2.云南省绿春县普查中心, 云南 绿春 662599 ;3. 云南省农村科技服务中心, 云南 昆明 650021)
中医药的临床防治毒副作用小,能提高机体免疫力,控制病毒复制或阻止病毒致细胞病变等,在治疗病毒性疾病方面显示出抗生素不可替代的优势[1]。目前,已知黄芩多糖(ScutellariabaicalensisGeorgi polysaccharide,SBGP)是黄芩提取黄酮过程中产生的副产物,具有免疫调节和抗病毒等功效[2]。许多研究表明,不同浓度的黄芩多糖能显著抑制新城疫病毒对鸡胚成纤维细胞的侵染作用和猪繁殖与呼吸综合征病毒的增殖,且通过小鼠附睾精子畸形试验发现,黄芩多糖无生殖遗传毒性[3-5]。伪狂犬病病毒(Pseudorabies virus,PRV)可感染许多哺乳动物,猪是其自然宿主,被感染后极易引起繁殖障碍和生殖功能下降等症状[6],PRV感染公猪后大多导致睾丸肿胀或萎缩,引发睾丸炎,精子活力下降,丧失种用能力[7],因此给许多国家的养猪业造成重大经济损失。免疫接种是防控PRV感染仔猪的有效手段,但目前可用的PRV商业疫苗并不能有效预防PRV变异株感染[8]。猪睾丸(Swine testis,ST)细胞能提高抗原效价,是制备伪狂犬病(Pseudorabies,PR)疫苗的首选细胞[9]。转录组学为探索中药治疗疾病的机制提供了新思路,应用RNA-seq转录组测序技术研究宿主基因转录本信息,揭示药物多靶点影响基因差异表达水平和调控疾病发展的分子机制。
本试验旨在研究黄芩多糖对PRV感染ST细胞的作用,并通过RNA-Seq测序分析其相关差异基因的表达,以期为进一步研究黄芩多糖调控PRV感染的宿主机制提供参考。
1 材料与方法
1.1 材料来源 黄芩多糖粉末,购自北京索莱宝科技有限公司;ST细胞,购自湖南丰晖生物科技有限公司,置于液氮中保存;PRV-XD-2014毒株病毒液,由云南农业大学传染病实验室留存。
1.2 主要试剂和仪器 胎牛血清和DMEM高糖培养基,均购自Gibco公司;磷酸盐缓冲液(Phosphate buffer saline,PBS,1×)、二甲基亚砜(Dimethylsulfoxide,DMSO)和细胞冻存液,均购自昆明赞纳生物科技有限公司;CCK-8试剂盒,购自日本东仁化学科技有限公司;蒸馏水(Distilled water),购自Invitrogen公司;0.25%胰蛋白酶,购自HyClone公司;青-链霉素(双抗),购自北京索莱宝科技有限公司;猪肿瘤坏死因子α(Tumor necrosis factor-α,TNF-α)、猪γ干扰素(Interferon-γ,IFN-γ)和猪α干扰素(Interferon-α,IFN-α) ELISA检测试剂盒,均购自上海酶联生物科技有限公司。倒置显微镜,重庆光电仪器有限公司产品;全波长酶标仪,Thermo Fisher Scientific公司产品。
1.3 试验方法
1.3.1 主要溶液配制 黄芩多糖溶液:称取3.125 g黄芩多糖粉末加入1 L蒸馏水,振荡混匀后备用。
1.3.2 细胞复苏和培养 将ST细胞冻存管置于37 ℃水浴锅中快速摇晃融化后,将细胞悬液转移到10 mL离心管,加3 mL DMEM高糖培养基混匀,1 000 r/min离心4 min;弃上清液,加1 mL细胞完全培养基(含10%胎牛血清、1%双抗的DMEM高糖培养基)吹匀,吸取细胞悬液加入T25培养瓶中,补加4 mL细胞完全培养基,置于CO2恒温培养箱中培养。待细胞汇合度达90%时,用于后续试验。
1.3.3 PRV扩增 将1 mL PRV-XD-2014毒株病毒液接种于ST细胞,吸附1 h后弃去病毒液,加入5 mL细胞维持培养基(含2%胎牛血清的DMEM高糖培养基)继续培养。待90%的细胞发生细胞病变效应(Cytopathic effect,CPE)时,-80 ℃反复冻融3次,4 ℃、12 000 r/min离心15 min,取上清病毒液分装,于-80 ℃长期保存。
1.3.4 50%组织细胞感染量(Median tissue culture infective dose,TCID50)测定 将ST细胞接种于96孔细胞培养板中,1×104个/孔,用PBS清洗2遍,加入用细胞维持培养基按10倍倍比梯度法稀释的病毒液,稀释度分别为10-1~10-10,每个稀释度设置8个重复,另设只加细胞维持培养基的细胞作为对照,置于CO2恒温培养箱中培养。逐日观察CPE情况并记录,根据Reed-Muench法按公式(1)计算病毒滴度。
lgTCID50=距离比例×稀释对数间的差值+高于50%病变率的稀释度的对数
(1)
距离比例=(高于50%病变率的百分数-50%)÷(高于50%病变率的百分数-低于50%病变率的百分数)
(2)
1.3.5 黄芩多糖对ST细胞最大安全浓度的测定 将ST细胞以1×104个/孔接种到96孔板中,用PBS清洗2遍,加入用DMEM 高糖培养基按2倍倍比稀释的9个浓度的黄芩多糖溶液(即1 562.50、781.25、390.63、195.31、97.66、48.83、24.41、12.21和6.10 μg/mL),另设不加黄芩多糖溶液的DMEM高糖培养基培养的ST细胞作为空白对照组和只加DMEM高糖培养基作为空白组,每个浓度组、空白对照组和空白组均设6个复孔,培养48 h后,按照CCK-8试剂盒说明书操作,根据公式(3)计算细胞存活率,以确定黄芩多糖对ST细胞的最大安全浓度(Cmax)。
细胞存活率(%)=[(试验孔OD450 nm-空白孔OD450 nm)÷(空白对照孔OD450 nm-空白孔OD450 nm)]×100%
(3)
1.3.6 黄芩多糖对PRV感染ST细胞的作用 将ST细胞以1×104个/孔接种于96孔板,预防模式组细胞分别先加入不同浓度的黄芩多糖溶液(Cmax、1/2Cmax、1/4Cmax、1/8Cmax和1/16Cmax)培养4 h后,再加入100 TCID50的PRV病毒液,0.1 mL/孔,孵育2 h后PBS洗2遍,加细胞维持培养基继续培养;治疗模式组细胞先接种100 TCID50的PRV病毒液,0.1 mL/孔,孵育2 h,PBS洗2遍后,再使用不同浓度的黄芩多糖溶液处理;杀毒模式组细胞则先分别将不同浓度的黄芩多糖溶液和100 TCID50的PRV病毒液混合,再将各浓度混合液加至细胞中,0.1 mL/孔,处理2 h后PBS洗2遍,加细胞维持培养基继续培养;同时设置只接种PRV病毒液的细胞作为PRV对照组和不作任何处理的细胞作为空白对照组,每组均设6个复孔。PRV对照组出现典型CPE时,按照CCK-8试剂盒操作说明书测定各组细胞OD450 nm值,并于倒置显微镜下观察CPE。参照参考文献[12]进行黄芩多糖抗病毒活性评价:处理组OD450 nm值极显著大于PRV对照组,表明具有显著抗病毒活性;OD450 nm值显著大于PRV对照组,表明具有一定抗病毒活性;OD450 mm值与PRV对照组差异不显著,表明无抗病毒活性。按照公式(4)计算黄芩多糖的治疗指数(Therapeutic index,TI)。
TI=最大安全浓度÷最小有效浓度
(4)
细胞培养48 h后,收集各组细胞培养液,1 500 r/min离心20 min,取上清液,按照ELISA检测试剂盒说明书测定IFN-γ、IFN-α和TNF-α的含量。
1.3.7 细胞总RNA的提取和转录组数据的测定 选取效果较优的空白对照组、PRV对照组和最佳药物浓度组,每组3个重复样本,在24 h时采用TRIzol法提取细胞总RNA,送广州基迪奥生物科技有限公司进行mRNA 样品质量检测和纯化,并构建测序文库。
1.3.8 统计分析 数据使用SPSS 20.0软件进行处理,Graphpad Prism 8制图。试验结果以“平均值±标准差”表示,采用单因素分析方法进行显著性分析,P<0.05表示差异显著,P<0.01表示差异极显著。转录组数据采用RPKM(Reads Per Kbper Million mapped reads)方法计算基因表达量,以差异表达倍数为2,| log2(Fold change)|>1,且错误发现率(False discovery rate,FDR)<0.05 为筛选标准。其中FDR<0.05时,log2(Fold change)≥1的为上调表达基因,log2(Fold change)≤-1的为下调表达基因。使用NCBI 数据库中的BLASTX对确定的对应基因进行比较。基因本体论(Gene Ontology,GO)(http://www.geneontology.org)和 Kyoto京都基因与基因组百科全书(Encyclopedia of Genes and Genomes,KEGG)通路(http://www.genome.jp/kegg/)使用DEGseq软件和超几何检验进行分析,随后使用Omicsmart 动态实时数据分析平台(http://www.omicsmart.com)进行总的数据分析。
2 结果
2.1 PRV TCID50的测定 按照Reed-Muench法计算得PRV病毒滴度为10-5.39TCID50/0.1 mL。
2.2 黄芩多糖对ST细胞最大安全浓度的测定 如图1所示,在一定范围内,细胞存活率随着黄芩多糖浓度的降低逐渐升高。与空白对照组相比,当黄芩多糖浓度≤97.66 μg/mL时,OD450 nm值差异均不显著(P>0.05),即97.66 μg/mL为黄芩多糖对ST细胞的最大安全浓度。
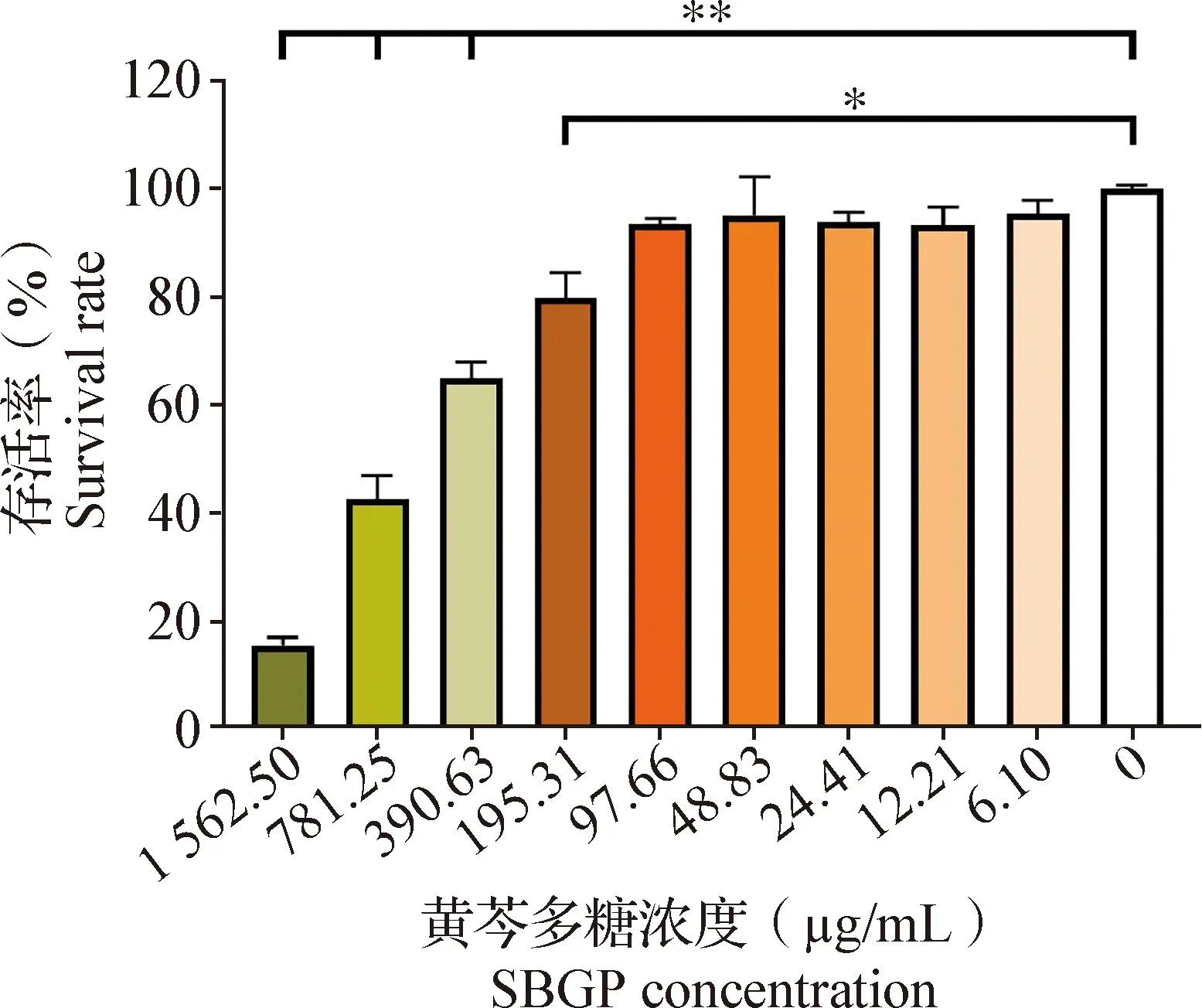
图1 ST细胞存活率测定
2.3 黄芩多糖对PRV感染ST细胞的作用
2.3.1 CCK8检测 如图2所示,不同模式下PRV对照组OD450 nm值均极显著低于空白对照组(P<0.01),即PRV感染可导致ST细胞存活率极显著降低,表明建模成功。预防模式中,97.66 μg/mL黄芩多糖处理组的OD450 nm值均极显著高于PRV对照组(P<0.01),具有显著抗病毒活性,当黄芩多糖浓度<48.83 μg/mL时,OD450 nm值与PRV对照组差异均不显著(P>0.05),即48.83 μg/mL为预防模式中黄芩多糖对ST细胞的最小有效浓度;TI为2。治疗模式中,97.66 μg/mL和48.83 μg/mL黄芩多糖处理组的OD450 nm值均极显著高于PRV对照组(P<0.01),具有显著抗病毒活性;当黄芩多糖浓度<24.41 μg/mL时,OD450 nm值与PRV对照组差异均不显著(P>0.05),即24.41 μg/mL为治疗模式中黄芩多糖对ST细胞的最小有效浓度;TI为4。杀毒模式中,97.66 μg/mL和24.41 μg/mL黄芩多糖处理组的OD450 nm值均极显著高于PRV对照组(P<0.01),具有显著抗病毒活性;当黄芩多糖浓度<24.41 μg/mL时,OD450 nm值与PRV对照组差异均不显著(P>0.05),即24.41 μg/mL为治疗模式中黄芩多糖对ST细胞的最小有效浓度;TI为4。
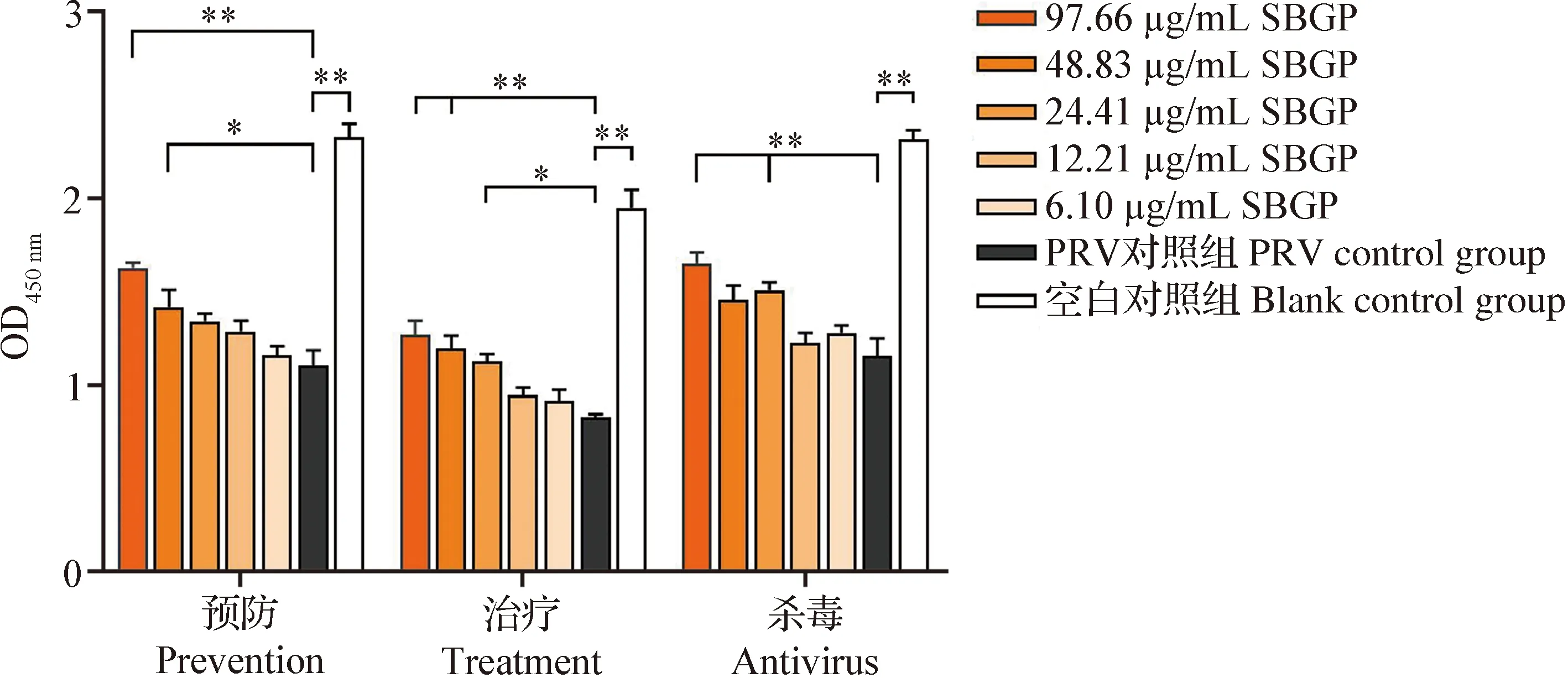
图2 预防、治疗和杀毒模式下ST细胞的OD450 nm值测定
综上,黄芩多糖在3个模式中均可显著提高PRV感染细胞的存活率,且浓度为97.66 μg/mL时效果最佳。根据TI可知,黄芩多糖的治疗和杀毒模式优于预防模式,且24.41 μg/mL以上浓度为有效药物浓度。
2.3.2 CPE变化情况 如图3所示,PRV对照组ST细胞出现皱缩、变圆、融合,形成葡萄串样细胞团,明显脱落和死亡等典型的CPE现象(图3B)。预防模式中,97.66和48.83 μg/mL黄芩多糖处理均能减轻PRV所引起的CPE(图3C1和3C2),24.41 μg/mL的 CPE与PRV对照组无明显差异(图3C3)。治疗和杀毒模式中,3个浓度的黄芩多糖处理均能减弱PRV感染引起的CPE(图3D1~3E3)。

图3 ST细胞病变(200×)
2.3.3 IFN-γ、IFN-α和TNF-α含量的测定 如图4所示,与空白对照组相比,PRV对照组IFN-γ和IFN-α含量均极显著降低(P<0.01),TNF-α含量极显著升高(P<0.01)。与PRV对照组相比,不同模式下IFN-γ含量在浓度为97.66 μg/mL和48.83 μg/mL的黄芩多糖处理后均极显著升高(P<0.01);IFN-α含量在浓度为97.66 μg/mL的黄芩多糖处理后均极显著升高(P<0.01);TNF-α含量在浓度为97.66 μg/mL的黄芩多糖处理后均极显著降低(P<0.01)。不同模式下3个浓度黄芩多糖处理组的IFN-γ、IFN-α和TNF-α含量与空白对照组相比差异均不显著(P>0.05)。
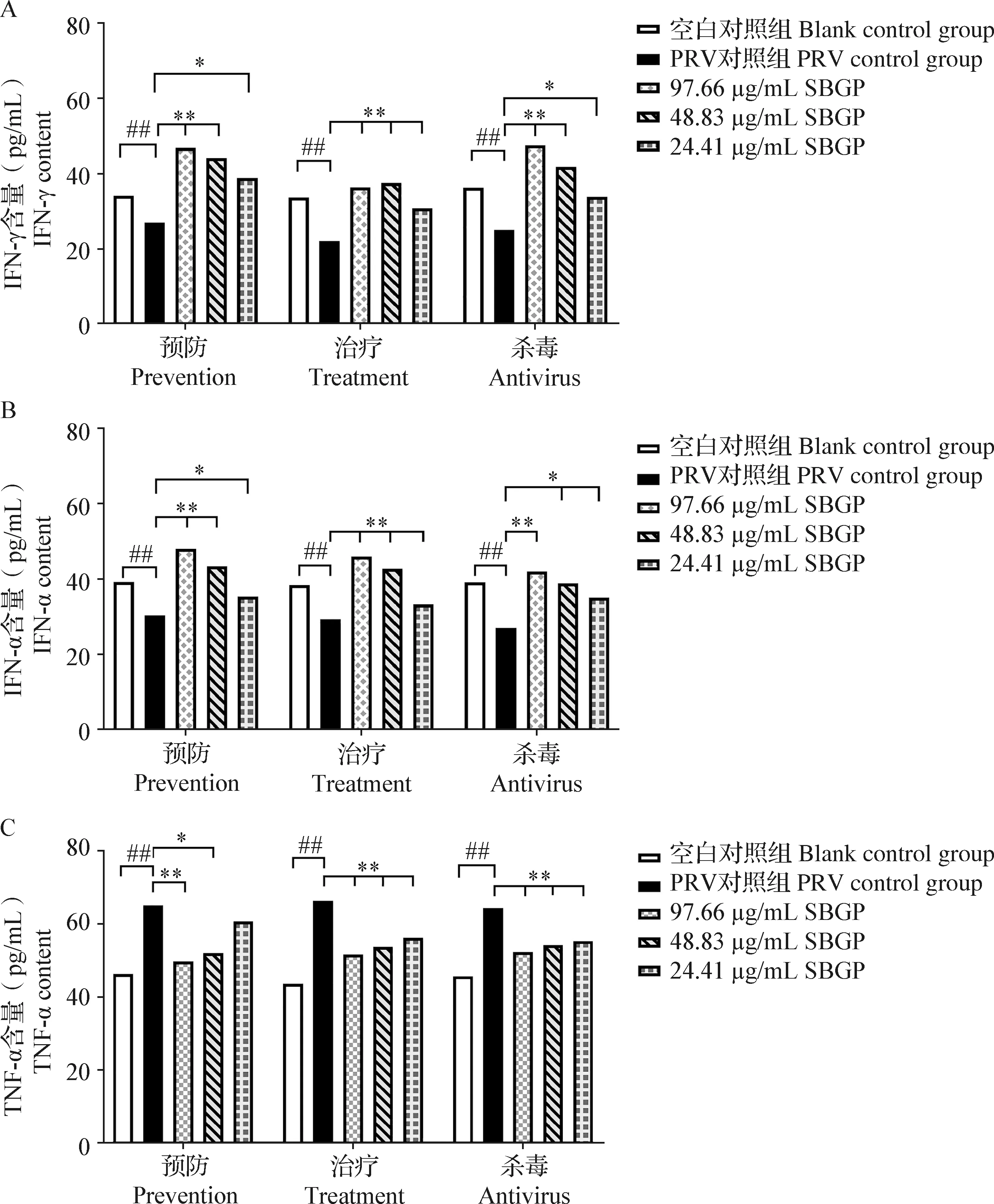
图4 预防、治疗和杀毒模式中ST细胞IFN-γ(A)、IFN-α(B)和TFN-α(C)含量
综上试验结果表明,黄芩多糖在3个模式中均可使PRV感染细胞的IFN-γ和IFN-α分泌增加,炎症因子TNF-α分泌减少;改善PRV引起的CPE,提高细胞存活率,且在浓度为97.66 μg/mL时效果最好。鉴于临床上主要以治疗为主,本试验选取治疗模式下97.66 μg/mL黄芩多糖处理组、空白对照组和PRV对照组进行转录组测序,分析黄芩多糖对PRV感染ST细胞作用的相关分子或药物靶点。
2.4 黄芩多糖对PRV感染ST细胞的差异基因表达
2.4.1 差异表达基因 如图5A所示,空白对照组和PRV对照组共有3 284个差异基因,其中1 528个上调,1 756个下调;PRV对照组和黄芩多糖治疗组共有531个差异基因,其中398个上调,133个下调。如图5B所示,3个组共同交集的差异基因有74个,其中,空白对照组与PRV对照组和空白对照组与黄芩多糖治疗组均上调、下调的基因分别为19和 55个;PRV对照组和黄芩多糖治疗组上调、下调的基因分别为70和 4个。74个基因中以SOCS3、VEGFA、ZBTB18、CLCN6、RSBN1、RBM47和TET2差异表达较为显著。
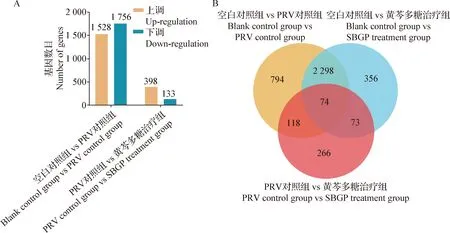
图5 差异基因分析
2.4.2 GO功能分析 从生物过程(Biological processes)、分子功能(Molecular function)和细胞组分(Cellular component)3个方面分析3个组差异基因的富集情况。空白对照组与PRV对照组比较,上调和下调的差异基因主要注释在细胞过程(Cellular process)、代谢过程(Metabolic process)和生物调节(Biological regulation)等生物过程中,结合(Binding)和催化活性(Catalyic activity)等分子功能中,以及细胞(Cell)和细胞器(Organelle)等细胞组分中(图6A)。PRV对照组与黄芩多糖治疗组比较,上调和下调的差异基因注释最多的条目分别是生物过程中的细胞过程(Cellular process),分子功能中的结合(Binding),细胞组分中的细胞(Cell)和细胞部分(Cell part)(图6B)。
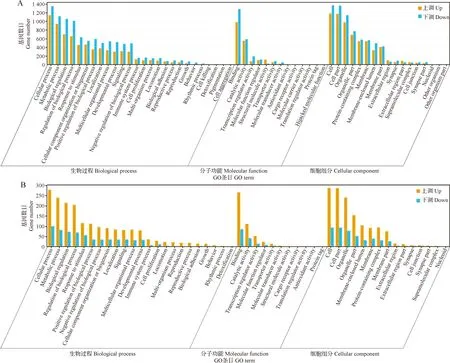
图6 差异基因GO富集分类图
综上,在空白对照组和PRV对照组主要富集的是下调基因,在PRV对照组和黄芩多糖治疗组中主要富集的是上调基因。显著富集的差异基因主要集中在生物过程中的细胞和代谢过程,细胞组分中的细胞和细胞器,分子功能中的催化和结合活性。
2.4.3 KEGG分析 对空白对照组与PRV对照组、PRV对照组与黄芩多糖治疗组间统计了富集显著性最高的15个KEGG通路。空白对照组与PRV对照组分别为:核糖体、剪接体、哺乳动物雷帕霉素靶蛋白(Mammalian target of rapamycin,mTOR)信号通路、泛素介导的蛋白水解、微小核糖核酸、细胞凋亡、内质网蛋白加工、缬氨酸、亮氨酸和异亮氨酸降解、RNA转运、焦点粘连、黏合连接通路、氧化磷酸化、内吞、丝裂原活化蛋白激酶(Mitogen-activated protein kinases,MAPK)信号通路和肿瘤坏死因子(Tumor necrosis factor,TNF)信号通路(图7A);PRV对照组与黄芩多糖治疗组分别为:TNF信号通路、MAPK信号通路、mTOR信号通路、胰岛素抵抗、粘连结、子宫内膜癌、矿物质吸收、叉头框蛋白O(Forkhead box O protein,FoxO)、腺苷酸激活蛋白激酶(AMP-activated protein kinase,AMPK)、神经营养素、Toll样受体(Toll-like receptors,TLR)、Hedgehog(Hh)信号通路、T细胞受体、NOD样受体(NOD-like receptors,NLRs)和磷脂酰肌醇3激酶-蛋白激酶B(Phosphatidylinositol 3 kinase-protein kinase B,PI3K-AKT)信号通路(图7B)。
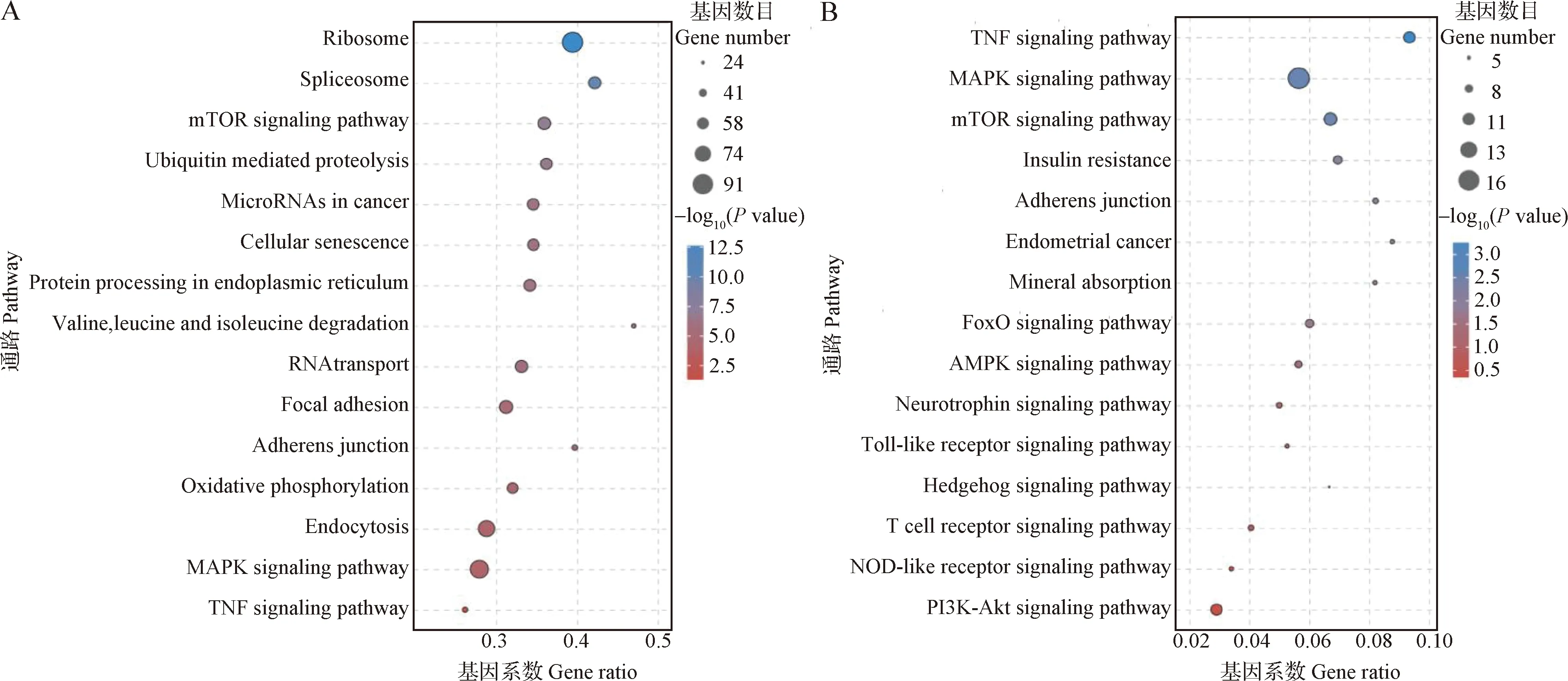
图7 KEGG通路分析气泡图
3 讨论
许多植物多糖,包括黄芪多糖、板蓝根多糖和金银花多糖等,均具有抗病毒作用,多糖和病毒的不同加入方式可以判定其是否能够与病毒结合达到直接抑制或杀灭病毒的作用[10]。宛燕飞[11]发现,仙人掌多糖对鸡新城疫病毒(Newcastle disease virus,NDV)具有明显的抑制作用,且先加仙人掌多糖再攻毒效果最优。王鑫滢等[12]利用细胞病变观察和MTT法研究3种不同给药方式下黄芩多糖体外抗NDV的活性,结果表明,黄芩多糖对NDV具有较好的预防和治疗作用,但对病毒的直接灭活作用相对较低。本试验与之相似,通过观察细胞形态变化和测定细胞存活率研究黄芩多糖对PRV感染ST细胞的作用,结果显示,预防、治疗和杀毒模式均能明显改善PRV引起的CPE,且能够提高细胞存活率。许多多糖对免疫系统都有调节作用,不仅可以激活T/B淋巴细胞、巨噬细胞和自然杀伤细胞等免疫细胞参与机体免疫,还可以刺激IFN产生,活化补体,实现多糖抗病毒作用[13]。机体免疫介导因子中,IFN-α和IFN-γ是抗病毒感染的主要细胞因子,由T淋巴细胞和NK细胞分泌,具有抑制病毒复制和防止病毒感染的作用,在免疫调节中发挥重要作用。王永霞等[14]研究表明,红树林淡紫拟青霉胞外多糖具有一定的抗单纯疱疹病毒(Herpes simplex virus,HSV-1)作用,可能是通过抑制病毒复制,刺激IFN-γ和IL-12分泌,抑制TNF-α产生完成的。本研究前期试验发现,PRV感染仔猪后,通过黄芩多糖治疗后可以提高仔猪的IFN-γ和IL-4含量,促进CD4+和CD8+分化,以增强其体液免疫和细胞免疫,并提高仔猪感染PRV后的存活率[15]。同样的,本试验发现,黄芩多糖在预防、治疗和杀毒模式中均可以促进IFN-γ和IFN-α细胞因子的释放,以抑制病毒而提高细胞存活率,还可以抑制炎性因子TNF-α的释放而发挥抗炎作用,改善PRV引起的CPE。
由上述试验结果可知,黄芩多糖对PRV感染ST细胞有一定保护作用,但潜在机制仍不清楚。因此,本试验结合RNA-seq深度挖掘黄芩多糖治疗组(97.66 μg/mL)、空白对照组和PRV对照组共交集差异基因74个,主要参与细胞代谢和结合活性等生物学过程。杨高娟[16]通过转录组测序技术分析PRV感染早期PK-15细胞差异基因,主要包括突触囊泡内吞作用、炎症应答、p53信号通路和细胞因子-细胞因子受体相互作用。本试验中,空白对照组和PRV对照组KEGG富集结果提示,MAPK信号通路、mTOR信号通路和细胞凋亡可能促进PRV体外增殖。侯子驰等[10]研究发现,多糖可与细胞表面特异性受体结合,激活细胞内各种信号转导通路,从而发挥免疫调节和抗病毒作用。有研究表明,板蓝根多糖可与TLR3受体结合,激活相关信号通路,抑制流感病毒复制[17]。刘丹华[18]利用转录组测序技术研究发现,在脂多糖(Lipopolysacharide,LPS)诱导鸡巨噬细胞HD11炎症模型中,黄芪多糖预处理能通过诱导SOCS3的高表达抑制NF-κBp65和p38MAPK的过度活化,降低炎性细胞因子IL-1β和TNF-α的释放,从而发挥抑制炎症的作用。另外,黄芩多糖可通过抑制NF-κB信号转导和NLRP3炎症体活化改善结肠炎[19]。本试验经转录组结果分析显示,黄芩多糖能调节TNF信号通路相关基因(SOCS3、CCL5、PIK3R1、CREB3L1、MLKL、FOS、CREB5、LIF、TNFRSF1A和MAP3K8)和TLR信号通路相关基因(TBK1、CCL5、PIK3R1、FOS和MAP3K8)过度表达,提示黄芩多糖对PRV感染ST细胞起到保护作用的机制可能与TNF信号通路和Toll样受体信号通路有关,但还需进一步研究。此外,MAPK、mTOR、AMPK、神经营养素和T细胞受体等信号通路上均有显著富集表达基因,黄芩多糖可能对这些信号通路有影响。
综上,黄芩多糖可显著减轻PRV引起的ST细胞存活率下降和病变,具有一定的保护作用;其作用机理可能是通过调节TNF和TLR信号通路中SOCS3、CCL5、FOS、PIK3R1和MAP3K8基因的表达。本试验结果为黄芩多糖调控PRV感染宿主机制的关键分子和药物靶点研究提供理论依据。
