泰兴市猪源沙门菌的分离鉴定和耐药性分析
2023-12-01桂文龙李巨银徐婷婷
桂文龙, 李巨银, 魏 宁, 徐婷婷
(江苏农牧科技职业学院动物医学院, 江苏 泰州 225300)
沙门菌(Salmonella)是一种重要的人兽共患病原菌,可以导致不同动物发病,包括引起人类发病。目前,全世界发现至少有67种O抗原和3 500个以上沙门菌血清型[1],而且绝大部分具有致病性。沙门菌感染可引起猪发生猪副伤寒,是目前养猪业中的一种较为常见的重要细菌性传染病,主要侵害6月龄以下仔猪,尤以1~4月龄仔猪多发,急性发病的猪常因败血症而死亡,慢性发病的猪表现为坏死性肠炎,有时可出现卡他性或干酪性肺炎,给养猪业带来较大的经济损失[2]。沙门菌均为非宿主适应型,可通过食物链传递给人类,造成人类发病。因此,研究沙门菌的流行情况和耐药性,对动物健康和公共卫生具有重要的意义[3]。当前,泰兴市猪源沙门菌的感染日趋严重,而针对泰兴市猪源沙门菌的分布、血清型及其耐药性尚未有相关分析。因此,本试验选取江苏省泰兴市部分规模化猪场和屠宰厂的猪粪样品,进行沙门菌的分离鉴定和药物敏感性分析,以便为临床用药和公共卫生安全提供指导和帮助。
1 材料与方法
1.1 标准菌株 阳性参考菌株沙门菌(BNCC202004001)、质控菌株大肠杆菌(ATCC25922、ATCC35218),均由江苏农牧科技职业学院传染病实验室保存提供。
1.2 主要试剂 酵母提取物、胰蛋白胨、琼脂粉、琼脂糖、木糖赖氨酸-4琼脂基础(Xylose lysine tergitol-4 agar base,XLT-4)、四硫磺酸钠煌绿增菌液基础(Sodium tetrathiosulfonate brilliant green enrichment liquid base,TTB)、缓冲蛋白胨水(Buffered peptone water,BPW)、Mueller-Hinton 琼脂、NaCl、甘油、DL2 000 Marker、2×TaqMaster Mix、50×TAE电泳缓冲液和Gold-viewⅠ型核酸染色剂等,均购自上海万生昊天生物技术有限公司。
1.3 药敏纸片 氨苄西林(Ampicillin,AMP)、头孢氨苄(Cephalexin,CL)、头孢唑啉(Cefazolin,CZ)、头孢噻肟(Cefotaxime,CTX)、头孢曲松(Ceftriaxone,CRO)、头孢吡肟(Cefepime,FEP)、亚胺培南(Imipenem,IPM)、氨曲南(Aztreonam,ATM)、链霉素(Streptomycin,S)、卡那霉素(Kanamycin,K)、庆大霉素(Gentamicin,GM)、阿米卡星(Amikacin,AK)、四环素(Tetracycline,E)、多西环素(Doxycycline,D)、氟苯尼考(Florfenicol,FL)、萘啶酸(Naphthyric acid,NA)、诺氟沙星(Norfloxacin,NOR)、环丙沙星(Ciprofloxacin,CIP)、恩诺沙星(Enrofloxacin,ENR)、氧氟沙星(Ofloxacin,OFX)、依诺沙星(Enoxacin,ENX)、加替沙星(Gatifloxacin,GAT)、复方新诺明(Compound sulfamethoxazole,SXT)和甲氧苄啶(Trimethoprim,W),共24种药敏纸片,均购自南京全隆生物技术有限公司,药敏纸片购回后在-20 ℃保存,并在有效期内使用。
1.4 主要仪器 PCR基因扩增仪(K960)、高速离心机(TGL-16gR)、核酸电泳槽(JY-SCZ7)、紫外分光光度计(722)、电泳仪(Power Pac Basic)、恒温培养箱(HPX-9082MBE)、鼓风干燥箱(GZX-914MBE)、电子天平(HZF-A+300)、双人超净工作台(SW-CJ-2FD)、冰箱(BCD-238S)、干式恒温器(MK200-4)、超低温储存箱(DW-HL540)、pH计(FE20)、压力蒸汽灭菌锅(LDZX-400)、显微镜(DM500)、恒温培养振荡器(ZWY-100H)和涡旋混合器(MX-S),均由江苏农牧科技职业学院传染病实验室提供。
1.5 样品采集 2021年1月,选取江苏省泰兴市24个规模化猪场和2个屠宰厂,无菌采集猪粪样品,每个猪场各采集30份、每个屠宰厂各采集90份,共计900份,每份猪粪样品1 g左右,分别置于放有0.5 mL BPW的灭菌离心管中,置于含冰袋的泡沫箱内,密封保存,及时运回实验室处理。
1.6 猪源沙门菌的分离鉴定 将装有粪便样品的离心管,于37 ℃、120 r/min摇床培养8 h;取100 μL含样品的BPW培养基,于37 ℃、220 r/min摇床培养6 h;取300 μL含样品的BPW培养基,加入3 mL TTB,于42 ℃、180 r/min摇床培养12 h,取培养菌液划线于XLT-4平板,37 ℃培养箱中培养24 h,观察菌落特点,并挑取单菌落进行革兰染色镜检和PCR鉴定。
依照GenBank中已公布的沙门菌invA基因序列,利用Primer Premier 5.0软件设计特异性引物,引物序列为:invA-F:5′-GTGAAATTATCGCCACGTTCGGGCAA-3′,invA-R:5′-TCATCGCACCGTCAAAGGAAC-3′。PCR反应体系:2×TaqMaster Mix 12.5 μL,invA-F(10 nmol/L)1 μL,invA-R(10 nmol/L)1 μL,ddH2O 10.5 μL,挑取部分单个菌落置于 PCR 反应管,涡旋振荡 15 s,离心后进行 PCR 反应。PCR反应程序:94 ℃预变性 2 min;98 ℃变性 10 s,58 ℃退火 20 s,72 ℃延伸 20 s,30个循环;72 ℃延伸 6 min[4]。以沙门菌BNCC202004001作为试验用阳性对照菌株,取 5 μL PCR 反应产物,经 1.0% 琼脂糖凝胶电泳,于凝胶成像系统观察结果。
1.7 猪源沙门菌的血清型鉴定 将PCR分离鉴定结果为沙门菌的菌株接种于LB液体培养基,37 ℃、220 r/min 摇床培养,当菌液于600 nm处的光密度(Optical density,OD600 nm)值为 0.9 时,取 200 μL 菌液与 200 μL 80%甘油混合,编号后保存于-80 ℃超低温冰箱,每株菌株保存4管备用。取干净玻片,标记2个试验区域,1个试验区内滴加1滴A-F多价O型血清,另1个试验区作为对照区域滴加1滴生理盐水,挑取1满环待测菌液,与A-F多价O型血清充分混匀,判定结果,出现凝集现象为阳性反应。然后,用O2、O3、O4、O7、O8、O9、O10和O11因子分别进行血清凝集试验。根据试验结果,判定分离菌株的O群的血清型。同样操作,进行多价鞭毛抗原H的鉴定。根据国家沙门菌检验标准[5],最后确定沙门菌的血清型。
1.8 猪源沙门菌的药物敏感性试验 将保存备用的沙门菌的菌株分别划线接种于LB固体培养基平板,37 ℃培养箱培养20 h。挑取 LB 固体培养基平板上的单个菌落,再接种于 LB 液体培养基,37 ℃摇床培养至 0.5个麦氏比浊单位[6]。取200 μL LB 液体菌液均匀涂抹接种于 Mueller-Hinton 固体培养基平板,晾干后均匀贴药敏纸片,37 ℃培养箱培养 20 h。用游标卡尺量取抑菌圈直径,根据《纸片法抗菌药物敏感试验标准(WS/T 125—1999)》[7]判定药敏试验结果。
2 结果
2.1 猪源沙门菌的分离鉴定 分离的猪源沙门菌在XLT-4固体培养基平板上形成表面光滑、边缘整齐、大小1~2 mm的黑色菌落,经革兰染色镜检可观察到长杆状、红色的沙门菌形态;PCR电泳结果显示,疑似沙门菌在566 bp处均有特异性条带,可鉴定为沙门菌。经统计,共有52株分离菌株判定为猪源沙门菌,分离率为5.78%(52/900)。其中,在24个规模化猪场采集的720份样品中,分离到沙门菌49株,分离率为6.81%,且各猪场间分离率存在较大差异,最高的猪场分离率为20.00%,最低的猪场没有分离到沙门菌菌株;在2个屠宰厂采集的180份样品中,分离到沙门菌3株,分离率为1.67%,相比规模化猪场较低。
2.2 猪源沙门菌的血清型鉴定 结果显示,52株沙门菌分离菌株共鉴定出7种血清型,其中德尔卑沙门菌(SalmonellaDerby)有19株(占36.54%),里森沙门菌(SalmonellaRissen)有15株(占28.85%),鼠伤寒沙门菌(SalmonellaTyphimurium)有6 株(占11.54%),伦敦沙门菌(SalmonellaLondon)有5株(占9.62%),纽兰沙门菌(SalmonellaNewlands)有3株(占5.77%),纽波特沙门菌(SalmonellaNewport)和罗米他沙门菌(SalmonellaLomita)各2株(各占3.85%);24个规模化猪场中有7个猪场分离的沙门菌有2种及以上血清型,而2个屠宰厂分离的沙门菌分别只有1种血清型。
2.3 猪源沙门菌的药物敏感性试验
2.3.1 猪源沙门菌的耐药率 52株猪源沙门菌分离菌株对24种抗菌药物的耐药率差异较大,具体耐药率及其分布情况如表1和图1所示,分离菌株对多西环素(D)、甲氧苄啶(W)、四环素(E)、氨苄西林(AMP)和氟苯尼考(FL)5种药物耐药率均超过80.00%,最高的达98.08%(多西环素);对头孢噻肟(CTX)、头孢曲松(CRO)、头孢吡肟(FEP)和氧氟沙星(OFX)4种药物完全或中度敏感。从耐药的抗菌药物种类分析,52株猪源沙门菌分离菌株对四环素类、磺胺类、青霉素类和酰胺醇类抗菌药物耐药严重,至少超过70.00%;对头孢菌素类和喹诺酮类抗菌药物较为敏感。
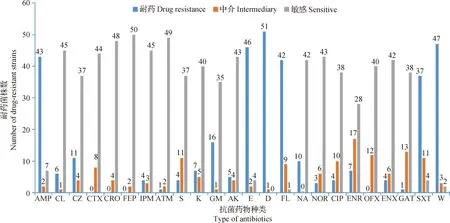
图1 猪源沙门菌分离菌株对不同抗菌药物的耐药率

表1 52株猪源沙门菌分离菌株对不同抗菌药物的耐药率
2.3.2 不同猪源沙门菌分离菌株对抗菌药物的耐药性 不同血清型猪源沙门菌分离菌株对所测抗菌药物的耐药性结果如表2所示,19 株德尔卑沙门菌(S.Derby)对1~20种抗菌药物耐药,15株里森沙门菌(S.Rissen)对0~12种抗菌药物耐药,6 株鼠伤寒沙门菌(S.Typhimurium)对6~16种抗菌药物耐药,5 株为伦敦沙门菌(S.London)对0~10种抗菌药物耐药,3株纽兰沙门菌(S.Newlands)对0~3种抗菌药物耐药,2株纽波特沙门菌(S.Newport)对所测抗菌药物均无耐药,2 株罗米他沙门菌(S.Lomita)对2~4种抗菌药物耐药。
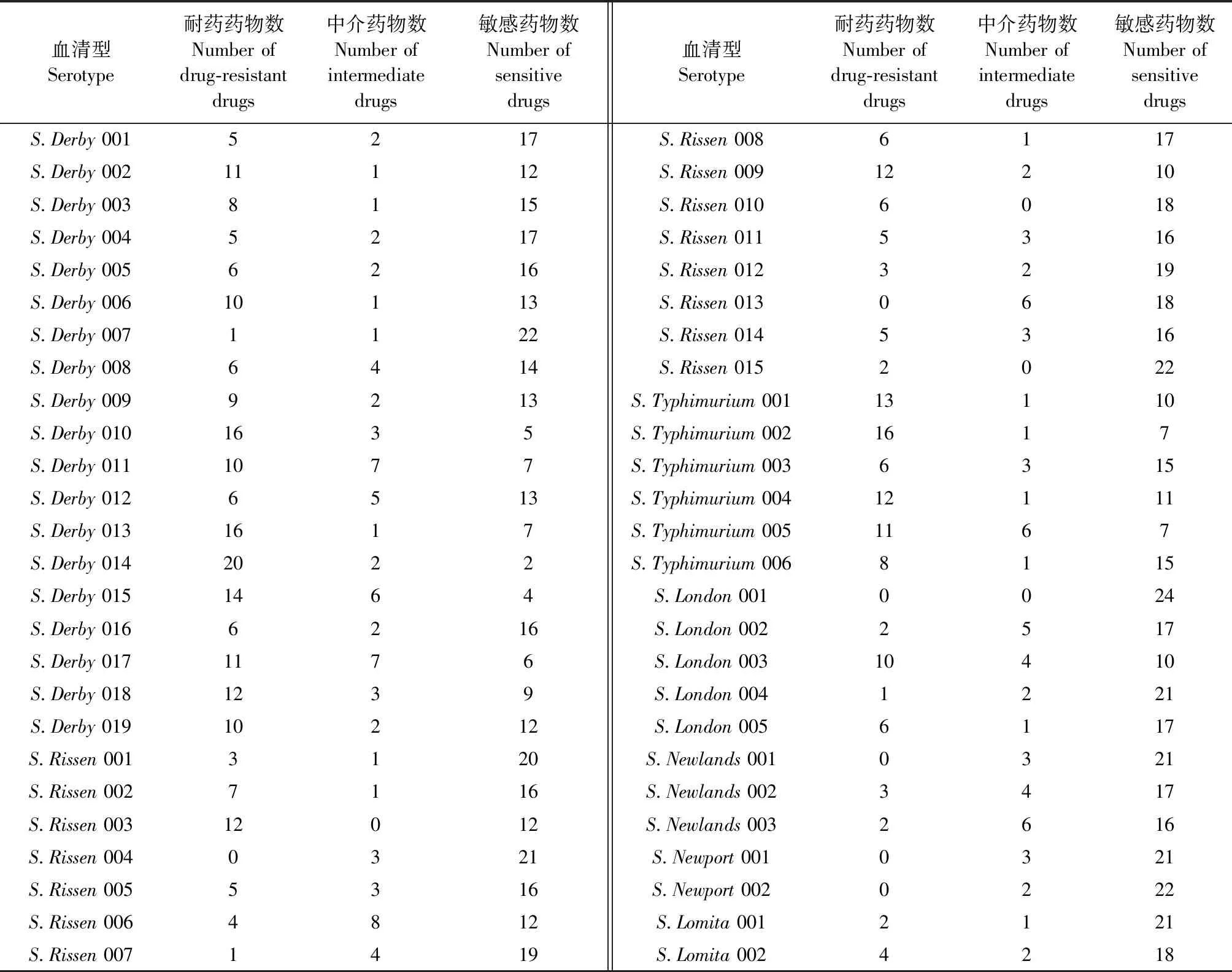
表2 不同血清型猪源沙门菌分离菌株对抗菌药物的耐药性
2.3.3 不同猪源沙门菌分离菌株对抗菌药物的多重耐药性 52株猪源沙门菌分离菌株对9类抗菌药物的多重耐药情况如图2所示,共有39株猪源沙门菌具有多重耐药性,占比75.00%,耐药的药物种类为3~7类,有19株菌株对5类以上抗菌药物多重耐药,有8株菌株对4类抗菌药物多重耐药,有12株菌株对3类抗菌药物多重耐药。
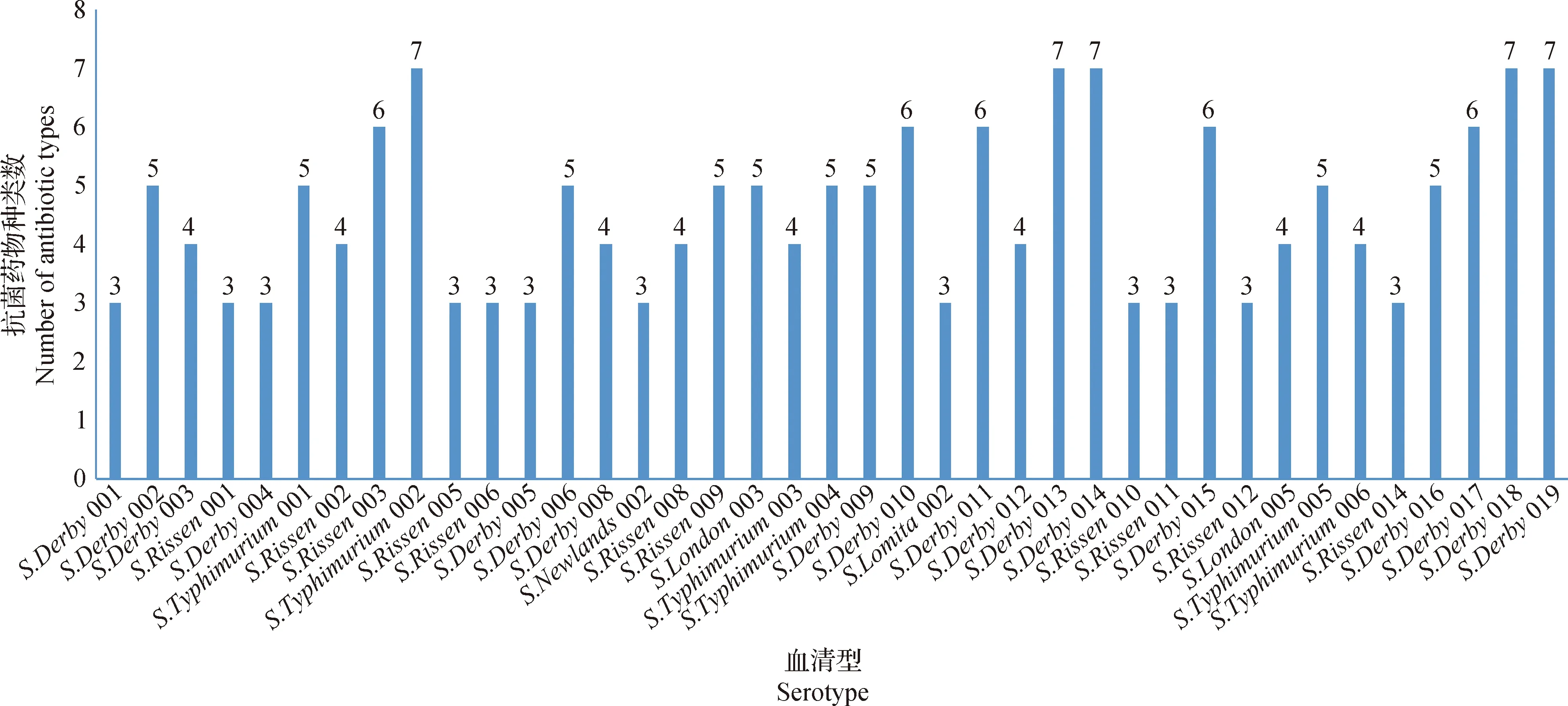
图2 39株猪源沙门菌菌株对 9 类抗菌药物的多重耐药分析
3 讨论
本试验采用BPW培养基进行预增菌,利用TTB培养基选择性增菌,然后划线于XLT-4培养基平板,挑取典型菌落,进行PCR扩增鉴定,可明显提高沙门菌检出率。从泰兴市采集的900份猪粪样品中分离出沙门菌52株,分离率为5.78%;各采样地点的分离率差异较大,最高的猪场沙门菌分离率为20.00%,最低的猪场未分离到沙门菌菌株;52株菌株中共鉴定出7种血清型,其中德尔卑沙门菌(S.Derby)和里森沙门菌(S.Rissen)的分离率分别为36.54%和28.85%,是本试验分离菌株的优势血清型,而鼠伤寒沙门菌(S.Typhimurium)占比为11.54%。总体来看,本试验中对泰兴市猪源沙门菌分离率较高,结果与张毅等[8]2018年对四川省规模化猪场沙门菌的分离率(6.6%)相近;血清型结果与方忠意等[9]2019年在河南省5个市生猪屠宰厂抽检结果以德尔卑沙门菌为优势血清型一致,也跟东南亚国家2017年猪源沙门菌的优势血清型为肠炎沙门菌、德尔卑沙门菌和鼠伤寒沙门菌数据相近[10]。猪源沙门菌在泰兴市养猪业中感染率较高,且不同养殖场的饲养管理水平、药物预防不同,导致感染率差异较大,需要各养殖场加强饲养管理和注重药物预防。
本试验的52株猪源沙门菌分离菌株对24种抗菌药物的耐药率存在差异,其中对四环素类药物耐药率最高,尤其是对多西环素(D)耐药率达到98.08%,其次是磺胺类、青霉素类和酰胺醇类抗菌药物耐药严重,对头孢菌素类和喹诺酮类抗菌药物较为敏感;不同血清型分离菌株的耐药情况存在一定的差异,其中德尔卑沙门菌(S.Derby)耐药率最高,其次为鼠伤寒沙门菌(S.Typhimurium)、里森沙门菌(S.Rissen)和伦敦沙门菌(S.London),最低为纽兰沙门菌(S.Newlands)、纽波特沙门菌(S.Newport)和罗米他沙门菌(S.Lomita);分离菌株的多重耐药情况也较严重,共有39株猪源沙门菌菌株对9类抗菌药物具有多重耐药性。这与吴荔琴等[11]在广东省对2014—2016年广州市屠宰厂分离的沙门菌耐药试验结果相符合,与张海等[12]2019年在贵州省某规模化猪场猪源沙门菌分离菌株的耐药情况相近。因此,泰兴市养殖场平时要加强对猪沙门菌的预防用药,注意穿梭用药和定期更换药物种类,必要时需要结合药敏试验结果来综合考虑预防和治疗方案。根据本试验结果,建议泰兴市在治疗猪沙门菌病时,可选择头孢菌素类和喹诺酮类抗菌药物治疗,效果将较为理想,如头孢吡肟等抗菌药物。
