蜡样芽胞杆菌肠毒素FM(CwpFM)流行情况及其作用机制的研究进展
2023-12-01朱要宏王九峰杨贵燕
单 强, 刘 宁, 王 雪, 朱要宏, 王九峰, 杨贵燕
(中国农业大学动物医学院, 北京 海淀 100193)
蜡样芽胞杆菌是一种存在于食物、土壤和环境中的食源性致病菌,能形成耐高温、脱水和其他物理压力的内生孢子来抵抗恶劣环境。蜡样芽胞杆菌也是一种常见的食品生产环境细菌,其孢子无法被巴氏消毒杀死且具有很强的黏附性,可传播到各种食品中,对食品安全和人类健康造成极大威胁。当蜡样芽胞杆菌作为一种机会性致病菌进入动物体内,可能会导致严重的感染[1]。但蜡样芽胞杆菌并不都是致病菌,在合理的毒性范围内可作为益生菌来使用[2]。如何区分菌株是益生菌还是致病菌是一个关键问题。有研究发现,蜡样芽胞杆菌所分泌的肠毒素FM(Enterotoxin FM,EntFM),也被称作细胞壁肽酶FM(Cell wall peptidase FM,CwpFM),可作为生物标记物来区分致病菌,但关于CwpFM毒性作用机制的研究目前仍不足[3]。本综述总结了蜡样芽胞杆菌及其CwpFM的流行情况,整理了其作用机制的研究进展,为进一步了解CwpFM的毒性作用提供参考依据,为探究CwpFM的作用机制提供新思路。
1 蜡样芽胞杆菌毒力因子CwpFM
蜡样芽胞杆菌通过产生一系列毒力因子,包括成孔毒素、呕吐毒素、溶血素、肠毒素、蛋白酶和磷脂酶等,引发呕吐或腹泻型食物中毒(图1)[4]。蜡样芽胞杆菌可以分泌溶血素BL(Hemolysin BL,Hbl)和非溶血型肠毒素(Nonhemolytic enterotoxin,Nhe)2种成孔毒素,Hbl和Nhe为三组分组成毒素,有研究发现,这2种毒素通过在细胞膜上打孔导致钾离子外流,激活含NLR家族Pyrin域蛋白3(NLR family pyrin domain-containing 3,NLRP3)炎性小体进而诱导免疫应答[5,6]。细胞毒素K(Cytotoxin K,Cyt K)被认为是引起腹泻综合征的潜在致病因子,有研究发现,其对人结肠腺癌细胞Caco-2有很强的毒性[7]。呕吐毒素(Cereulide)是一种小分子亲脂性十二环肽,结构性质稳定,能耐高温和蛋白水解,并可在酸性环境下存活。溶血素I是热不稳定蛋白,其溶血活性可被胆固醇抑制,而溶血素II和溶血素III是不依赖胆固醇的溶血素。溶血素II有孔形成活性,可通过活化Caspase3或Caspase8诱导小鼠巨噬细胞和人单核细胞凋亡[8]。Agata等在1995年发现肠毒素T,其在大肠杆菌中的转化产物表现出Vero细胞毒性,且在血管通透性测定中呈阳性,注射小鼠后可致死[9]。CwpFM是一种蜡样芽胞杆菌潜在的细胞壁肽酶,可维持细菌形态和运动性,与细菌生物膜形成、上皮细胞粘附、巨噬细胞空泡化和细菌毒力有关[10]。有研究表明,致病菌株的CwpFM含有一段特定的固有无序连接子,位于细菌Src同源3结构域3(Three bacterial Src homology 3 domains,SH3b3)和催化新型脂蛋白C/蛋白量为60 kDa(New lipoprotein C/protein of 60 kDa,NLPC/P60)结构域之间,能够作为一个标记来很好地区分致病性菌株和非致病性菌株[3]。
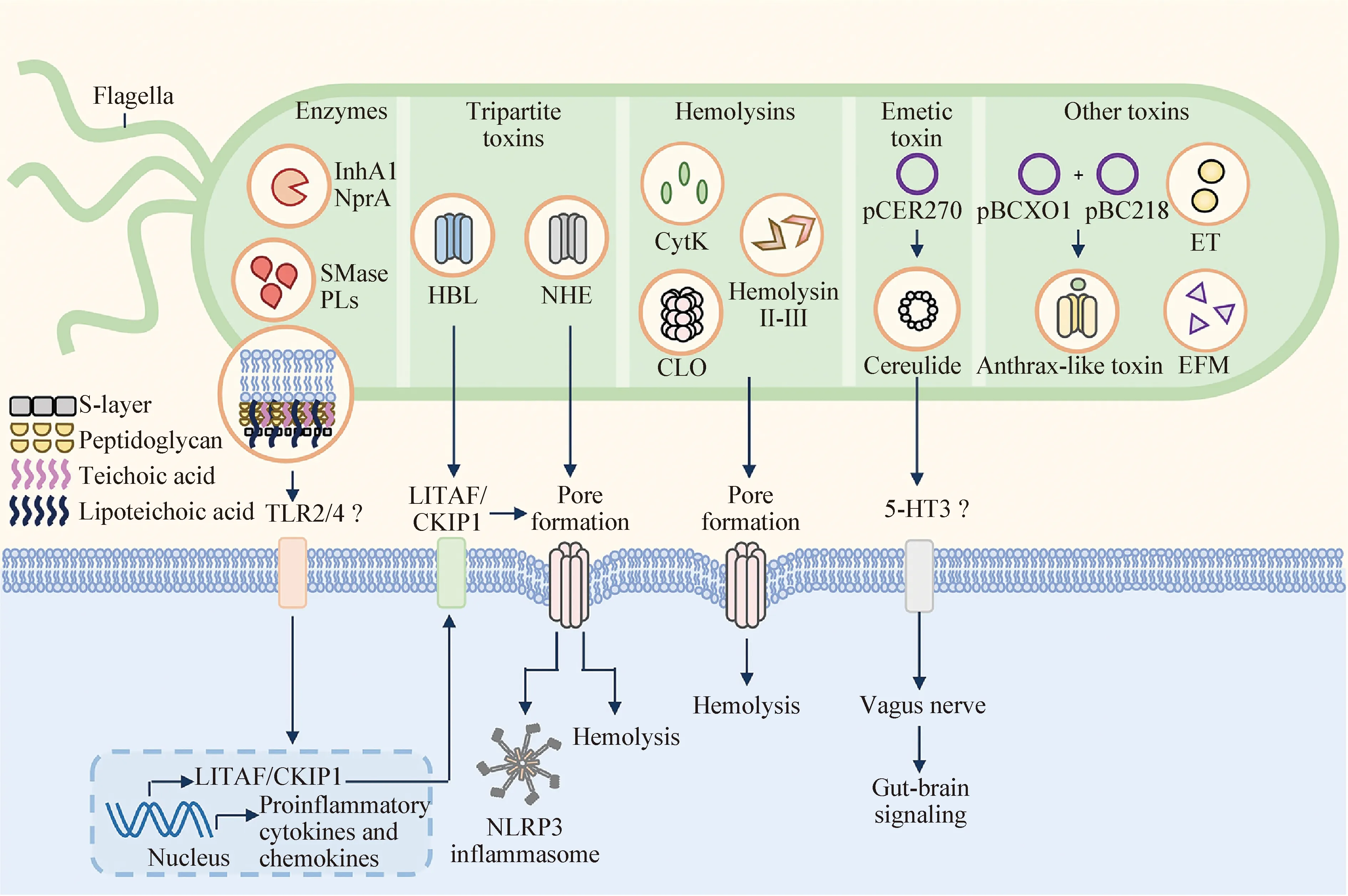
图1 蜡样芽胞杆菌的毒力因子[4]
2 蜡样芽胞杆菌及其CwpFM的流行情况
蜡样芽胞杆菌是一种常见的食源性致病菌,在我国乳制品中的分离率呈上升趋势[11]。有研究发现,我国的牛奶和乳制品中蜡样芽胞杆菌的分离率介于10.80%~42.22%,CwpFM的检测率介于71.93%~100%[12-17]。而在即食食品、生菜和环境中,蜡样芽胞杆菌的分离率介于35.12%~40.00%,食物和环境中CwpFM的分离率高达91.20%~100%[18,19]。由此可见,我国乳制品和食品中蜡样芽胞杆菌的分离率很高,且这些蜡样芽胞杆菌大部分都携带CwpFM基因。在韩国的食品Sunsik中,蜡样芽胞杆菌的分离率高达35.00%~41.94%,CwpFM的分离率为100%[20,21]。而在发酵酒精饮料和豆豉发酵产品中,蜡样芽胞杆菌的分离率介于29.09%~53.41%,CwpFM的分离率介于81.60%~100%[22,23]。从绿叶莴苣、食品、环境和临床样本中所分离的597株蜡样芽胞杆菌的CwpFM分离率介于77.21%~86.14%[24-26]。从哥伦比亚的食物、木薯淀粉和食品粉末样品中,共分离得到262株蜡样芽胞杆菌,CwpFM的分离率介于62.00%~92.90%[27-29]。而在其他国家的食品和环境中,CwpFM的分离率也同样高达70.60%~100%[30-32]。不同地区食品和环境中蜡样芽胞杆菌及其CwpFM的分离情况如表1所示,蜡样芽胞杆菌在国内和国外食物中的分离率均很高,这可能对人类食品造成一定的安全隐患,且大部分蜡样芽胞杆菌中都携带有CwpFM基因。

表1 不同地区食品和环境中蜡样芽胞杆菌及其CwpFM的分离情况
3 蜡样芽胞杆菌CwpFM的作用机制
CwpFM基因长度为1 269 bp,编码分子量为45 kDa的蛋白质。CwpFM在动物模型中可引起肠毒素症状,可增加家兔血管通透性,对小鼠有致死作用,并表现出Vero细胞毒性,但其不具备溶血酶活性和卵磷脂酶活性[33]。为了诱导有效感染,蜡样芽胞杆菌必须在宿主肠道定殖并持续存在。有研究表明,蜡样芽胞杆菌黏附于上皮细胞,并在固液和液气界面形成生物膜[34]。生物膜是一种多细胞细菌群落,由附着在细胞表面并嵌入胞外聚合物基质中的微生物组成。细菌和真核细胞的黏附通常对于易感宿主的感染至关重要。有研究发现,与野生型蜡样芽胞杆菌菌株相比,敲除CwpFM基因的菌株对Hela细胞的黏附力降低了10倍,且与野生型菌株相比,敲除CwpFM基因的菌株传播能力下降,迁移区直径减少了约73.50%;而回补菌株与野生型菌株具有相同的传染力[10]。
蜡样芽胞杆菌CwpFM是一种潜在的细胞壁肽酶,是NLPC/P60肽酶家族中的一员。NLPC/P60作为炭疽杆菌的一种毒力因子,是炭疽杆菌分泌体的一部分,可在被感染动物的血液中检测到[35]。有研究报道,CwpFM基因是以单拷贝形式存在于蜡样芽胞杆菌群大多数成员的染色体上[24]。NLPC/P60蛋白是一个可以修饰细胞壁的细胞壁肽酶家族,其大多数蛋白除含有自身催化位点外,还有与细胞壁的多肽、碳水化合物和脂质相互作用所必需的结构域,如Src同源3(Src homology 3,SH3)、溶解素基序(Lysin motif,LysM)和肽聚糖结合结构域。细菌细胞壁肽酶参与多种过程,如生长过程中肽聚糖的修饰、细胞壁的周转、细胞分裂过程中子细胞的分离和运动、细菌的黏附和侵袭以及生物膜的形成等,从而直接影响细菌的致病性[36]。细菌的细胞壁是由肽聚糖组成的复杂结构。肽聚糖的主要结构特征是由短肽交联的线性聚糖链,通过承受膨胀来保持细胞的完整性。在蜡样芽胞杆菌中,非交联的茎附着的核心结构是L-丙氨酸-γ-D-谷氨酸-L-赖氨酸-D-丙氨酸-D-丙氨酸(L-Ala-γ-D-Glu-L-Lys-D-Ala-D-Ala),在外界环境的影响下,肽聚糖内核进行O-乙酰化和N-去乙酰化等化学修饰,也可以结合甘氨酸和非经典D-氨基酸。细胞壁的生物合成受到高度调控,且其可塑性需要通过不断调整来适应细菌细胞周期或不断变化的环境,保证细胞壁不被破坏[37]。细菌细胞壁水解酶参与细菌的黏附和侵袭,在宿主细胞和生物被膜形成的起始阶段中存在,与细菌的致病性有关,由其产生的细胞壁片段可作为信号分子来触发细菌信息交流、免疫反应和抗生素耐药性的产生[38]。
有研究证明,蜡样芽胞杆菌的CwpFM影响细菌对上皮细胞的黏附和生物膜的形成,诱导巨噬细胞空泡化[10]。Boonchai等发现,CwpFM蛋白刺激会使Vero细胞的细胞膜发生形态学变化,且CwpFM蛋白具有细胞毒性,CwpFM基因中所含有的4个重复序列“TCAAAC”可能与蜡状芽胞杆菌的细胞毒性有关[39]。来自致病蜡样芽胞杆菌菌株的CwpFM含有20个内在无序的特定片段,插入SH3b3和催化NLPC_P60结构域之间,可作为生物标记物来区分蜡样芽胞杆菌的致病性和非致病性[3]。然而,现阶段对CwpFM在蜡样芽胞杆菌感染中的具体作用途径研究甚少。
4 小结
综上所述,蜡样芽胞杆菌广泛存在于食物和环境中,给人类和动物的健康和食品安全造成极大的隐患。当蜡样芽胞杆菌通过环境接触到食物后,可产生内生孢子且很难被杀死。当其被人类或动物食用后会发生腹泻或呕吐等多种疾病。而目前在蜡样芽胞杆菌产生的肠毒素中,大多数的研究集中于Hbl和Nhe。本文对CwpFM的流行情况进行总结后发现,CwpFM在蜡样芽胞杆菌中携带率非常高,而现有的研究对其作用模式的分子描述尚不深入。要想充分了解蜡样芽胞杆菌的危害,就必需了解其毒力因子的致病机制,因此需要对CwpFM的作用机制进行深入探究,从而更加全面认识CwpFM,并将其可能产生的危害降到最低,以保障人类的健康。
