补阳还五汤对脑缺血再灌注损伤小鼠RhoA/ROCK通路的影响
2023-12-01邢烨锋赵武霞欧志杰张天艾胡玥
邢烨锋,赵武霞,欧志杰,张天艾,胡玥
(1.南通市通州区中医院检验科,江苏 南通 226300;2.南京中医药大学中医学院·中西医结合学院,江苏 南京 210023;3.常熟市中医院神经内科,江苏 常熟 215516)
缺血性中风约占所有中风的80%,是一种高发病率和高死亡率的脑血管疾病[1]。研究发现,脑缺血后小胶质细胞迅速增殖活化,参与脑缺血再灌注损伤的病理过程[2-3],对缺血后损伤发挥修复和加剧的双重作用[4]。P2Y12受体是一种仅限于中枢神经系统小胶质细胞代谢的嘌呤受体[5],与神经病理和炎症相关[6]。此外,激活的GTP-RhoA/ROCK2信号通路和提高的磷酸化p38丝裂原活化蛋白激酶(MAPK)水平促进炎症损伤,在抑制P2Y12受体后可得到改善[6]。清代名医王清任《医林改错》中的补阳还五汤在缺血性脑卒中的临床防治中被广泛运用[7]。现代药理研究发现,补阳还五汤可促进小胶质细胞抗炎介质的分泌,通过减轻炎症反应以减轻脑损伤[8-9]。然而,补阳还五汤对脑缺血再灌注损伤小鼠P2Y12受体介导的RhoA/ROCK信号通路的影响尚未见报道。因此,本研究拟通过构建脑缺血再灌注损伤小鼠模型,探讨补阳还五汤对小胶质细胞的极化以及P2Y12受体介导的RhoA/ROCK炎症信号通路的影响。
1 材料与方法
1.1 动物
健康C57BL/6J小鼠(SPF级)60只,雄性,6~8周龄,18~22 g,购自江苏集萃药康生物科技有限公司。实验动物许可证号:SYXK(苏)2018-0049。分笼饲养条件:自由进食、饮水,12 h光照和12 h黑暗交替循环,温度23~25 ℃,湿度40%~60%,适应性饲养1周后进行实验。本研究经南京中医药大学动物保护与伦理委员会批准(伦理编号:A21065),动物的饲养条件和实验程序均严格遵守实验动物管理委员会和伦理道德委员会规章制度。
1.2 补阳还五汤溶液制备方法
补阳还五汤由君药黄芪120 g,臣药当归6 g以及佐药赤芍4.5 g,川芎3 g,桃仁3 g,红花3 g,地龙3 g组成(生产批号:20220201,安徽桐化堂中药饮片科技有限公司),符合《中华人民共和国药典》2020版规定。取上述各味中药饮片混合加水浸泡1 h,水煎40 min后取药液,药渣同法再次煎煮,合并后浓缩为含生药2 g·mL-1的补阳还五汤水溶液,-20 ℃保存备用。
1.3 仪器与试剂
纯水仪(型号:Milli-Q Academic A10,美国Milipore公司);荧光显微镜[型号:IX73,奥林巴斯(中国)有限公司];高速冷冻离心机(型号:Vlicro CL21R,上海宝赛生物科技有限公司);冷冻切片机[型号:6250,达科为(深圳)医疗设备有限公司];化学发光底物(ECL)成像系统(型号:EI600,南京碧云天生物技术有限公司);低温离心机(型号:CENTRIFUGE 5424R,德国Eppendorf公司);实时荧光定量PCR仪(型号:7500,美国ABI公司);显影成像仪(型号:Tanon-4600,上海天能公司)。
MRS2395(货号:M5942,美国Sigma公司);2,3,5-氯化三苯基四氮唑蓝(TTC)染色剂(货号:T819366,中国医药集团上海化学试剂公司);Triton X-100(货号:T8200,北京索莱宝科技有限公司);4′,6-二脒基-2-苯基吲哚(DAPI)(货号:C1002,南京碧云天生物技术有限公司);BCA蛋白浓度试剂盒(货号:P0012,南京碧云天生物技术有限公司);线栓(货号:9070001701,瑞沃德生命科技有限公司);Trizol(货号:15596026,美国Thermo公司);逆转录试剂盒(货号:11119ES60,上海翌圣生物科技有限公司);SYBR染料(货号:11201ES03,上海翌圣生物科技有限公司);兔抗Iba1(货号:LKG5732,日本Wako公司);山羊抗CD206(货号:ab64693)、P2Y12抗体(货号:ab300140)、Alexa Fluor 488二抗(货号:ab150077)、Alexa Fluor 594二抗(货号:ab150116)、RhoA抗体(货号:ab187027)、CD16/32抗体(货号:ab215977)、ROCK抗体(货号:ab134181)、鼠抗P2Y12抗体(货号:ab184411)购自英国Abcam公司;p38 MAPK抗体(货号:8690S)、p-p38 MAPK抗体(货号:4511)购自美国CST公司;羊抗兔二抗IgG(货号:S0001)、羊抗鼠二抗IgG(货号:S0002)购自美国Affinity公司。
1.4 MCAO造模、分组与给药
将小鼠随机分为假手术(Sham)组、模型(MCAO)组、补阳还五汤低剂量(BYHW-L)组、补阳还五汤高剂量(BYHW-H)组、补阳还五汤高剂量+MRS2395(BYHW-H+MRS2395)组,每组6只。参考文献的实验方法构建MCAO模型[10],Sham组线栓不阻塞大脑中动脉。BYHW-L组、BYHW-H组在缺血24 h后每日分别给予补阳还五汤低、高剂量(6.5、26 g·kg-1)[11]处理,BYHW-H+MRS2395组小鼠除每日灌胃26 g·kg-1补阳还五汤外,将MRS2395溶于5%DMSO中,600 μg·d-1,腹腔注射,从术后前1 d开始,每日给药3次,共6 d。Sham组和MCAO组给予等体积生理盐水灌胃,共7 d。
1.5 神经功能评分
分别在术后清醒第0、24、48、72 h和第7天,参考Zea-Longa神经功能缺损评分标准[10],评估小鼠神经功能受损程度。评分标准:无神经功能缺陷,0分;提尾时阻塞侧前爪不能完全伸展,1分;行走时向阻塞侧转圈,2分;行走时向阻塞侧倾倒,3分;意识丧失,不能自主行走现象,4分。评分越高说明神经损伤越严重。
1.6 TTC染色
术后第7天,摘眼球取血后断头取脑,将脑组织切成约2 mm厚的冠状位脑片,置于1%TTC染色液中37 ℃避光孵育染色30 min,每5 min翻动1次使染色均匀,并拍照记录。经染色后有线粒体存活的正常组织呈玫瑰红色,梗死区域呈灰白色,且界限分明,易于剥离。用Image Pro Plus软件分析小鼠脑组织梗死体积和整个脑组织体积。梗死比=梗死体积/整个脑体积×100%。
1.7 免疫荧光双染色
取小鼠脑组织石蜡切片常规脱蜡至水,用柠檬酸钠抗原修复液微波加热10 min进行抗原修复,5%牛血清白蛋白(BSA)封闭后,分别加入M1型小胶质细胞表面标记物兔抗Iba1(货号:LKG5732)/鼠抗CD16/32(1∶200) (货号:ab215977),M2型小胶质细胞表面标记物兔抗Iba1/山羊抗CD206(1∶100) (货号:ab64693)以及兔抗Iba1/鼠抗P2Y12 (1∶200) (货号:ab300140),并4 ℃孵育过夜。第2天,加荧光二抗在37 ℃下孵育1 h,并用DAPI避光孵育10 min,封片置于暗盒中4 ℃保存。在荧光显微镜下观察样品。
1.8 qPCR检测
使用灭菌器械取各组小鼠脑组织,用Trizol进行RNA提取,参考RNA逆转录试剂说明书得到组织cDNA,-80 ℃保存备用。采用qPCR法进行扩增反应,然后运用2-ΔΔCt法分析目的基因相对表达量,PCR引物均由通用生物系统(安徽)有限公司合成提供,引物序列见表1。

表1 qPCR引物序列
1.9 蛋白提取及Western blot分析
取各组小鼠脑组织缺血区域,-80 ℃保存备用。磨碎的脑组织加入含有蛋白酶抑制剂和磷酸酶抑制剂的RIPA裂解液裂解,采用BCA测定法定量蛋白浓度,将Loading buffer加入蛋白中,100 ℃变性10 min。经过聚丙烯酰胺凝胶电泳(PAGE)分离蛋白质样品,并转移到聚偏二氟乙烯(PVDF)膜上。5%脱脂牛奶封闭后,分别加入鼠抗P2Y12(1∶500) (货号:ab184411)、RhoA(1∶5 000) (货号:ab187027)、ROCK(1∶1 000) (货号:ab134181)、p38 MAPK(1∶1 000) (货号:8090S)和GAPDH 一抗(1∶1 000) (货号:ab8245),4 ℃孵育过夜。次日洗膜后,加入HRP标记的二抗室温孵育1 h,再次洗膜后显影成像,使用Image Lab软件进行灰度分析。
1.10 统计学方法
2 结果
2.1 补阳还五汤促进MCAO模型小鼠神经功能的恢复
Longa评分越高,神经损伤越严重,结果如表2所示。Sham组小鼠无神经功能损伤,第0、24、48、72 h及第7天的神经功能评分均为0分;而第7天MCAO组评分显著升高(P<0.01),提示术后存在神经功能损伤。术后持续给药7 d后,与MCAO组相比,BYHW-H组神经功能评分下降(P<0.05),提示高剂量补阳还五汤促进神经功能恢复;与BYHW-H组相比,BYHW-H+MRS2395组并无显著性差异,但是评分低于BYHW-H组。

表2 各组神经功能评分
TTC染色结果如图1所示,术后第7天,取小鼠大脑经TTC染色,结果显示正常组织呈玫瑰红色,梗死区域呈灰白色。与Sham组相比,MCAO组梗死体积明显较大(P<0.01);与MCAO组相比,BYHW-L、BYHW-H组梗死体积减小(P<0.05,P<0.01);且BYHW-H组与BYHW-H+MRS2395组梗死体积并无显著性变化。综上所述,补阳还五汤可促进MCAO模型小鼠神经功能的恢复。
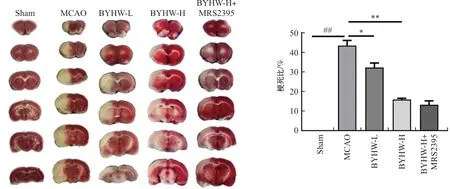
图1 补阳还五汤对MCAO小鼠脑梗死体积的影响
2.2 补阳还五汤促进小胶质细胞从促炎向抗炎的表型转化
如图2所示,术后第7天,小鼠大脑组织免疫荧光染色结果显示:与Sham组比较,MCAO组M1型小胶质细胞的标记物CD16表达显著上升(P<0.001);与MCAO组比较,BYHW-L、BYHW+H组CD16表达水平下降(P<0.05,P<0.01)。结果表明补阳还五汤抑制M1型小胶质细胞的增加。与BYHW-H组相比,BYHW-H+MRS2395组的CD16表达水平并无显著性变化。同时检测脑组织中M2型小胶质细胞。与Sham组相比,MCAO组小胶质细胞的M2型标记物CD206表达明显降低(P<0.01);与MCAO组比较,BYHW-L、BYHW+H组CD206表达水平上升(P<0.05,P<0.01)。结果表明补阳还五汤促进M2型小胶质细胞的增加。与BYHW-H组相比,BYHW-H+MRS2395组的CD206表达水平无显著变化。

注:A.小胶质细胞的M1型标记物CD16;B.小胶质细胞的M2型标记物CD206;与Sham组比较,##P<0.01,###P<0.001;与MCAO组比较,
小鼠MCAO术后第7天,采用qPCR进一步检测补阳还五汤对小胶质细胞标记物mRNA表达的影响。如图3所示,与Sham组相比,MCAO组小鼠脑组织中M2型小胶质细胞标记物CD206 mRNA和IL-10 mRNA表达增加(P<0.01,P<0.05),Arg-1 mRNA表达显著减少(P<0.001);与MCAO组比,BYHW-L、BYHW-H组CD206 mRNA、IL-10 mRNA(P<0.05,P<0.01)和Arg-1 mRNA(P<0.01)表达均上升。与BYHW-H组相比,BYHW-H+MRS2395组中3者表达水平无显著差异。与Sham组相比,MCAO组TGF-β mRNA表达明显上升(P<0.001);TGF-β mRNA的表达在BYHW-L、BYHW-H组中比在MCAO组中明显降低(P<0.01),给予MRS2395后TGF-β mRNA表达与BYHW-H组相似,与其余3组变化趋势不同,可能与P2Y12受体相关[12]。另外,与Sham组相比,MCAO组小鼠脑组织中M1型小胶质细胞标记物CD16 mRNA和CD86 mRNA表达增加(P<0.01);与MCAO组比,BYHW-L、BYHW-H组CD16 mRNA表达均显著下降(P<0.05,P<0.01),同时,BYHW-H组CD86 mRNA表达显著下降(P<0.01)。综上所述,补阳还五汤可能促进缺血/再灌注损伤后小胶质细胞表型转化,更深入的机制需进一步探索。
2.3 补阳还五汤对P2Y12介导的RhoA/ROCK通路的影响
为验证MRS2395对小胶质细胞P2Y12受体的抑制作用,对小鼠大脑组织进行免疫荧光双染色,如图4显示,在MCAO模型中,小胶质细胞中表达的P2Y12显著上升(P<0.01),并且其表达可被抑制剂MRS2395显著抑制(P<0.01),且BYHW-H也对小胶质细胞中P2Y12表达有显著的抑制作用(P<0.01)。
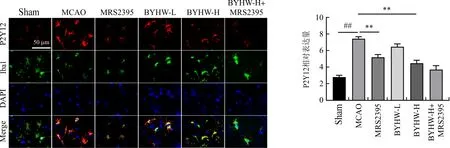
注:与Sham组比较;##P<0.01;与MCAO组比较,
MCAO术后第7天,Western blot检测小鼠大脑组织蛋白表达。结果显示,与Sham组相比,MCAO组P2Y12、RhoA、ROCK蛋白表达及p-p38 MAPK/p38 MAPK比值显著上升(P<0.001);与MCAO组相比,BYHW-L、BYHW-H组P2Y12、RhoA、ROCK蛋白表达及p-p38 MAPK/p38 MAPK比值显著降低(P<0.05,P<0.01)。与BYHW-H组相比,BYHW-H+MRS2395组中各指标影响无显著差异,如图5。

注:与Sham组比较;###P<0.001;与MCAO组比较,
3 讨论
中风死亡率很高,其中缺血性中风患者占总中风人数的80%以上[1]。由于缺血性中风复杂的病理生理过程和中风治疗的局限性[13],数百万中风幸存者面临罹患偏瘫等残疾的风险。补阳还五汤是治疗中风的经典名方,有补气活血,化瘀通络的功效。现代医学研究表明该方可以从减轻炎症反应、修复神经和降低氧化应激等多方面防治脑卒中[14],相关信号通路涉及经典的PI3K/AKT通路[15]、AMPK/mTOR通路[16]、Notch信号通路[17]等。
小胶质细胞是正常或受损大脑必不可少的常驻免疫细胞,而脑缺血后小胶质细胞不受控制或过度激活是有害的[18]。有研究表明,小胶质细胞在刺激下被极化而呈现某种表型,常见的表型有2类,即经典激活型M1表型,以及替代激活型M2表型。在脑缺血再灌注损伤等病理状态下,M1型小胶质细胞被过度活化,将加速分泌白细胞介素-β(Interleukin-β,IL-β)、肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)、白细胞介素-6(Interleukin-6,IL-6)等炎症因子,进一步扩大炎症反应,加深神经损伤程度;与之相对应,M2型小胶质细胞为抗炎表型,可抑制炎症反应[19]。本研究中,补阳还五汤干预7 d后,高剂量和低剂量组均能减少CD16+小胶质细胞,即M1型小胶质细胞数量,同时增加CD206+小胶质细胞,即M2型小胶质细胞数量。此外,补阳还五汤也可调控小胶质细胞标记物mRNA的表达。以上结果表明脑缺血再灌注损伤后,补阳还五汤的干预可促进小胶质细胞M1到M2的表型转化。
P2Y12是脑小胶质细胞中丰富的嘌呤能受体,也是小胶质细胞的特异性标志物[20]。在动物实验中,脑损伤或注射ATP/ADP引发的P2Y12激活可以调节早期小胶质细胞的反应,而P2Y12缺乏或抑制具有神经保护作用。敲除小胶质细胞中的P2Y12或给予P2Y12的抑制剂都显示出改善脑缺血后海马CA1区神经元活性和缓解神经元损伤的作用[21]。此外,抑制P2Y12能够预防M1型和M2型小胶质细胞向高浓度的ADP区迁移,可抑制促炎因子的释放[22]。在MCAO模型中,通过抑制小胶质细胞中依赖于P2Y12的通路可保护小鼠免受MCAO引起的缺血性损伤和神经损伤的影响[23-24]。综上所述,抑制小胶质细胞P2Y12受体的激活,可减少神经元死亡,避免血脑屏障破坏而发挥神经保护作用。
RhoA是小分子G蛋白家族的一员,参与许多细胞功能,包括细胞骨架重排、细胞运动、吞噬作用和细胞内运输[25]。RhoA在非活性形式(GDP结合)和活性形式(GTP结合)之间循环,其活性形式与下游效应分子相互作用调节细胞功能。RhoA最匹配的下游效应分子是Rho激酶(ROCK),在各种中枢神经系统疾病中观察到了RhoA/ROCK通路的激活,如中风和脑部炎症[26],抑制RhoA/ROCK信号可以减轻神经炎症和缺血后的神经元损伤[27-28]。研究表明,P2Y12参与的小胶质细胞活化中,抑制ROCK后可降低p38 MAPK的磷酸化水平,激活的RhoA/ROCK/p38 MAPK信号通路被P2Y12拮抗剂逆转[6,29],减轻神经病理损伤。
本研究中,MCAO可引发P2Y12介导RhoA/ROCK通路相关蛋白的高表达,而补阳还五汤的干预可降低其表达。MRS2395为P2Y12受体抑制剂,然而在本研究中,BYHW-H+MRS2395组与BYHW-H组相比并无显著差异,提示特异性拮抗P2Y12受体并不能抑制补阳还五汤的神经保护作用,表明在P2Y12介导的RhoA/ROCK通路之外,补阳还五汤还可通过其他途径发挥神经保护作用,体现了中药复方多靶点多途径作用的特点,但具体机制仍需要进一步深入探索。
